藻酸盐裂解酶对高黏液性肺炎克雷伯杆菌生物被膜的影响
2022-09-09肖红梅杨雨婷罗甫花
肖红梅,姜 维,刘 伟,杨雨婷,罗甫花*
(1. 邵阳学院附属第一医院,邵阳 422000;2. 长沙金域医学检验实验室有限公司,长沙 410205)
肺炎克雷伯杆菌(Klebsiella pneumoniae,KP)是一种革兰氏阴性的乳糖发酵杆菌,具有突出的荚膜[1],是医院感染常见的致病菌之一。2020年,全国细菌耐药性监测网公布的数据显示,革兰阴性菌中KP耐药率排第二[2]。根据KP毒力,可将其分为两大类,经典肺炎克雷伯菌(classicKlebsilla pneu-moniae)和高毒力肺炎克雷伯菌(hypervirulentKlebsilla pneumoniae,HvKP)。HvKP能够在年轻健康的个体中引起危及生命的社区获得性感染,包括肝脓肿并发眼内炎、脑膜炎、骨髓炎和坏死性筋膜炎,因此其与高发病率和死亡率有关[3]。据最新的国内多中心研究显示,黏液型KP的检出率可高达73.9%,并呈明显上升趋势[2]。经我院院感监测网统计,KP检出率在所有病原菌中排名第三。据美国国立卫生研究院统计,80%以上的人类微生物感染均由细菌生物被膜(bacterial biofilm,BF)引起[4]。BF是细菌的多耐药机制之一,通过屏障作用、耐药基因的表达等机制保护细菌逃逸宿主免疫和抗菌药物的杀伤作用,从而产生对抗菌药物高度耐药,给临床治疗带来难度,导致临床相关感染的难治性和复发性[5-6]。KP是容易形成BF的细菌之一,它有丰富的荚膜,依靠荚膜多糖和细菌分泌的黏附分子在物体表面形成生物被膜[7]。朱冰等[8]在临床分离KP的分布、耐药性及生物被膜形成能力的分析中发现,临床分离的KP具有较强的耐药性及生物被膜形成能力。KP生物被膜形成已成为感染性疾病中的常见问题。
目前对BF的研究较多,同时其也是抗生素感染研究的热点。国内外有不少研究通过联合用药提高生物被膜的清除率[9-10]。藻酸盐裂解酶(alginate lyase,AlgL)能特异性地降解藻酸盐,降低细菌的黏附性,影响生物被膜的形成。藻酸盐单克隆抗体能中和被膜内的藻酸盐,使抗生素被膜的密度降低,结构完整性被破坏,从而提高抗生素对被膜内细菌的杀伤力。Cho等[11]在铜绿假单胞菌生物被膜研究中发现,使用有效的AlgL可能是一个有前途的治疗策略 ;Lamppa等[12]和Tavafi等[13]的研究表明,AlgL有消除铜绿假单胞菌生物膜和提高抗生素疗效的机制。细菌因子RpoS是响应多重环境胁迫的调控因子,当细菌面临营养缺乏、环境压力或进入稳定期时,RpoS含量就会增加[14]。Tto等[15]研究发现,大肠杆菌生物被膜的耐药性升高与RpoS基因的表达增加相关,RpoS基因通过调节参与能量代谢基因、热休克蛋白基因、多药耐药性基因等影响大肠杆菌生物被膜的生长能力以及其对氨苄青霉素的抗性。Muhanad等[16]在对沙门菌生物被膜研究中阐述了关键基因RpoS对沙门菌生物被膜形成具有正调节作用,通过调节细胞内一些压力应答相关基因的表达在细菌抗胁迫中发挥功能。
目前,国内外AlgL对HvKP生物被膜和RpoS基因影响的研究少有报道。本研究以HvKP为试验材料,通过质谱鉴定、拉丝试验、荧光定量PCR试验、生物膜半定量试验来确定AlgL对HvKP的影响。
1 材料与方法
1.1 主要试剂和仪器
本项研究工作使用的仪器有全自动快速微生物质谱检测系统(型号:VITEK,法国生物梅里埃公司)、全自动微生物鉴定药敏分析系统(型号:VITEK-2 Compact,法国生物梅里埃公司)、veritiTM Dx PC扩增仪(美国Thermo公司)、ChemiDoc XRS+凝胶成像系统(美国Bio-Rad公司)、荧光定量PCR仪[appliedbiosystems QuantStudio 5(美国 Thermo公司)];核酸浓度检测仪器[NanoDropTM One超微量紫外-可见分光光度计美国Thermo公司)]。研究工作使用的酶和生化试剂见表1。
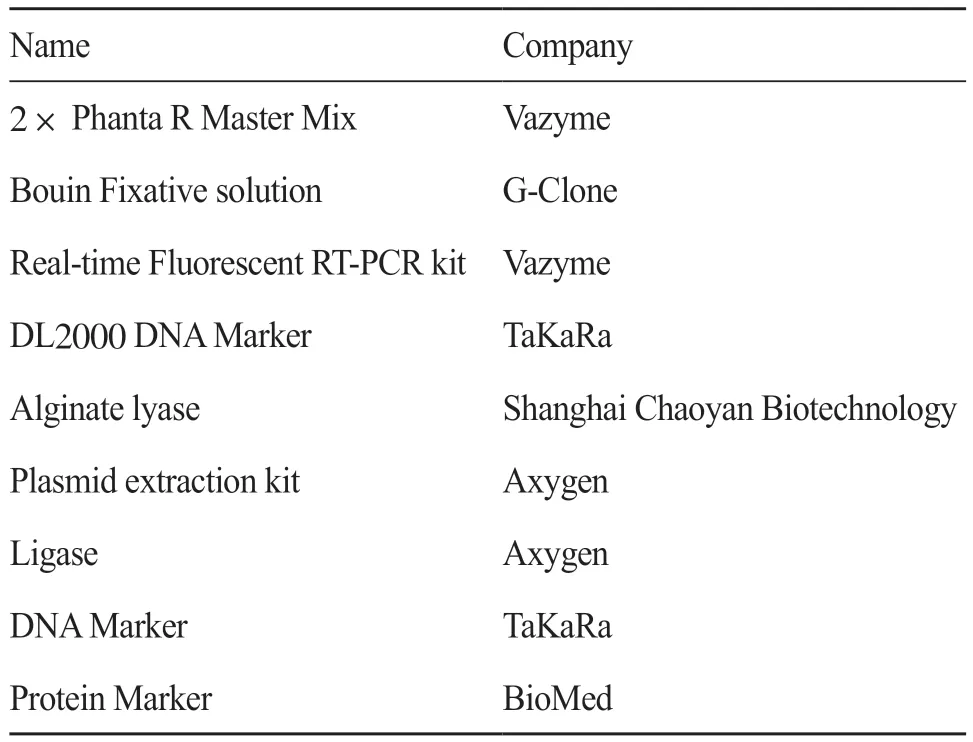
表1 研究所用酶与生化试剂Tab. 1 Enzymes and biochemical reagents for research
1.2 HvKP的临床分离
本试验所使用的HvKP分离于2019年1月—2020年12月邵阳学院附属第一医院感染性疾病患者的痰液样本,通过全自动快速微生物质谱检测系统VITEK进行鉴定,并将拉丝试验阳性的菌株定义为HvKP。质控菌株鲍曼不动杆菌(Acinetobncter baumannii)和KP购自北京市临床检验中心。本研究已通过伦理委员会的审查(批件号:2019007)。
1.3 药敏试验
从30位患者中对应分离鉴定的30株KP菌株依次编号为Sample 1~Sample 30组,再通过全自动微生物鉴定药敏分析系统对分离鉴定的KP菌株进行药敏试验。
1.4 拉丝试验
将菌株通过三段划线方法接种于血平板中,在37℃培养箱过夜培养后,用细菌接种环沾取单菌落向上挑起,如挑起的菌落黏液丝长度大于0.5 cm,则为拉丝试验阳性。
1.5 RpoS基因鉴定
本研究中引物由生工生物工程(上海)股份有限公司合成(表2)。使用Axygen公司的DNA提取试剂盒提取HvKP的DNA,以HvKP的DNA为模板,用RpoS的引物扩增目的基因。PCR反应体系:DNA模板1.0 μL(20 ng)、上游引物0.4 μL、下游引物 0.4 μL、2×SYBR Green Mix(2.5 mmol/L)10.0 μL、1×ROX dye 0.4 μL、无菌超纯水 7.8 μL,总体积20.0 μL。PCR反应条件 :95℃预变性10 min,95℃变性 15 s,60℃退火30 s,72℃延伸 2 min,40 个循环,72℃补平10 min,16℃保存。以鲍曼不动杆菌作为阴性对照组,试验组为Sample 1~Sample 30组。琼脂糖凝胶电泳检测PCR 扩增结果。
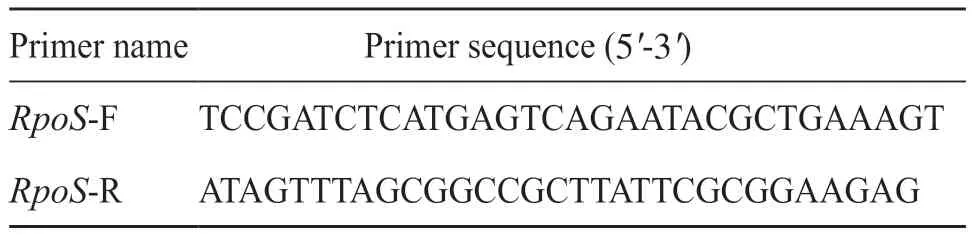
表2 目的基因扩增引物及其序列Tab. 2 Objective gene amplification primers and their sequences
1.6 抑制生物被膜形成试验
取对数生长期的菌落,先用生理盐水调节菌液含量为0.5麦氏浊度(McFarland,MCF),再进行稀释,其菌液与生理盐水的体积比为1:19。将菌液与设定梯度浓度的AlgL进行充分混匀,再将其转种到血平板上,继续置于培养箱培养至对数生长期,观察菌落的生长情况。用新鲜的麦氏(Mueller Hinton,MH)培养液调节上述培养后的各组菌液含量至3.33 MCF,并将其接种于96孔板中,每孔200 μL,每菌株设3个复孔,培养箱静止培养24 h。弃去上清液,每孔加200 μL MH培养液,培养箱静止培养24 h。弃去上清液,每孔加入200 μL结晶紫水溶液,染色2 min,弃去染液,用蒸馏水轻轻冲洗96孔板,直至阴性对照没有颜色(阴性对照组为MH培养液)。室温晾干,95%乙醇脱色。酶标仪测定波长为630 nm处的光密度(optical density,OD)。生物膜形成量的判断标准:将阴性对照的平均OD630nm与标准差之和定义为光密度阈值,将OD平均值连续3次显著性超过光密度阈值的待测菌株定义为产生物被膜菌株。
以鲍曼不动杆菌作为阴性对照组;Sample 7菌液为HvKP组;据Sample 7菌液添加不同量的AlgL依次命名为HvKP+AlgL(62.5 U)、HvKP+AlgL(312.5 U)、HvKP+AlgL(1 562.5 U)。
1.7 统计学分析
用GraphPad prism 8软件进行统计学分析,所有数据用平均数±标准差()表示。两组之间的比较采用t检验,多组之间的比较采用One-way analysis of variance检验,事后多重比较采用 Dunnett’s multiple comparisons test。P<0.05视为差异具有统计学意义。
2 结果与分析
2.1 临床特征
通过全自动快速微生物质谱检测系统,将从临床呼吸系统感染患者中分离的30株菌株的质谱图与KP的质谱图进行比较,30株菌株鉴定为KP。其临床特征包括性别、年龄、基础疾病、最高体温(表3)。KP感染患者为中老年人,同时患至少2种以上疾病,其中具有肺部感染临床特征患者占56.7%,符合KP的流行病学人群。

表3 临床呼吸系统感染肺炎克雷伯杆菌患者的临床特征Tab. 3 Clinical characteristics of HvKP in respiratory infections
2.2 药敏试验
通过全自动微生物鉴定药敏分析系统对30株KP菌株进行药敏分析,其耐药率结果见表4。我们通过药敏试验发现,氨苄西林的耐药率为100.0%,庆大霉素的耐药率为10.0%,头孢吡肟的耐药率为33.3%,复方新诺明的耐药率为13.3%,环丙沙星的耐药率为33.3%。同时发现,Sample 7组标本的耐药性最强,其对氨苄西林、庆大霉素、头孢吡肟、复方新诺明、环丙沙星5种抗生素均耐药。Sample 7组标本取自神经内科一位70岁患者,该患者被诊断出急性上呼吸道感染、急性肾盂肾炎、肾结石、肾功能不全、脓毒血症、2型糖尿病性酮症、输尿管扩张、电解质混乱、低蛋白血症、脑动脉供血不足、营养性贫血、慢性乙型病毒肝炎、女性盆腔积液等多种疾病。

表4 30株KP对抗菌药物的耐药率Tab. 4 Resistance of 30 strains of KP to antibacterial drugs
2.3 HvKP鉴定
本文通过拉丝试验发现,临床分离的30株KP其挑起的菌落黏液丝长度均大于0.5 cm,呈阳性,可判定为HvKP,结果见图1。

图1 拉丝试验Fig. 1 Drawing experiment
2.4 耐药基因RpoS检测
PCR检测基因结果如图2所示,各菌株在1 000 bp左右出现表达的条带,符合RpoS基因的大小,表明通过试验筛选的30株HvKP中包含RpoS基因。通过荧光定量PCR试验检测各组样本中的RpoS基因的表达量,发现阴性对照鲍曼不动杆菌组的循环数阈值(cycle threshold value,CT)为0,HvKP菌株组的CT为22.75±3.14,其中Sample 7组的CT为30.91,RpoS基因表达水平最高。HvKP是糖尿病患者细菌性肝脓肿的优势致病菌株[17],老年患者因为机体免疫功能下降,容易发生HvKP院内感染[18],RpoS基因与生物被膜的形成呈正相关[15]。综上所述,RpoS基因在宿主的表达可能与机体免疫功能水平相关。
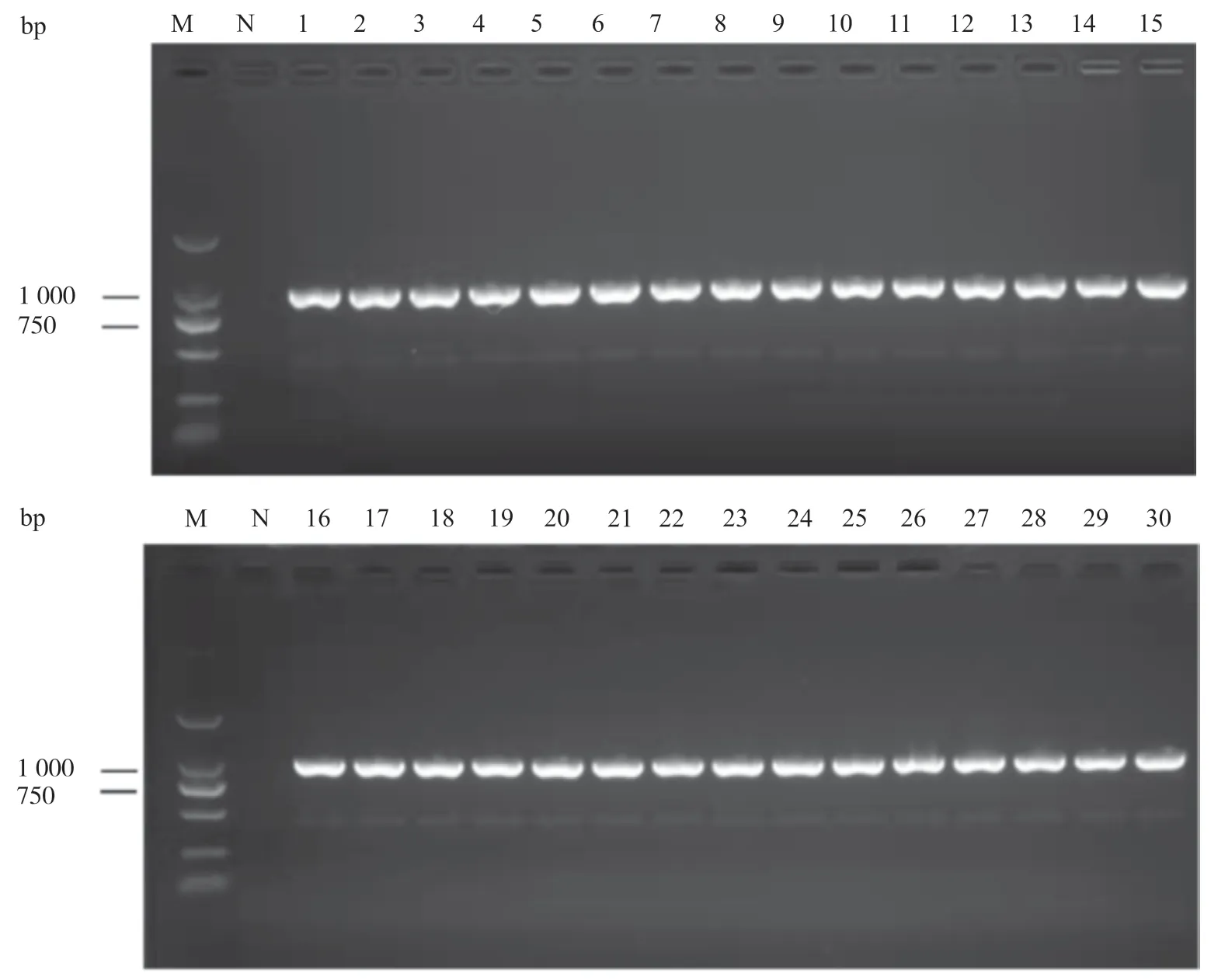
图2 RpoS基因凝胶电泳结果Fig. 2 The PCR amplification results of RpoS gene
2.5 AlgL对HvKP生物被膜的抑制作用
通过生物膜半定量试验对HvKP进行筛选,发现Sample 7 组菌液形成的生物被膜水平最高,将其命名为J-7组。将0、12.5、62.5、312.5、1 562.5 U的AlgL与J-7组菌株共孵育后进行生物膜半定量试验,生物膜半定量试验结果如图3所示。试验发现,与阴性对照组相比,HvKP组的OD值显著升高,表明HvKP成功产生生物被膜;与HvKP组相比,HvKP+AlgL(62.5 U)组的OD值显著降低;与HvKP+AlgL(62.5 U)组相比,HvKP+AlgL(312.5 U)组OD值显著降低;与HvKP+AlgL(312.5 U)组比,HvKP+AlgL(1 562.5 U)组无显著性差异,表明在一定AlgL浓度范围内,OD值随着AlgL浓度的升高而降低。综上所述,AlgL能抑制HvKP生物被膜的形成。
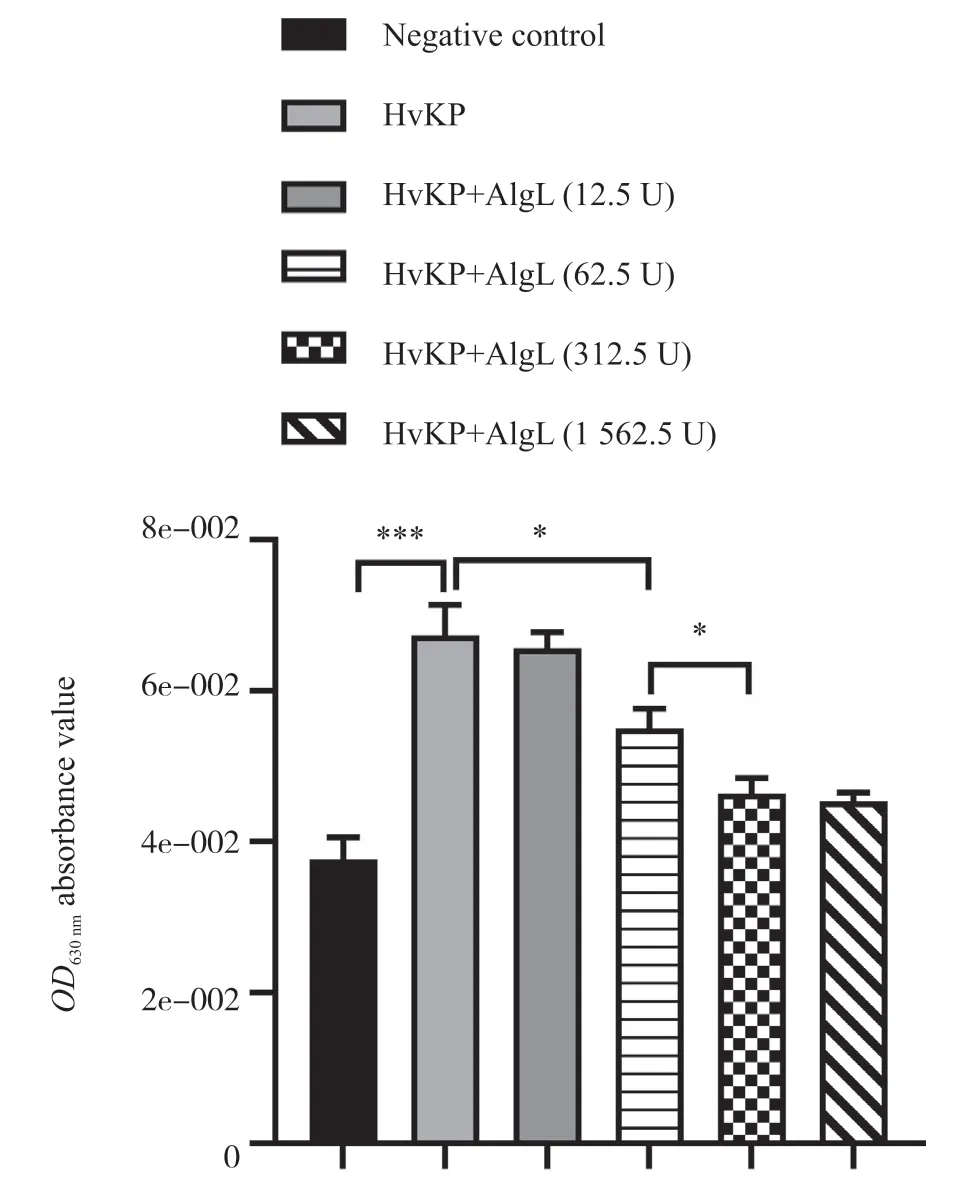
图3 生物膜半定量试验Fig. 3 Agarose gel electrophoresis
3 讨论
HvKP具有极强的播散能力,呼吸系统是其最常见的感染部位。在中国,HvKP感染率从8.33%到73.9%不等[19]。有研究报告称,糖尿病患者患有肺炎克雷伯菌并发症的风险会增加[20],并且大多数KP感染会导致肺炎或尿路感染[21]。HvKP是肺炎、转移性糖尿病感染、肝脓肿、脑膜炎及化脓性关节炎的重要病原体之一,严重威胁人类的健康[22]。本研究从临床送检标本分离出的KP,经鉴定30株均为HvKP,且发现在感染者的疾病分布中,肺部感染占56.7%,糖尿病疾病占26.7%。在临床中应该重点关注伴有肺炎的糖尿病患者,做好HvKP的预防、监测以及治疗。
KP的细菌生物被膜是影响其致病性的原因之一[23]。KP由1型和3型菌毛黏附素组装而成,它能促进细菌黏附到上皮细胞、免疫细胞和非生物表面[22]。在大肠杆菌中,生物膜的形成取决于各种调节剂,其中包括RpoS。RpoS是一种应激反应西格玛因子,允许细菌在应激条件下生存和适应[24]。KP具有很强的环境适应性,RpoS基因过度表达会导致3型菌毛编码基因的转录本丰度降低3~10倍,缺乏RpoS基因的KP的应激耐受性会减弱[25]。KP生物膜形成过程中最重要的表面结构就是3型菌毛和荚膜多糖[26]。有研究发现,RpoS基因可以介导鞭毛及生物膜等特殊结构的形成[27]。与野生型溶藻弧菌相比,RNAi处理的细菌其黏附、生物膜产生和毒力能力显著受损[28]。本研究分离鉴定的30株HvKP均扩增出耐药基因RpoS。30株HvKP中Sample 7组样本耐药性最强,并且其RpoS表达水平最高。Sample 7患者为患有急性上呼吸道感染、2型糖尿病性酮症等13种疾病的70岁老年人,该患者同时患有的疾病数目最多。在临床上,针对患有多种疾病免疫力低下的老年患者,我们需要加强对HvKP的监测。
生物膜是由不同病原体形成的复杂动态结构,可引起慢性持续性和复发性感染[29]。氧化应激可能会氧化和破坏肺炎克雷伯菌的生物膜,导致主要膜蛋白和肺炎克雷伯菌的活性丧失[30]。在伯克霍尔德菌中,RpoS基因通过增强过氧化氢酶的活性在氧化应激反应中发挥作用[31]。黏液性的铜绿假单胞菌的特征就是海藻外多糖增加,从而抵御抗生素和宿主免疫系统能力增强。AlgL可以降解这种糖,并被提议作为生物治疗剂来溶解铜绿假单胞菌的生物膜[32]。幽门螺杆菌生物膜的抗菌试验发现,克拉霉素与AlgL结合可提高抗生素的治疗效果[33]。HvKP也是一种高毒力高黏液性的病原微生物。本研究用AlgL对HvKP进行生物膜半定量试验,发现AlgL对HvKP生物被膜的形成有显著性的抑制作用。
本研究表明,患有肺部感染等多种疾病的老年患者应为HvKP重点监测人群,这为临床诊疗提供了一定的参考。本文在AlgL治疗HvKP感染上进行了一些探索,也为临床上解决HvKP耐药性提供了一定的参考。但本研究只进行了体外试验,缺乏体内试验研究,有一定的局限性,需要通过进一步的试验来确定AlgL用于临床上治疗细菌性感染疾病的用法、疗效、毒副作用等。