基础胰岛素联合GLP-1受体激动剂方案治疗超重肥胖T2DM的效果*
2022-09-09区觉璋刘得华朱锦匙黄泽柳孙艳
区觉璋 刘得华 朱锦匙 黄泽 柳孙艳
糖尿病(DM)是以高血糖水平为特征的代谢性疾病,其中2型糖尿病(T2DM)占90%左右[1]。T2DM主要表现为胰岛素进行性分泌不足伴胰岛素抵抗[2],长期高血糖水平会引起严重并发症,对患者生命安全造成较大威胁。目前临床用于治疗T2DM的主要方式为注射胰岛素控制血糖,但长期使用可能增加T2DM患者身体负担并加重胰岛素抵抗[3]。超重肥胖是T2DM的危险因素,该类患者常伴有不健康的饮食习惯,血糖控制水平较差。胰高血糖素样肽-1(GLP-1)受体激动剂可以增加胰岛β细胞增殖,进而减少胰高血糖素分泌,增加中枢饱腹感,达到降糖减重的作用[4]。基于此,本研究旨在观察多次胰岛素注射转换为基础胰岛素联合GLP-1受体激动剂方案治疗超重肥胖T2DM的效果及对生活质量的影响。现报道如下。
1 资料与方法
1.1 一般资料
选择2019年8月-2021年8月在江门市五邑中医院就诊的80例超重肥胖T2DM患者为研究对象,按随机数字表法分为观察组(n=40)和对照组(n=40)。(1)纳入标准:①符合T2DM的诊断标准[5];②年龄18~75岁;③配合度高,依从性好;④均为超重或肥胖人群,即体重指数(BMI)>24 kg/m2。(2)排除标准:①有 GLP-1受体激动剂和二肽基肽酶抑制剂使用史;②对本次研究使用药物过敏;③肝肾功能不全;④不能耐受药物的严重胃肠道副作用。观察组,男22例,女18例;年龄32~72 岁,平均(51.26±8.41)岁;BMI 25~32 kg/m2,平 均(28.64±2.31)kg/m2; 病程2~10年,平均(5.62±1.73)年。对照组,男21例,女19例;年龄32~75 岁,平均(52.36±8.26) 岁;BMI 25~32 kg/m2,平均(28.96±2.44)kg/m2;病程2~10年,平均(5.36±1.68)年。两组一般资料比较,差异均无统计学意义(P>0.05),具有可比性。本研究已经医院伦理委员会批准,患者及家属均知情同意并签署知情同意书。
1.2 方法
两组研究前均采用多次胰岛素注射方案,且嘱患者糖尿病饮食并加强运动锻炼。
对照组无转换用药,继续胰岛素多次注射方案,具体操作如下:胰岛素需求量0.4~0.8 U/(kg·d),给予精蛋白锌重组赖脯胰岛素混合注射液(50R)(生产厂家:Lilly France,批准文号:国药准字J20080055,规格:3 ml∶300单位)皮下注射,分2~3次餐前皮下注射。疗程3个月。
观察组转换为基础胰岛素联合GLP-1受体激动剂方案,具体操作如下,给予诺和达德谷胰岛素(生产厂家:丹麦Novo Nordisk A/S,批准文号:国药准字 J20171096,规格:3 ml∶300单位)皮下注射,0.3~0.6 U/(kg·d),1 次 /d;利拉鲁肽注射液[生产厂家:诺和诺德(中国)制药有限公司,批准文号:国药准字 J20160037,规格:3 ml∶18 mg]皮下注射,初始日剂量0.6 mg,逐渐增加日剂量至1.2 mg,1次/d。疗程3个月。
两组除针剂转换外,其他口服降糖药物不变。
1.3 观察指标及评价标准
比较两组治疗前后相关指标。(1)记录BMI变化。(2)便携血糖仪测量空腹血糖(FBG)和餐后2 h 血糖(2 h PG)水平。(3)采集两组外周静脉血,3 000 r/min离心 10 min后,取上层血清,用亲和层析法测定糖化血红蛋白(HbA1c)水平。(4)酶联免疫吸附法测定两组空腹胰岛素(FINS)水平,并计算出胰岛β细胞功能(HOMA-β)和胰岛素抵抗指数(HOMA-IR)水平。(5)采用糖尿病患者生存质量特异性量表(DSQL)评估两组生活质量,该量表共有生理(12~60分)、心理(8~40分)、治疗(3~15分)和社会关系(4~20分)4个维度,得分在27~135分,分数越低生存质量越高[6]。(6)统计两组治疗3个月内不良反应发生情况。不良反应包括轻度胃肠道反应、皮肤瘙痒、低血糖、水肿。
1.4 统计学处理
采用SPSS 19.0软件对所得数据进行统计分析,计量资料用(±s)表示,组间比较采用独立样本t检验,组内比较采用配对t检验;计数资料以率(%)表示,比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组BMI和血糖相关指标比较
治疗前,两组BMI和血糖相关指标比较,差异均无统计学意义(P>0.05);治疗3个月后,两组FBG、2 h PG 和 HbA1c较治疗前均降低(P<0.05),观察组BMI较治疗前降低(P<0.05),且观察组BMI、HbA1c较对照组均更低(P<0.05),见表1。
表1 两组BMI和血糖相关指标比较(±s)
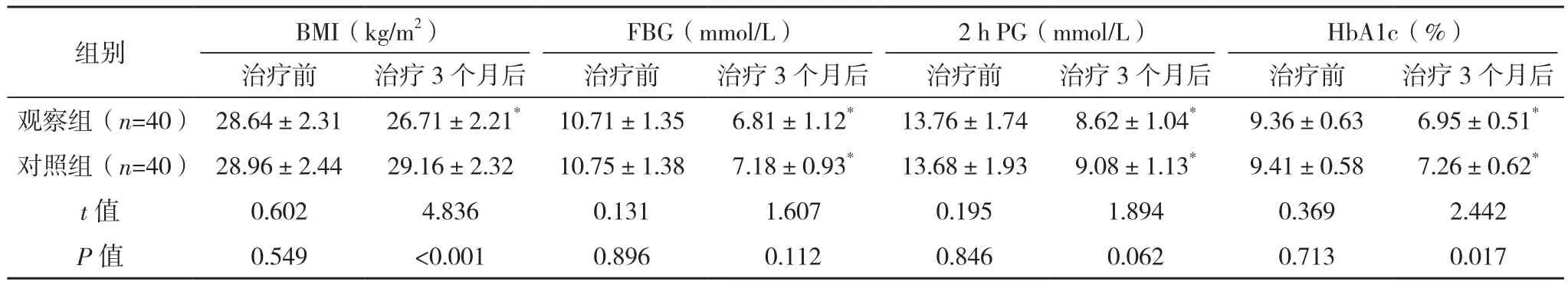
表1 两组BMI和血糖相关指标比较(±s)
*与本组治疗前相比,P<0.05。
组别 BMI(kg/m2)FBG(mmol/L)2 h PG(mmol/L)HbA1c(%)治疗前 治疗3个月后 治疗前 治疗3个月后 治疗前 治疗3个月后 治疗前 治疗3个月后观察组(n=40) 28.64±2.31 26.71±2.21* 10.71±1.35 6.81±1.12* 13.76±1.74 8.62±1.04* 9.36±0.63 6.95±0.51*对照组(n=40) 28.96±2.44 29.16±2.32 10.75±1.38 7.18±0.93* 13.68±1.93 9.08±1.13* 9.41±0.58 7.26±0.62*t值 0.602 4.836 0.131 1.607 0.195 1.894 0.369 2.442 P值 0.549 <0.001 0.896 0.112 0.846 0.062 0.713 0.017
2.2 两组胰岛功能比较
治疗前,两组胰岛功能比较,差异均无统计学意义(P>0.05);治疗3个月后,两组FINS和HOMA-β较治疗前均升高,且观察组较对照组均更高(P<0.05);治疗3个月后,两组HOMA-IR较治疗前均降低,观察组较对照组更低(P<0.05),见表2。
表2 两组胰岛功能比较(±s)
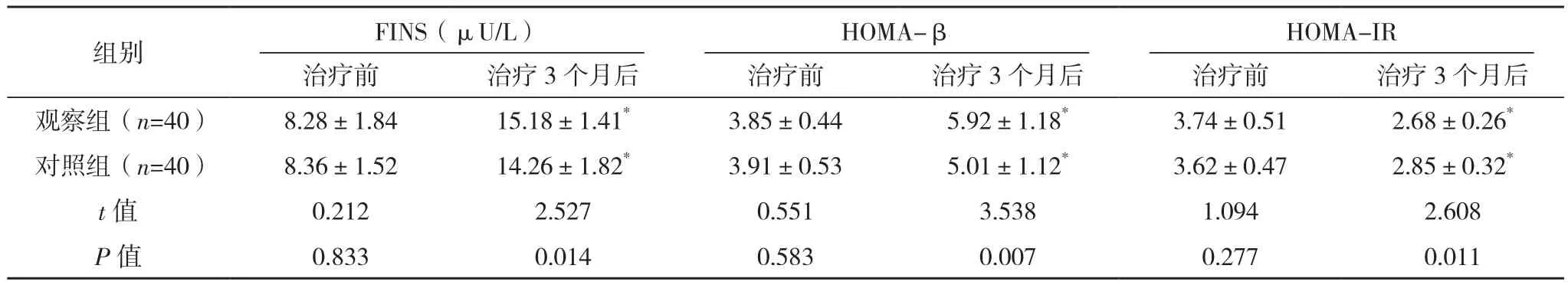
表2 两组胰岛功能比较(±s)
*与本组治疗前相比,P<0.05。
组别 FINS(μU/L)HOMA-βHOMA-IR治疗前 治疗3个月后 治疗前 治疗3个月后 治疗前 治疗3个月后观察组(n=40) 8.28±1.84 15.18±1.41* 3.85±0.44 5.92±1.18* 3.74±0.51 2.68±0.26*对照组(n=40) 8.36±1.52 14.26±1.82* 3.91±0.53 5.01±1.12* 3.62±0.47 2.85±0.32*t值 0.212 2.527 0.551 3.538 1.094 2.608 P值 0.833 0.014 0.583 0.007 0.277 0.011
2.3 两组DSQL评分比较
治疗前,两组DSQL各维度评分及总分比较,差异均无统计学意义(P>0.05);治疗3个月后,观察组DSQL各维度评分及总分较治疗前均降低(P<0.05),对照组较治疗前均无明显变化(P>0.05),且观察组较对照组均更低(P<0.05),见表3。
表3 两组DSQL评分比较[分,(±s)]
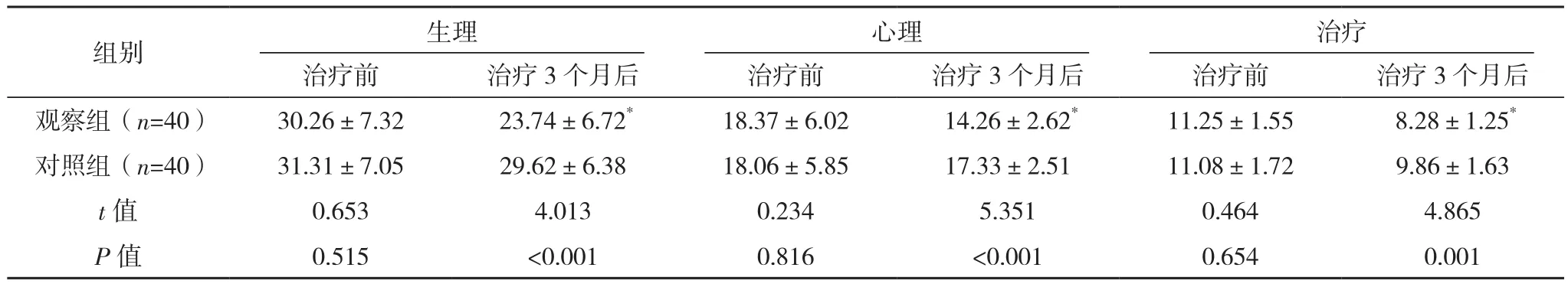
表3 两组DSQL评分比较[分,(±s)]
组别 生理 心理 治疗治疗前 治疗3个月后 治疗前 治疗3个月后 治疗前 治疗3个月后观察组(n=40) 30.26±7.32 23.74±6.72* 18.37±6.02 14.26±2.62* 11.25±1.55 8.28±1.25*对照组(n=40) 31.31±7.05 29.62±6.38 18.06±5.85 17.33±2.51 11.08±1.72 9.86±1.63 t值 0.653 4.013 0.234 5.351 0.464 4.865 P值 0.515 <0.001 0.816 <0.001 0.654 0.001
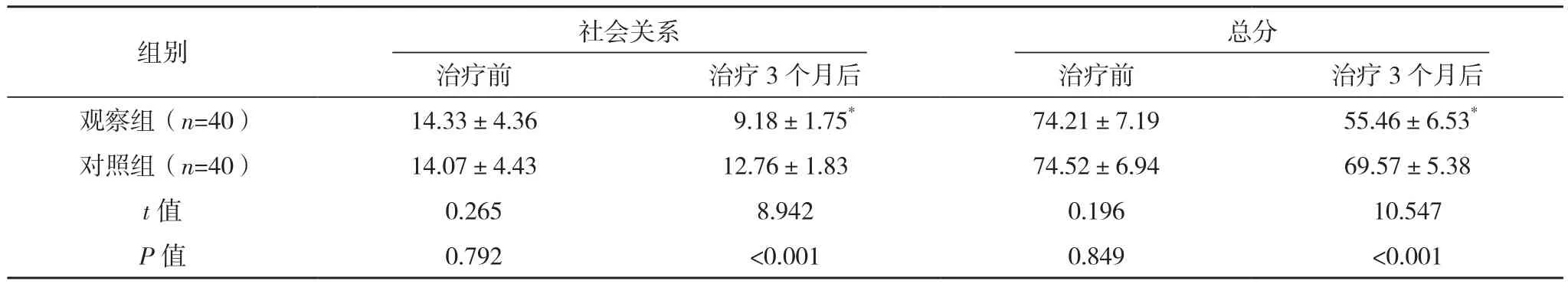
表3(续)
2.4 两组不良反应发生率比较
治疗3个月内,观察组低血糖发生率、不良反应发生率均低于对照组(P<0.05),见表4。
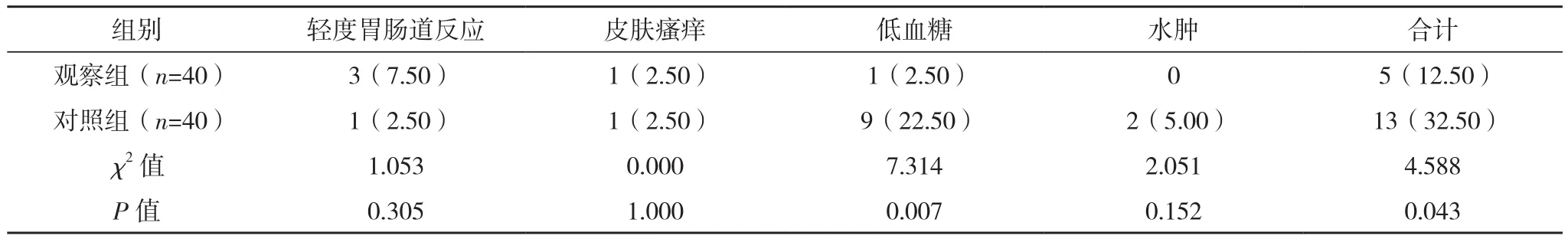
表4 两组不良反应发生率比较[例(%)]
3 讨论
超重肥胖T2DM患者大多伴有胰岛素抵抗,进而对胰岛素敏感性降低,外周血糖消耗减少,肝脏合成肝糖水平升高,最终导致血糖升高,当血糖升高至一定水平时将产生高糖毒性,可影响β细胞功能,进而引发高胰岛素血症[7],加重胰岛素抵抗,如此恶性循环,最终造成胰岛功能衰竭。肥胖作为T2DM的独立危险因素,与该疾病的发展关系密切。因此,对于超重肥胖T2DM患者,改良用药方案以兼顾控制血糖与减轻体重双重治疗目的尤为关键[8]。
胰岛素为控制血糖最有效的方法,但胰岛素的药理作用为促进糖原和蛋白质合成,阻止其分解,故糖尿病患者大多伴有BMI增加。而常规多次预混胰岛素注射方案作为维持胰岛素治疗的常见方案,虽然能控制血糖水平,但针对胰岛素引起的BMI升高却无明显疗效,因血糖波动,常需调整剂量,但患者缺乏专业知识,不恰当的剂量调整容易引起低血糖发生。
本研究中,治疗3个月后,两组FBG、2 h PG和HbA1c较治疗前均降低(P<0.05),观察组BMI较治疗前降低(P<0.05),且观察组BMI、HbA1c较对照组均更低(P<0.05)。表明多次胰岛素注射方案是否转换为基础胰岛素联合GLP-1受体激动剂方案对超重肥胖T2DM患者FBG、2 h PG水平控制方面无明显差异,但能有效减轻超重肥胖T2DM患者体重。考虑与GLP-1受体激动剂的作用有关,GLP-1受体激动剂可提高胰岛素的敏感度,减少胰高血糖素分泌,进而发挥降糖作用;除此之外,GLP-1受体激动剂还能减少胃酸分泌,增加中枢饱腹感,从而减轻患者体重水平,药代动力学表明,基础胰岛素联合GLP-1受体激动剂可在降血糖的同时不影响各自的药代动力学模式[8]。使用胰岛素时可通过增加用量来加强血糖控制效果,但也会增加低血糖的发生率,还会造成体重增加,而基础胰岛素与GLP-1受体激动剂联用具有协同互补的作用,基础胰岛素降低FBG,GLP-1受体激动剂可降低2 h PG,两种药物相互协同可显著减少胰岛素的用量,增加血糖控制水平,且不增加低血糖发生率[9]。同时,有研究表明,随着T2DM患者体重指数的升高,GLP-1受体激动剂对胰岛功能的改善作用越明显[10]。
胰岛素可平稳快速控制血糖水平,逆转高糖毒性[11],进而对胰岛细胞功能的损害减轻,有助于延缓胰岛功能退化进程。本研究中,治疗3个月后,两组FINS和HOMA-β较治疗前均升高,且观察组较对照组均更高(P<0.05);治疗3个月后,两组HOMA-IR较治疗前均降低,观察组较对照组更低(P<0.05)。表明多次胰岛素注射转换为基础胰岛素联合GLP-1受体激动剂方案可显著改善超重肥胖T2DM患者胰岛功能。分析原因为基础胰岛素可以延缓胰岛功能退化进程,加之GLP-1受体激动剂可保护β细胞功能,增加胰岛素的分泌,增强胰岛素敏感性,从而更有利于胰岛功能的改善[12]。
本研究还发现,治疗3个月后,观察组DSQL各维度评分及总分较治疗前均降低(P<0.05),对照组较治疗前均无明显变化(P>0.05),且观察组较对照组均更低(P<0.05)。表明多次胰岛素注射转换为基础胰岛素联合GLP-1受体激动剂方案可明显提高超重肥胖T2DM患者的生活质量,考虑是因为多次胰岛素注射方案需要每天用药2~3次,且需要在餐前用药,而基础胰岛素联合GLP-1受体激动剂方案每天只需用药1次,且不受进食时间影响,简化用药方案的同时,能显著减轻患者体重,进而降低血糖控制不良和心血管不良事件的发生风险,故有利于提升患者生活质量。
本研究中,治疗3个月内,观察组低血糖发生率、不良反应发生率较对照组均更低(P<0.05)。表明基础胰岛素联合GLP-1受体激动剂方案治疗超重肥胖T2DM患者可显著降低低血糖不良反应发生率,可能是因为GLP-1受体激动剂可增加胰岛素的敏感度,减少胰高血糖素分泌,属于葡萄糖依赖性降糖,故能有效避免低血糖出现。除此之外,有学者提出,预混胰岛素与三餐餐时联合长效胰岛素治疗方案在控制血糖方面具有同等疗效[13]。因此,对于目前使用预混胰岛素类似物多次注射方案或者基础胰岛素联合餐时胰岛素多次注射方案的超重肥胖T2DM患者,可优先考虑基础胰岛素联合GLP-1受体激动剂方案。
综上所述,基础胰岛素联合GLP-1受体激动剂方案治疗超重肥胖T2DM患者在保证其降糖作用的同时还能显著降低BMI,改善胰岛功能,提高其生活质量,减少低血糖不良反应发生风险。
