基于生物信息学分析构建免疫相关基因脓毒症预后模型
2022-09-09朱思哲叶成林
朱思哲,叶成林
(1.华中科技大学同济医学院附属同济医院临床免疫研究室,湖北 武汉 430030;2.武汉大学人民医院病理科,湖北 武汉 430060)
脓毒症(sepsis)是宿主对感染的免疫反应失调而导致危及生命的器官功能性障碍[1]。据保守估计,脓毒症是全世界死亡和危重病的主要原因[2]。尽管在过去的几十年中,脓毒症的预后有所改善,但脓毒症休克的死亡率仍高于25%~30%,甚至40%~50%[3]。此外,幸存的脓毒症患者通常要承受长期的身体、心理和认知障碍[4]。脓毒症与其他主要流行病不同,其治疗是非特异性的,没有批准的药物,只能给予维持器官功能、抗生素和保障血液动力学稳定治疗。因此,迫切需要探索更多潜在的脓毒症诊断生物标志物并构建预后模型,从而提高治疗决策的有效性。免疫反应失调在脓毒症中扮演着重要的角色。单核细胞和巨噬细胞是先天免疫系统的主要组成部分,在脓毒症期间协调宿主免疫反应方面发挥着关键作用。在脓毒症的早期阶段,两种不同的淋巴细胞分泌的促炎因子和趋化因子水平升高,这会加剧炎症反应,增加死亡率[5]。中性粒细胞是体循环中最丰富的白细胞。研究表明,脓毒症患者中循环中性粒细胞增加可导致免疫失调,通过释放细胞因子和活性氧导致多器官衰竭,CD4+T 细胞可以直接介导宿主对脓毒症的反应,脓毒症导致的细胞凋亡会诱导CD4+T细胞的耗竭[6]。而脓毒症导致记忆CD8+T 细胞表型、保护功能和定位的长期改变,可能会改变宿主对再感染的反应能力[7]。因此,免疫相关基因在脓毒症的诊断与预后预测方面具有巨大潜力。目前,关于免疫相关基因在脓毒症的诊断与预后方面的研究报道罕见。基于此,本研究通过生物信息学分析获得具有表达差异的免疫相关基因,并探索其生物学功能。进一步通过LASSO 回归和多因素COX 回归分析筛选脓毒症独立预后基因,并构建预后风险模型,以及探索所筛选的基因在脓毒症中的诊断价值,为脓毒症的诊断、治疗和预后提供新的思路。
1 资料与方法
1.1 数据来源 通过GEO 数据库(https://www.ncbi.nlm.nih.gov/geo/)下载脓毒症基因芯片表达数据集GSE134347、GSE13904 和GSE65682,每个数据集样本信息见表1。通过CIBERSORTx 数据库(https://cibersortx.stanford.edu/)分析GSE134347 数据集中每个样本中22 种常见免疫细胞的浸润程度。

表1 GSE134347、GSE13904 和GSE65682 数据集信息
1.2 差异基因分析 利用R 包limma 对GSE134347数据集进行差异分析,adjustP-value <0.05,|Log2FC|>1 的基因被定义为差异表达基因(DEGs)。通过ImmPort 数据库下载免疫相关基因,并与差异表达基因取交集。
1.3 生物学功能富集分析 利用R 包clusterProfile进行生物学功能GO(gene ontology)和KEGG(kyoto encyclopedia of genes and genomes)富集分析,利用R 包GOplot 计算z-score。
1.4 构建风险预后模型 通过R 包glmnet 对GSE65682 数据集中含有预后信息的标本进行LASSO 回归分析,设置10 折交叉验证,以获得最优模型。利用R 包survival 进行多因素COX 回归筛选独立预后基因(P<0.01),风险比(Hazard ratio,HR)>1为危险因素,HR<1 为保护因素。进一步通过多因素回归分析确定每个独立预后基因的回归系数,建立预后风险模型,预测患者生存率。公式为:风险分数=Σβi×xi,βi为基因对应的多元COX 回归beta 值,xi为基因表达值。
1.5 绘制诊断ROC 曲线及验证 利用R 包pROC 对GSE134347 训练集和GSE13904 验证集中的独立预后基因绘制诊断ROC 曲线和计算AUC 值,并通过R 包ggplot2 绘制这两个数据集中独立预后基因表达值小提琴图。
2 结果
2.1 免疫浸润分析 免疫浸润分析显示,脓毒症组和正常组的免疫细胞浸润具有差异。在脓毒症组中,浆细胞(plasma cells)、活化CD4+记忆T 细胞(T cells CD4 memory activated)、调节性T 细胞(T cells regulatory)、单核细胞(monocyte)、M0 型巨噬细胞(macrophage M0)和中性粒细胞(neutrophils)的浸润程度上升,而初始B 细胞(B cells naive)、CD8+T 细胞(T cells CD8)、初始CD4+T 细胞(T cells CD4 naive)、静息CD4+记忆T 细胞(T cells CD4 memory resting)和静息自然杀伤细胞(NK cells resting)的浸润程度下降,见图1。

图1 免疫浸润分析
2.2 差异分析 共获得911 个上调基因和1248 个下调基因,见图2A。通过与免疫相关基因取交集,共获得差异表达的免疫相关基因245 个,见图2B。

图2 差异基因分析
2.3 生物学功能富集分析 对筛选的245 个免疫相关基因进行生物学富集分析:GO 富集显示上述基因主要富集于免疫反应激活细胞表面受体信号通路、细胞因子产生的正调控、抗原受体介导的信号通路、细胞活化的正调控、白细胞活化的正调控、淋巴细胞活化的正调控、淋巴细胞活化的调节、T 细胞受体信号通路、T 细胞活化、白细胞-细胞粘附,见图3A;KEGG 信号通路富集分析显示,上述基因主要富集于Th17 细胞分化、Th1 和Th2 细胞分化、抗原处理和呈递、造血细胞系、T 细胞受体信号通路、肺结核、弓形虫病、利什曼病、自然杀伤细胞介导的细胞毒性和甲型流感信号通路,见图3B。

图3 生物学功能富集分析
2.4 构建风险预后模型 对245 个免疫相关基因进行LASSO 回归分析筛选预后基因,见图4A;共获得DEFA4、IL4R、TFRC、CCL5、CAMP、CX3CR1、PRKCA、CD28 和LTB 9 个免疫相关预后基因,LASSO 回归轨迹见图4B。进一步通过多因素COX 归回筛选独立预后基因,DEFA4 为危险因素(HR>1),而CAMP、CX3CR1 和PRKCA 为保护因素(HR<1),见图4C。基于以上4 个基因的表达值与COX 回归系数构建风险预后模型,计算GSE65682 中每个脓毒症患者的风险分数:风险分数=0.2300×DEFA4-0.2894×CAMP-0.2958×CX3CR1-0.2388×PRKCA。进一步按照风险分数中位数将GSE65682 中的脓毒症患者分为高风险组和低风险组,比较两组28 d 生存差异,结果显示高风险组28 d 生存率低于低风险组(P=2.7e-7),见图5。
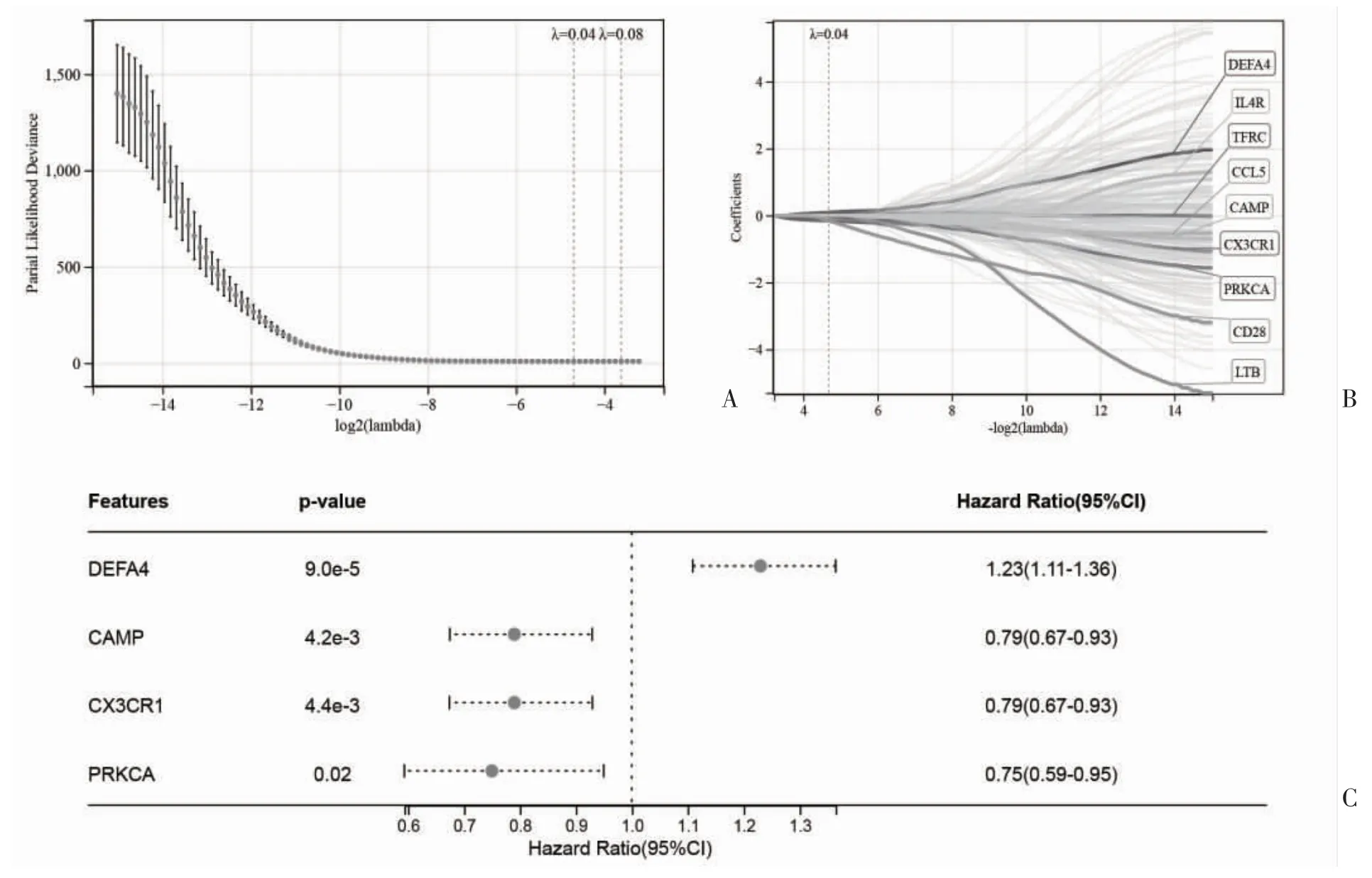
图4 LASSO 回归和多因素COX 回归分析
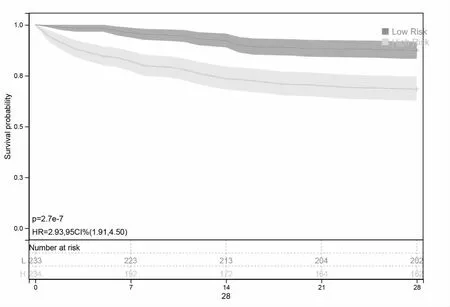
图5 生存分析
2.5 诊断ROC 曲线及验证 ROC 曲线显示,DEFA4(AUC=0.795)和PRKCA(AUC=0.893)展示出一定的诊断准确性,而CAMP(AUC=0.923)和CX3CR1(AUC=0.950)则具有较高的诊断准确性,见图6A。为了进一步验证上述结果,利用GSE13904 验证集绘制DEFA4、CAMP、CX3CR1 和PRKCA 的ROC 曲线,结果显示DEFA4、CAMP 和CX3CR1 展示出一定的诊断准确性,而PRKCA 则具有较低的准确性,见图6B。进一步根据DEFA4、CAMP、CX3CR1 和PRKCA 在GSE134347 训练集与GSE13904 验证集中的表达值,分别绘制表达值小提琴,结果显示DEFA4 和CAMP 的表达在脓毒症组上调(P<0.05),CX3CR1 和PRKCA 的表达则在正常组中上调(P<0.05),见图7。
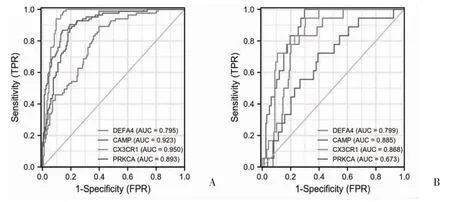
图6 该模型诊断脓毒症的ROC 曲线

图7 DEFA4、CAMP、CX3CR1 和PRKCA 基因表达水平
3 讨论
在过去的30 年里,脓毒症的定义和管理有很大的发展[8]。这得益于对临床综合征的理解、血流动力学监测工具的进步和抢救措施改进,但脓毒症仍是危重患者发病和死亡的主要原因之一[9]。多数患者在脓毒症的初始高炎症阶段可存活下来,但会进展到后期的免疫抑制阶段,其中30%的患者死于继发感染,免疫反应则可能在脓毒症患者死亡率中起主要作用[10]。因此,探索免疫相关基因在脓毒症中的作用,筛选免疫相关基因的脓毒症诊断生物标志物和构建预后风险模型对脓毒症的早期诊断和预后评估具有重要意义。
本研究对GEO 数据集的脓毒症组和正常组进行免疫浸润分析,结果显示脓毒症组与正常组外周血中免疫细胞浸润程度具有差异,这说明免疫调节在脓毒症中起重要作用。为了进一步探索免疫调节在脓毒症中的作用,本研究对脓毒症组和正常组进行差异分析,并从ImmPort 数据库下载免疫相关基因与差异基因取交集,共获得245 个免疫相关差异表达基因。生物功能富集分析显示245 个基因主要富集于Th17 细胞分化、Th1 和Th2 细胞分化、肺结核以及弓形虫病等免疫和感染相关信号通路。多项研究表明,这些信号通路与脓毒症密切相关。如Mishra R 等[11]报道肺结核性脓毒症休克是一种罕见的疾病,但其具有非常高的死亡率,这与败血症流行病学的普遍预期相反。Souza MC 等[12]报道,慢性弓形虫感染可加剧继发性多微生物脓毒症。Th 细胞作为适应性免疫的一部分,参与了脓毒症的免疫调节。脓毒症患者中Th17 和Th1 细胞的活化失调,以及Th17/Treg 比例失衡与脓毒症预后相关[13,14]。Xue M等[15]报道,社区获得性严重脓毒症患发作时,Th2/Th1 比例显著上升,Th2 占主导地位,其持续动态增加与ICU 获得性感染和28 d 死亡率有关。
为了进一步筛选免疫相关脓毒症预后基因,本研究对上述245 个基因进行LASSO 回归和多因素COX 回归,结果显示DEFA4、CAMP、CX3CR1 和PRKCA 可以作为脓毒症的独立预后基因。DEFA4又名HNP4(人中性粒细胞α 防御素4),编码一种先天免疫阳离子抗菌肽,对革兰氏阴性菌具有较强的抗菌效果,也能保护人外周血单核细胞免受HIV-1 感染[16]。CAMP 编码一种Cathelicidin 抗菌肽LL-17,是呼吸道内宿主防御细菌感染中的重要元素[17],并且可以抑制2 型登革热病毒的感染[18]。CX3CR1 是趋化因子fractalkine 的受体,CX3CR1+细胞可以阻止沙门氏菌的侵袭[19],并在控制可能导致组织损伤的异常肠道炎症方面具有重要作用[20]。PRKCA 编码蛋白激酶C 属于丝氨酸和苏氨酸特异性蛋白激酶家族,蛋白激酶C 参与调节先天免疫和适应性免疫,参与2 型先天淋巴细胞的活化和Th2细胞的活化与增殖[21]。基于上述4 个基因构建脓毒症的预后风险模型,结果显示高风险组28 d 生存率低于低风险组。由此推测DEFA4、CAMP、CX3CR1和PRKCA 在脓毒症的免疫调节中起到关键作用,且与预后紧密相关。ROC 曲线显示,DEFA4、CAMP和CX3CR1 在训练集和验证集中均表现出一定的诊断能力(AUC>0.75),而PRKCA 在验证集中AUC为0.673,说明DEFA4、CAMP、CX3CR1 和PRKCA可以成为脓毒症免疫相关生物标志物。本研究结果提示,DEFA4、CAMP、CX3CR1 和PRKCA 可能在脓毒症的免疫调节中起到重要的作用,并且与预后紧密相关。探索脓毒症的早期诊断生物标志物以及构建预后模型有助于给予脓毒症患者及时有效的治疗,同时提高患者生存率。
综上所述,本研究基于4 个免疫相关的独立预后基因DEFA4、CAMP、CX3CR1 和PRKCA,构建了脓毒症预后风险模型,其在脓毒症预后预测中具有一定的应用价值,并且上述4 个基因都具有一定的脓毒症诊断能力。
