miR-455-5p对肾细胞癌增殖凋亡及侵袭的影响及机制研究*
2022-09-09贺丽,杨平,田良△
贺 丽,杨 平,田 良△
(华中科技大学同济医学院协和武汉红十字会医院/武汉市红十字会医院:1.泌尿外科;2.骨科,武汉 430015)
肾细胞癌(RCC)是全球第七大常见肿瘤,男性发病率高于女性,RCC发病率在泌尿系统肿瘤中排第二位,且近年来发病率不断升高,2018年全球约400 000人被诊断为RCC[1]。RCC组织类型包括透明细胞型(70%)、乳头状细胞癌 (10%~15%) 及嫌色细胞癌(5%) 。处于进展期的患者生存率不到10%[2]。RCC的治疗方法包括手术、放化疗和内分泌治疗,但疗效仍不佳[3]。对早期RCC患者手术切除是可以治愈的。不幸的是,25%~30%患者在确诊时就存在远处转移,且约40%患者手术切除后复发[4]。深入阐明RCC的发生及发展机制对提高RCC的诊治水平极其重要。微RNA(miRNA)分子是一类长度为18~22 nt的短单链RNA,这类RNA不编码蛋白,通过与靶基因的3′-UTR末端序列结合影响靶基因的表达[5],进而调控包括细胞生长、组织发育、细胞增殖、分化、凋亡、侵袭及转移等生物学过程[6],在多种疾病尤其是肿瘤中发挥着重要的调控作用[7]。miR-455家族基因定位于染色体9q32上,miR-455家族包括miR-455-3p与miR-455-5p成员,miR-455-3p与多种肿瘤的增殖、凋亡、侵袭及转移相关[8-9]。相比之下,miR-455-5p 在肿瘤中的作用的研究较少见,通常认为其生物学功能与肿瘤类型有关[10]。在胃癌中miR-455-5p具有抑癌基因的功能[11]。但在口腔鳞状细胞癌中miR-455-5p却促癌基因的作用[12]。然而miR-455-5p在RCC细胞系中的表达、功能和作用机制尚不清楚。本研究探讨了miR-455-5p对RCC细胞系增殖、凋亡及侵袭的影响,并阐明其机制。
1 材料与方法
1.1标本采集
收集2018年1月至2020年12月本院泌尿外科收治并接受RCC切除术的60例RCC及癌旁组织标本,其中男40例,女20例,平均年龄(59.3±6.2)岁。所有组织标本均保存于-80 ℃冰箱。纳入标准:(1)患者一般情况可且接受RCC切除术;(2)经病理检查确诊为RCC;(3)临床病理资料齐全。排除标准:(1)肝、肾功能差,无法耐受手术者;(2)存在其他部位肿瘤;(3)临床病理资料不全。本研究经本院伦理委员会批准并符合赫尔辛基宣言。
1.2主要仪器和试剂
正常肾上皮细胞系HREpiC,肾癌细胞系Caki-2、A498、786-O及Caki-1均由同济医学院基础医学系实验室馈赠。于美国Cell signaling公司购买RAB18、GAPDH一抗,于美国Santa Cruz公司购买羊抗鼠IgG二抗。于美国Thermo Scientific公司购买BCA蛋白试剂盒、ECL试剂盒和LipofectamineTM3000 转染试剂。于上海天根生物技术公司购买MTT增殖检测试剂盒。于美国Invitrogen公司购买细胞侵袭小室试剂盒。广州锐博生物科技有限公司负责设计及合成miR-455-5p过表达序列(miR-455-5p mimics)及阴性对照序列(Scramble)。
1.2方法
1.2.1细胞培养及分组
将正常肾上皮细胞系HREpiC,Caki-2、A498、786-o及肾癌细胞系Caki-1置于10%胎牛血清(FBS)、青霉素-链霉素DMEM培养基中,并在 37 ℃、5% CO2的加湿培养箱中培养。对Caki-2细胞系采用LipofectamineTM3000试剂盒分别转染miR-455-5p mimics及Scramble序列,并分为miR-455-5p mimics组和Scramble组,转染后进行转染效率测定,并进行后续细胞增殖及侵袭实验。
1.2.2定量反转录聚合酶链反应
采用TRIzol试剂盒,依据说明书提取正常肾上皮细胞系HREpiC,肾癌细胞系Caki-2、A498、786-O及Caki-1,以及肾癌和癌旁组织中的总RNA,RNA浓度和纯度分析采用紫外分光光度计测量,并进行反转录。每个标本设3个复孔,每个标本测定3次,以U6作为miR-455-5p内参。使用2-ΔΔct法计算miR-455-5p相对表达水平。
1.2.3细胞增殖测定
细胞增殖能力测定采用MTT实验,以5×106个细胞/孔将两组细胞置于96孔板中,0、24、48、72、96 h加入10 μL MTT及90 μL DMEM培养液,37 ℃培养2 h,采用酶标仪测定490 nm处吸光度值(A)。
1.2.4细胞凋亡能力测定
采用Annexin V-FITC/PI双染法流式细胞术测定细胞凋亡能力。将两组细胞经胰酶消化悬浮后每组收集1~5×105细胞,加入Binding Buffer 500 μL以悬浮细胞,加入5 μL Annexin V-FITC混匀后加入5 μL Propidium Iodide混匀,在室温、避光、反应5~15 min后于1 h内用流式细胞仪分析凋亡细胞比例,计算细胞凋亡率。
1.2.5细胞侵袭测定
采用Transwell实验测定细胞侵袭能力,将两组细胞以4×104个细胞/孔加入侵袭小室上室并加入200 μL DMEM培养基,侵袭小室下室放置含20% FBS DMEM培养基500 μL。经37 ℃培养48 h,将未穿膜的细胞和培养基擦去,洗涤3次后用多聚甲醛固定10 min。对穿膜的下室侵袭细胞用0.5% 结晶紫染色,计数分析在视野显微镜(×200)下进行。
1.2.6Western blot检测
采用Western blot测定RAB18蛋白相对表达水平,裂解两组细胞并提取总蛋白,蛋白浓度测定采用BCA法。采用12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)进行蛋白分离电泳,并转膜至PVDF 膜上。将PVDF膜与RAB18(1∶300)、GAPDH(1∶300)一抗在4 ℃下孵育过夜,随后加入辣根过氧化物酶标记的羊抗鼠二抗(1∶400),并室温下孵育1 h。目标蛋白条带的测定采用ECL化学发光试剂盒,扫描条带灰度,采用Quantity One软件计算灰度值。目的蛋白相对表达水平=目的蛋白条带灰度值/GAPDH条带灰度值。
1.2.7miR-455-5p靶基因预测和验证
miR-455-5p靶基因的预测采用Target scan软件。miR-455-5p靶基因的验证使用双荧光素酶实验,采用LipofectamineTM3000 试剂盒将 PmirGLO-RAB18-3′ UTR 野生型质粒(Wt)、miR-455-5p mimics、pmirGLO-RAB18-3′ UTR突变型质粒(Mut)共转移至HEK293T 细胞中。荧光素酶活性用萤火虫荧光素酶活性检测试剂盒进行检测。
1.3统计学处理

2 结 果
2.1miR-455-5p低表达于肾癌细胞系及RCC组织
miR-455-5p在正常肾上皮细胞系HREpiC中相对表达水平为1.08±0.06,在Caki-2、A498、786-O及Caki-1肾癌细胞系的相对表达水平分别为0.36±0.02、0.51±0.04、0.60±0.06及0.52±0.08。miR-455-5p在肾癌细胞系中的表达水平均明显低于正常肾上皮细胞系HREpiC,差异均有统计学意义(P<0.05)。在RCC组织中表达水平为1.85±1.03,miR-455-5p在癌旁组织中表达水平为6.12±1.56。miR-455-5p在RCC组织中表达水平明显低于癌旁组织,差异有统计学意义(P<0.05),见图1。
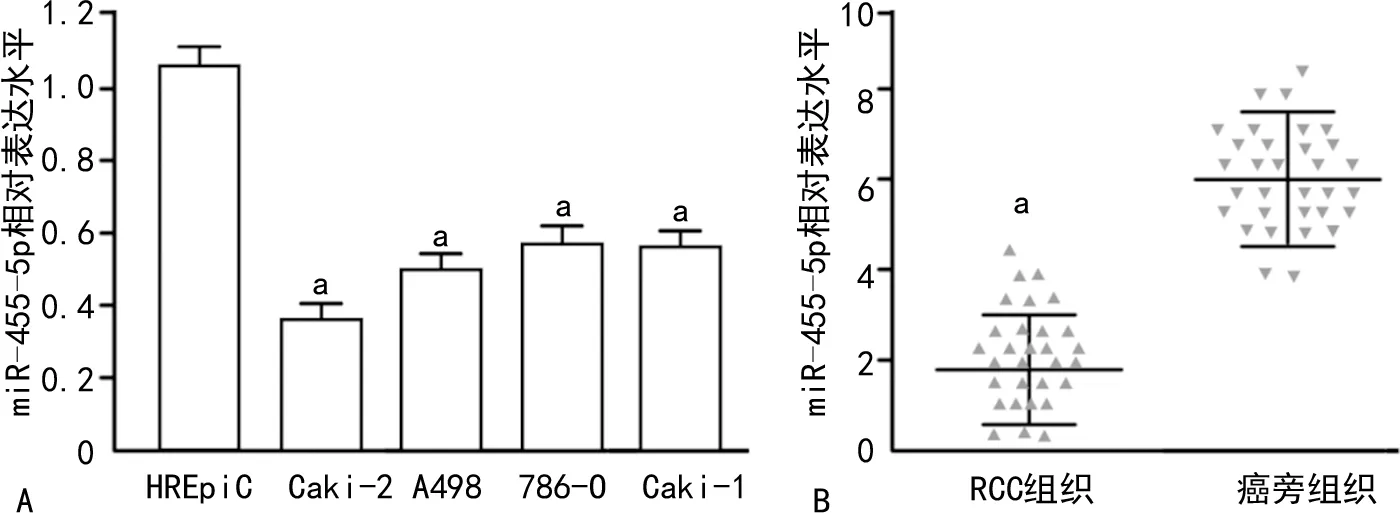
A:miR-455-5p在肾癌细胞系及正常肾上皮细胞系中的表达;B:miR-455-5p在RCC组织及癌旁组织中的表达;a:P<0.05。
2.2转染miR-455-5p抑制Caki-2细胞增殖
miR-455-5p mimics组miR-455-5p相对表达水平为5.53±0.04,Scramble组miR-455-5p相对表达水平为1.03±0.02。miR-455-5p mimics组miR-455-5p相对表达水平明显高于Scramble组,差异有统计学意义(P<0.05),见图2A。
miR-455-5p mimics组转染24 h后A490 nm值(0.46±0.03)与Scramble组(0.45±0.02)比较,差异无统计学意义(P>0.05);miR-455-5p mimics组转染48、72、93 h后A490 nm值(分别为0.63±0.13、0.92±0.21、1.32±0.17)均明显小于Scramble组(分别为1.18±0.19、1.62±0.34、2.30±0.25),差异均有统计学意义(P<0.05),见图2B。

A:miR-455-5p转染效率测定;B:细胞增殖曲线;a:P<0.05。
2.3转染miR-455-5p促进Caki-2细胞凋亡
miR-455-5p mimics组细胞凋亡率(13.2±1.6)%明显高于Scramble组(3.7±0.3)%,差异有统计学意义(P<0.05),见图3。

A:流式细胞术检测;B:细胞凋亡率;a:P<0.05。
2.4转染miR-455-5p抑制Caki-2细胞侵袭
miR-455-5p mimics组侵袭细胞数[(92±17)个]明显少于Scramble组[(377±23)个],差异有统计学意义(P<0.05),见图4。

A:Transwell实验(×200);B:侵袭细胞数;a:P<0.05。
2.5miR-455-5p靶向调控RAB18蛋白表达
miR-455-5p与RAB18 3′-UTR区序列可靶向结合,见图5A。在Caki-2细胞系中转染miR-455-5p mimics序列上调miR-455-5p表达,miR-455-5p mimics组RAB18蛋白表达水平明显低于Scramble组,见图5B。在RAB18野生型质粒(RAB18-WT)中miR-455-5p mimics组荧光素酶活性明显低于Scramble组,差异有统计学意义(P<0.05);而在RAB18突变型质粒(RAB18-MUT)中miR-455-5p mimics组与Scramble组荧光素酶活性比较,差异无统计学意义(P>0.05),见图5C。

A:miR-455-5p与RAB18 3′UTR5′区存在靶向结合序列;B:miR-455-5p转染后对RAB18蛋白表达的影响;C:miR-455-5p与RAB18的靶向关系;a:P<0.05。
3 讨 论
miRNA是肿瘤研究的热点,依据与miRNA结合的靶基因功能不同,miRNA在不同的肿瘤中发挥抑癌或促癌的功能。在RCC中已经发现多个miRNA发挥着重要的作用,包括miR-141、miR-34a、miR-155等[13]。
miR-455家族编码基因位于染色体9q32上,该区域是个脆性位点,容易发生杂合性缺失,这种情况多见于多种上皮鳞癌,如宫颈癌、肺癌和食管癌[14]。miR-455家族包括miR-455-3p与miR-455-5p成员。miR-455-3p与多种肿瘤的增殖、凋亡、侵袭及转移相关。在结肠癌细胞系HCT116中miR-455-3p抑制细胞增殖并诱导凋亡[8]。在三阴性乳腺癌中miR-455-3p通过靶向调控EI24表达,促进细胞迁移和侵袭[9]。相比之下,miR-455-5p 的生物学功能与肿瘤组织类型有关,存在异质性[10]。miR-455-5p在胃癌组织和细胞系中下调表达,且miR-455-5p可靶向RAB18抑制胃癌细胞增殖和迁移,扮演着抑癌基因的角色[11]。miR-455-5p在宫颈癌组织中呈低表达,并与患者预后不良相关,miR-455-5p可靶向调节S1PR1表达,进而抑制宫颈癌细胞系增殖和转移,发挥抑癌基因功能[15]。在食管鳞癌组织中miR-455-5p呈低表达,且与淋巴结转移及组织分化程度相关,过表达miR-455-5p可抑制食管癌细胞系Eca109细胞增殖、迁移及侵袭[16]。在胆管癌组织中miR-455-5p呈低表达,过表达miR-455-5p可抑制胆管癌细胞增殖、迁移及侵袭,并诱导凋亡,机制与调控MAPK、PI3K/AKT信号通路有关[17]。在前列腺癌中miR-455-5p过表达抑制前列腺癌细胞增殖,并通过靶向C-C基序趋化因子受体5抑制细胞增殖和肿瘤生长[18]。与此相反,miR-455-5p在恶性黑色素瘤及基底细胞癌中发挥促癌功能。如SHOSHAN等[19]报道miR-455-5p在恶性黑色素瘤中高表达,且可下调细胞质多聚体腺苷酸化元件结合蛋白1的表达,进而促进细胞增殖和转移。同样,SAND等[20]报道miR-455-5p在基底细胞癌中高表达,可能起促癌基因的作用。在口腔鳞状细胞癌中转化生长因子-β-SMAD 信号通路上调miR-455-5p表达并通过靶向重组人泛素结合酶E2-B(UBE2B)促进肿瘤细胞增殖[12]。
本研究在RCC组织及细胞系中进行研究发现,miR-455-5p在RCC组织及细胞系中呈低表达,与结肠癌[8]、三阴乳腺癌[9]、胃癌[11]、食管癌[16]、胆管癌[17]、前列腺癌[18]中的结果一致,但与恶性黑色素瘤[19]、基底细胞癌[20]、口腔鳞癌[12]结果相反,提示miR-455-5p可能在RCC中起抑癌基因的功能。本研究进一步分析了Caki-2细胞系转染miR-455-5p mimics上调miR-455-5p的表达,结果发现miR-455-5p mimics组细胞增殖能力低于Scramble组,侵袭细胞数少于对照组Scramble,表明miR-455-5p可抑制RCC细胞增殖和侵袭,发挥抑癌基因的功能。
RAB18 是 RAB GTPase 家族成员之一,在胞吐和分泌过程中调节囊泡的转运过程[21]。最近文献报道RAB家族蛋白与肿瘤发生联系密切[22-23]。在头颈部鳞癌中作为促癌因子,RAB18高表达,并且通过STAT3 信号通路促进细胞增殖、侵袭及顺铂耐药[24]。在肝细胞癌中RAB18的表达与患者预后不良相关,且RAB18可通过促进上皮间质转化促进肝癌细胞增殖和转移[25]。在胃癌中RAB18 通过调节线粒体功能和存活蛋白表达,促进胃癌细胞增殖和产生化疗耐药性[26]。在非小细胞癌中miR-30b/c通过靶向沉默RAB18表达可抑制细胞增殖,反之,上调RAB18促进细胞增殖[27]。表明RAB18在肿瘤发生、发展过程中起促癌基因功能。本研究通过双荧光素酶实验发现,miR-455-5p的靶基因为RAB18分子,且在细胞系中上调miR-455-5p表达后细胞增殖和侵袭受抑制,并促进细胞凋亡。其机制可能与miR-455-5p靶向下调促癌基因RAB18表达有关,即miR-455-5p通过靶向下调RAB18表达,进而抑制细胞增殖和侵袭,并促进细胞凋亡。
综上所述,本研究主要在肾癌细胞系中探讨了miR-455-5p对细胞增殖、侵袭及凋亡的影响,并初步探讨了其可能的机制。miR-455-5p在RCC组织及细胞系中均呈低表达,且上调miR-455-5p表达可抑制RCC细胞增殖和侵袭,并促进凋亡,机制可能与miR-455-5p靶向下调RAB18蛋白表达有关。但本研究不可避免存在一定的不足:(1)miR-455-5p的表达与患者临床病理因素及预后的关系尚未研究;(2)miR-455-5p与RCC术后患者预后的关系也未研究;(3)miR-455-5p在实验动物体内所扮演的功能也值得进一步研究,也是本研究后续的研究计划。
