KBaB5O9的两步法制备及其过程动力学研究
2022-09-08全志林李志祥周贤委向德兴冯晓琴黄宏升
全志林,李志祥,焦 斌,周贤委,向德兴,冯晓琴,2,黄宏升,2
(1.贵州理工学院化学工程学院,贵阳 550003;2.贵州省普通高等学校能源化学特色重点实验室,贵阳 550003)
0 引 言
硼酸盐中的硼存在BO3和BO4两种形式,它们可连接形成多种类型的多硼酸根阴离子,因此硼酸盐种类繁多,结构复杂多样。无水硼酸盐相较于水合硼酸盐通常同时存在两种或两种以上基本结构单元,因而其结构更加复杂多样,同时其具有热稳定性好、淬灭浓度高、强度高等优异性能,在阻燃、离子交换、催化、发光材料等领域具有潜在应用[1-2],而成为硼酸盐功能材料开发的主要对象。近年来,由于多金属硼酸盐相较于单金属硼酸盐具有更多的结构、种类和性能开发潜力,硼酸盐功能材料的开发从单金属硼酸盐转向了多金属硼酸盐[3]。研究发现当金属阳离子为碱金属和碱土金属等价态低、半径较大的离子时,硼酸盐结构电荷分布均匀,能量较大,结构相对稳定[4],且因为这些金属阳离子无d-d和f-f电子跃迁,更有利于深紫外光的透过,这就为紫外和深紫外区材料的存在提供了理论基础[5-6],如Li4Ca2B8O16[7]、RbBaB7O12[8]、Na2SrB16O26[9]、NaCaBO3[10]等无水碱金属-碱土金属硼酸盐具有良好的非线性光学性能,因而无水碱金属-碱土金属硼酸盐受到越来越多的关注。
制备无水硼酸盐的方法主要有气相沉积法、固相法,但这些方法存在能耗大、产物尺寸分布较宽、形貌粒径不易控制、过程不易控制等不足,在一定程度限制了其应用。以共沉淀法、水热溶剂热法等为代表的湿化学法由于具有合成产物物相与形貌易调控、反应条件温和等优点而得到越来越多的应用[11]。利用湿化学法制备无水硼酸盐时,通常先制备一个前驱体(主要为水合硼酸盐),然后将此前驱体进行热处理(热分解转化)得到最终产品,即分两步进行,又称“两步法”。研究人员利用两步法制备得到了一些无水硼酸盐,如CaB4O7[12]、Mg2B2O5[13]、Ca3(BO3)2[14]、Al4B2O9[15]等,但利用两步法制备无水硼酸盐时,第二步热处理过程中涉及多种物相变化过程[16],其机理复杂,未能实现产物的可控制备。因此,对第二步热处理过程中的物相变化过程及其机理进行研究显得非常重要。
目前无水碱金属-碱土金属硼酸盐的制备方法主要为高温固相法,还未见利用两步法制备无水碱金属-碱土金属硼酸盐的报道,但有极少量的关于将水合碱金属-碱土金属硼酸盐经热处理制备无水碱金属-碱土金属硼酸盐的报道,如Garcia-Valles等[17]利用NaCaB5O6(OH)6·5H2O制备得到了NaCaB5O9,并对NaCaB5O6(OH)6·5H2O热处理过程物相变化进行了研究,但对其机理研究不够深入。通过热分解动力学可获得物相变化过程的动力学参数及其机理,目前已有一些硼酸盐的热分解动力学研究,但主要集中在单金属硼酸盐,如SrB6O10·5H2O[18]、Zn3B6O12·3.5H2O[19]、KB5O8·4H2O[20]、2MgO·B2O3·1.5H2O[21]、2CaO·B2O3·H2O[22]。对于碱金属-碱土金属硼酸盐的研究很少,如毕颖等[16]对K2Ca[B4O5(OH)4]2·8H2O的结晶水脱失过程进行了动力学研究,但未对其物相变化过程进行研究。所以,为进一步完善碱金属-碱土金属硼酸盐的两步法可控制备,有必要对第二步的物相变化过程及其机理开展进一步的研究。
Sun等[23-24]利用高温固相法制备得到了具有[B5O11]7-基团的KBaB5O9,研究表明其具有较高的热稳定性,并且可作为稀土发光材料的良好基质。K2Ba[B4O5(OH)4]2·8H2O与K2Ba[B4O5(OH)4]2·10H2O[25]具有类似的结构单元,被认为是一种潜在的二阶非线性光学晶体。本课题组前期对K2Ba[B4O5(OH)4]2·8H2O的热力学性质进行了研究[26],但关于其热处理过程及动力学的研究尚未见报道。
本文利用K2Ba[B4O5(OH)4]2·8H2O前驱体经热处理(两步法)制备得到了KBaB5O9,并对前驱体的热处理变化过程及动力学进行了研究,为可控制备KBaB5O9提供了科学参考。
1 实 验
1.1 K2Ba[B4O5(OH)4]2·8H2O及其热处理产物制备
将适量K2B4O7·6H2O(AR)、BaCl2·2H2O(AR)分别溶于50 mL、20 mL蒸馏水中,后将氯化钡溶液缓慢加入四硼酸钾溶液中,搅拌1 h后密封,放置于室温环境中,7 d后得到长方体状晶体和部分白色沉淀,取出晶体用乙醇(AR)洗涤2~3次,抽滤,在50 ℃干燥5 h,得到样品A。将样品A分别在500 ℃、600 ℃、700 ℃、800 ℃的条件下煅烧4 h,自然冷却至室温,得到的产品分别记为A500、A600、A700、A800。
1.2 性能表征
利用傅里叶红外光谱仪(Nicolet NEXUS 670)对K2Ba[B4O5(OH)4]2·8H2O进行官能团分析,KBr压片,波数范围为400~4 000 cm-1;采用X射线衍射仪(ULtima IV)对K2Ba[B4O5(OH)4]2·8H2O及其热处理产物进行物相分析,Cu靶Kα线,石墨片滤波,管电压为30 kV,电流为20 mA,扫描速度为0.02 (°)/s,扫描范围为10°~70°;使用实验综合热分析仪(TG209F3Tarsus)对K2Ba[B4O5(OH)4]2·8H2O热分解过程的动力学进行分析,氩气气氛,升温速率为5 ℃/min、10 ℃/min、15 ℃/min、20 ℃/min。
2 结果与讨论
2.1 K2Ba[B4O5(OH)4]2·8H2O及其热处理产物的XRD分析
图1为K2Ba[B4O5(OH)4]2·8H2O的XRD谱。图中样品衍射峰较尖锐,表明该样品结晶度好,其衍射峰位置与参考文献[26]报道的K2Ba[B4O5(OH)4]2·8H2O基本一致,表明该物质为K2Ba[B4O5(OH)4]2·8H2O。图2为不同温度下K2Ba[B4O5(OH)4]2·8H2O热处理产物的XRD谱。当热处理温度为500 ℃时,产物无明显特征衍射峰出现,表明该产物为无定形结构;当温度为600 ℃时,产物出现了一些未知物质的衍射峰,表明当升高温度时,热处理产物的结构发生改变,由无定形转向晶态;与600 ℃时相比,当温度升高至700 ℃时,产物的大部分衍射峰强度明显减弱甚至消失,表明温度升高后,晶体内部结构有较大的改变,可能是在此温度下物质发生了分解[27];当温度为800 ℃时,产物的衍射峰较强,其衍射峰位置与KBaB5O9(JCPDS:97-016-1089)基本一致,无其他杂峰出现,表明该产物为KBaB5O9。
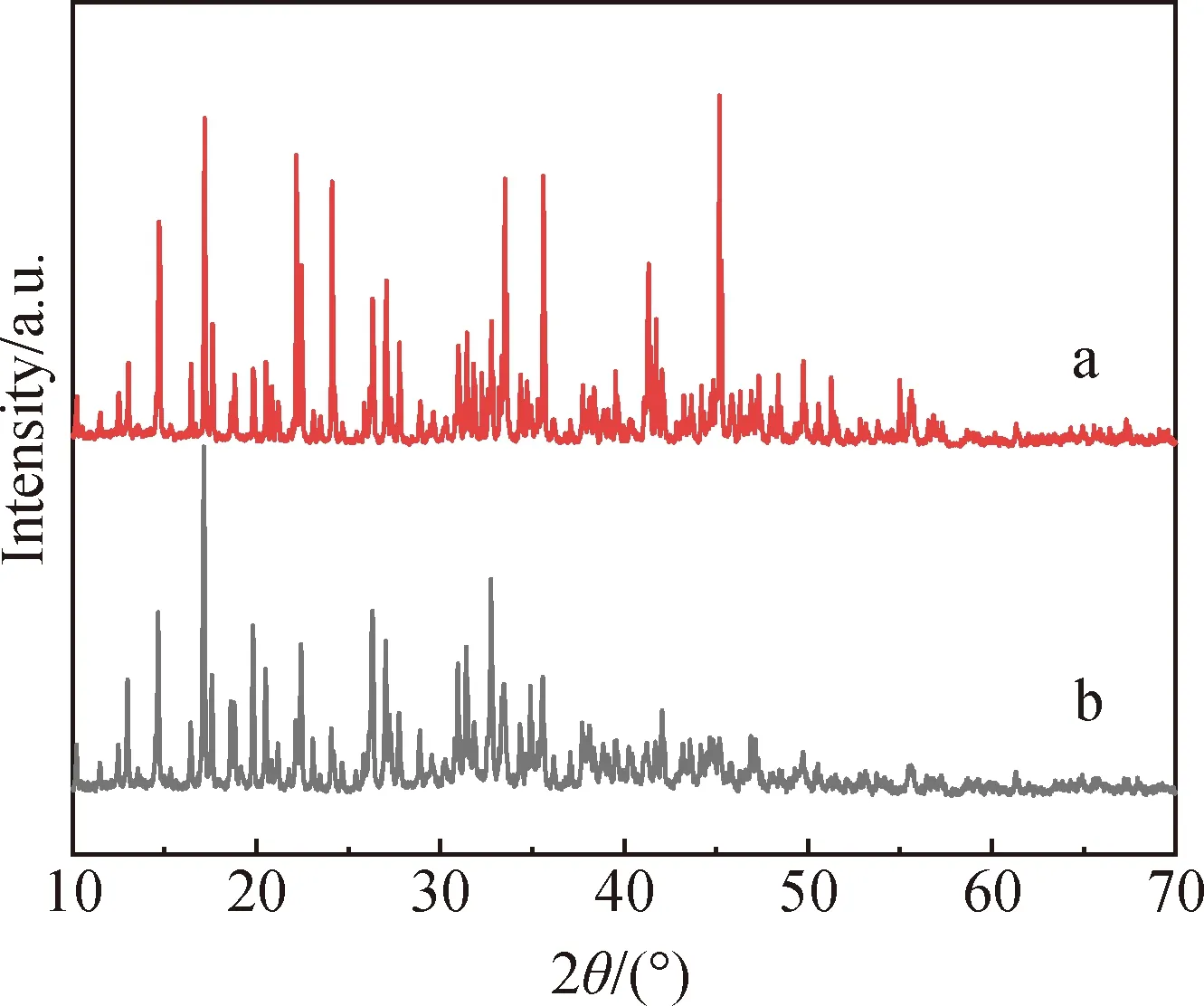
图1 K2Ba[B4O5(OH)4]2·8H2O的XRD谱(a,样品A;b,文献[26]报道的K2Ba[B4O5(OH)4]2·8H2O)Fig.1 XRD patterns of K2Ba[B4O5(OH)4]2·8H2O(a, sample A; b, K2Ba[B4O5(OH)4]2·8H2Oreported in the literature [26])
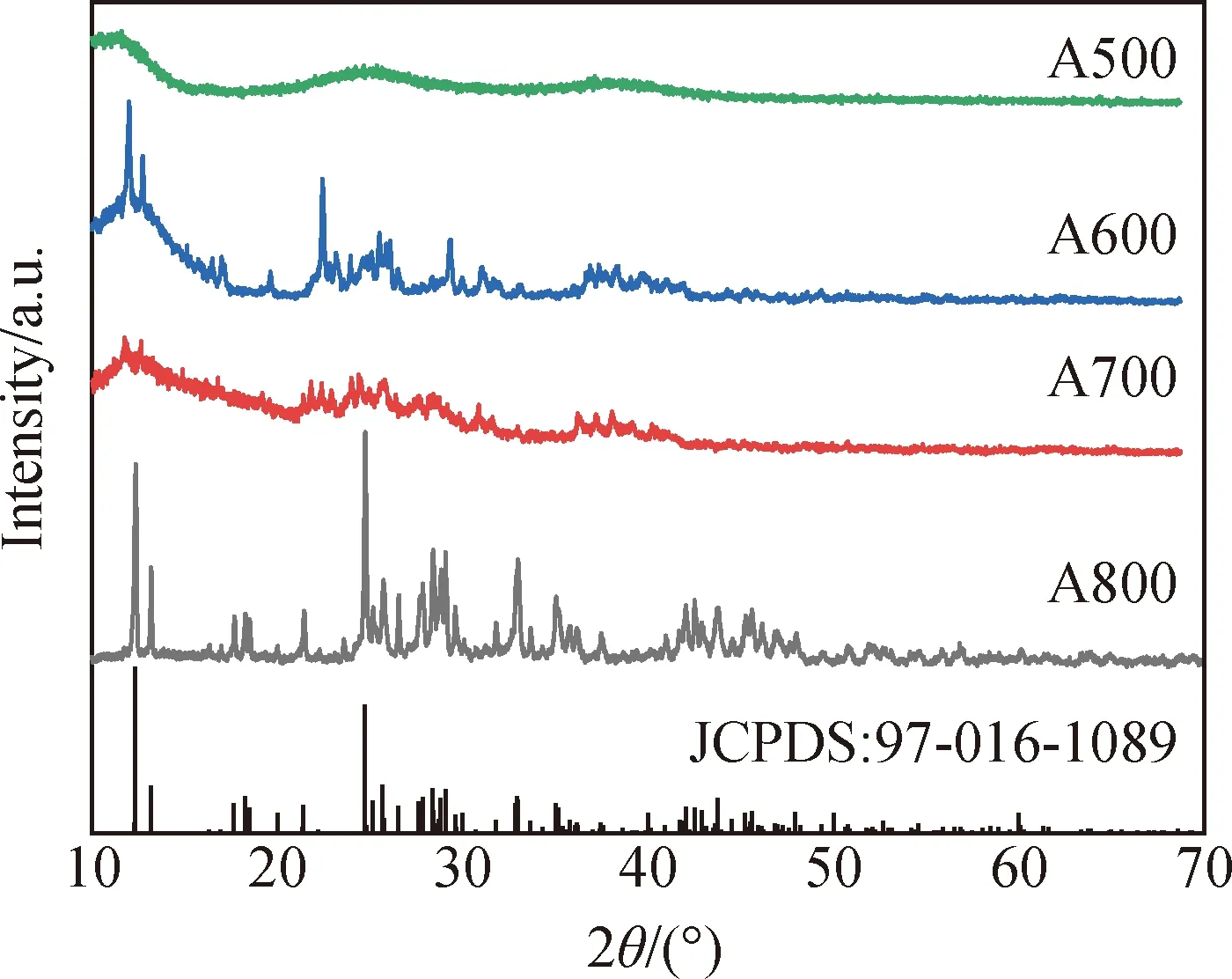
图2 不同温度下K2Ba[B4O5(OH)4]2·8H2O热处理产物的XRD谱Fig.2 XRD patterns of heat-treated productsof K2Ba[B4O5(OH)4]2·8H2Oat different temperatures
2.2 K2Ba[B4O5(OH)4]2·8H2O的FT-IR分析
图3是K2Ba[B4O5(OH)4]2·8H2O的FT-IR谱。图中位于3 449 cm-1处的吸收峰为O—H键的伸缩振动峰,位于1 623 cm-1处的吸收峰为H—O—H的弯曲振动峰,表明含有结晶水;而1 414 cm-1、1 013 cm-1处的吸收峰分别属于BO3和BO4的反对称伸缩振动峰,645 cm-1处属于BO3的面外弯曲振动峰[26],544 cm-1处为四硼酸根阴离子[B4O5(OH)4]2-的特征振动峰,该阴离子包含BO3、BO4两个结构单元[28],其整体峰形及位置与文献[26]报道的基本一致。

图3 K2Ba[B4O5(OH)4]2·8H2O的FT-IR谱Fig.3 FT-IR spectrum of K2Ba[B4O5(OH)4]2·8H2O
2.3 K2Ba[B4O5(OH)4]2·8H2O的TG-DTA-DTG分析
图4为K2Ba[B4O5(OH)4]2·8H2O的TG-DTA-DTG曲线。从TG曲线可看出,样品在46~500 ℃范围内有三个较明显的失重段:第一个失重段在46~80 ℃,失重率为4.8%,对应于失去2个结晶水(理论失重率为4.85%);第二个失重段在80~130 ℃,失重率为13.16%,对应于失去5个结晶水(理论失重率为12.13%),两个失重段分别对应于DTG曲线的两个峰;第三个失重段在130~550 ℃,失重率为8.75%,对应于8个羟基的脱失(理论失重率为9.72%)[16-17];样品的总失重率为26.74%,与理论值29.13%有一定差距,可能是样品长时间暴露在空气(30 ℃)中晶体风化失去1个结晶水所致[29]。在DTA曲线中,样品在72 ℃处出现较强的吸热峰,对应于样品中水的脱失;在584 ℃处出现较弱的放热峰,结合TG曲线及图2中A500、A600的XRD分析结果,推断为无水无定形物相的重结晶化;在674 ℃和790 ℃处的两个吸热峰,结合图2中A700、A800的XRD分析结果,分别对应于重结晶化后无水硼酸盐的分解和分解产物的熔融吸热[26,30]。

图4 K2Ba[B4O5(OH)4]2·8H2O的TG-DTA-DTG曲线Fig.4 TG-DTA-DTG curves of K2Ba[B4O5(OH)4]2·8H2O
以上结果表明,K2Ba[B4O5(OH)4]2·8H2O的热处理过程主要有5个阶段:首先在30~130 ℃分两个阶段,分别脱去3个结晶水和5个结晶水;然后在130~550 ℃范围内羟基脱失形成无定形无水硼酸盐;继续升高温度至600 ℃左右时,无定形物质逐渐转化为晶态物质;在600~700 ℃,晶态物质逐渐开始分解并形成无定形产物;最后随着温度的升高,产物进一步熔融后重结晶形成产物KBaB5O9。K2Ba[B4O5(OH)4]2·8H2O的热处理过程具体如式(1)~(6)所示。
K2Ba[B4O5(OH)4]2·8H2O30~80 ℃K2Ba[B4O5(OH)4]2·5H2O+3H2O
(1)
K2Ba[B4O5(OH)4]2·5H2O80~130 ℃K2Ba[B4O5(OH)4]2+5H2O
(2)
K2Ba[B4O5(OH)4]2130~550 ℃K2BaB8O14(ampoh)+4H2O
(3)
K2BaB8O14(ampoh)550~600 ℃K2BaB8O14(crystalline)
(4)
K2BaB8O14(crystalline)600~700 ℃KBaB5O9(ampoh)+KB3O5
(5)
KBaB5O9(ampoh)700~800 ℃KBaB5O9(crystalline)
(6)
2.4 K2Ba[B4O5(OH)4]2·8H2O的热分解动力学分析
采用Kissinger法[31]、Flynn-Wall-Ozawa法[32]、atava-estk法[32]对K2Ba[B4O5(OH)4]2·8H2O中结晶水的脱失进行非等温动力学分析。
Kissinger法:
ln(βT2p)=-ERTp+ln(ARE)
(7)
式中:β为升温速率,K/min;Tp为峰值温度,即失重变化最大时的温度,K;A为指前因子,min-1;E为活化能,J/mol;R为摩尔气体常数,8.314 J/(mol·K)。ln(β/T2p)与1/Tp呈线性关系,由斜率可求得活化能E,由截距可求得指前因子A。
Flynn-Wall-Ozawa法(FWO法):
lgβ=lg[AERG(α)]-2.315-0.456 7ERT
(8)
式中:α为转化率,%;G(α)为反应机理函数积分形式;T为热力学温度,K。由于不同β下各热谱峰顶温度Tp处的α值近似相等,则当式(8)中的温度T取为Tp时,lgβ与1/Tp呈线性关系,由斜率可求得E。该方法避开了反应机理函数的选取而直接求得E值,降低了因机理函数的不同而可能带来的误差[32]。
lgG(α)=lg(AsEsRβ)-2.315-0.456 7EsRT
(9)
式中:As和Es分别为采用atava-estk法求解得到的指前因子和活化能,min-1和J/mol。对于固定的β,将对应的T和α的数值代入方程,由lgG(α)对1/T作图,线性拟合,可求出Es与As。atava-estk法推导过程严密,可以直接从实验数据α、T计算动力学参数,因此用此方法求出的结果比较合理[32-33]。根据计算结果,要求保留符合条件(Es<400 kJ/mol)的Es及其对应的lgAs;然后筛选出Es和相应的lgAs,分别与FWO法和Kissinger法计算得到的E、lgA相比较,找出满足|(Es-E)/E|≤0.1的Es和|(lgAs-lgA)/lgA|≤0.2的lgAs,同时符合上述要求的G(α)才是该过程的最概然机理函数[33]。
K2Ba[B4O5(OH)4]2·8H2O的结晶水分两步脱失且第二步结晶水脱失为主要过程,因此本文主要就K2Ba[B4O5(OH)4]2·8H2O的第二步脱水过程进行热分解动力学研究。图5、图6分别为不同升温速率下K2Ba[B4O5(OH)4]2·8H2O的TG、DTG曲线。

图5 不同升温速率下K2Ba[B4O5(OH)4]2·8H2O的TG曲线Fig.5 TG curves of K2Ba[B4O5(OH)4]2·8H2Oat different heating rates

图6 不同升温速率下K2Ba[B4O5(OH)4]2·8H2O的DTG曲线Fig.6 DTG curves of K2Ba[B4O5(OH)4]2·8H2Oat different heating rates
利用Kissinger法求取活化能及指前因子,其拟合曲线如图7所示,根据拟合直线斜率计算出的活化能E为149.29 kJ/mol,同时根据其截距,结合活化能E计算得到的lgA为21.51 min-1,相关系数R2为0.996 9。使用FWO法得到的拟合曲线如图8所示,根据拟合直线斜率计算得出的活化能E为147.73 kJ/mol,相关系数R2为0.997 2。相关数据结果如表1所示,从结果可看出,使用上述两种不同动力学方程计算得到的活化能数值基本一致,且拟合相关系数都在0.99以上,线性相关性良好。这表明可信度较高,计算结果较为准确。
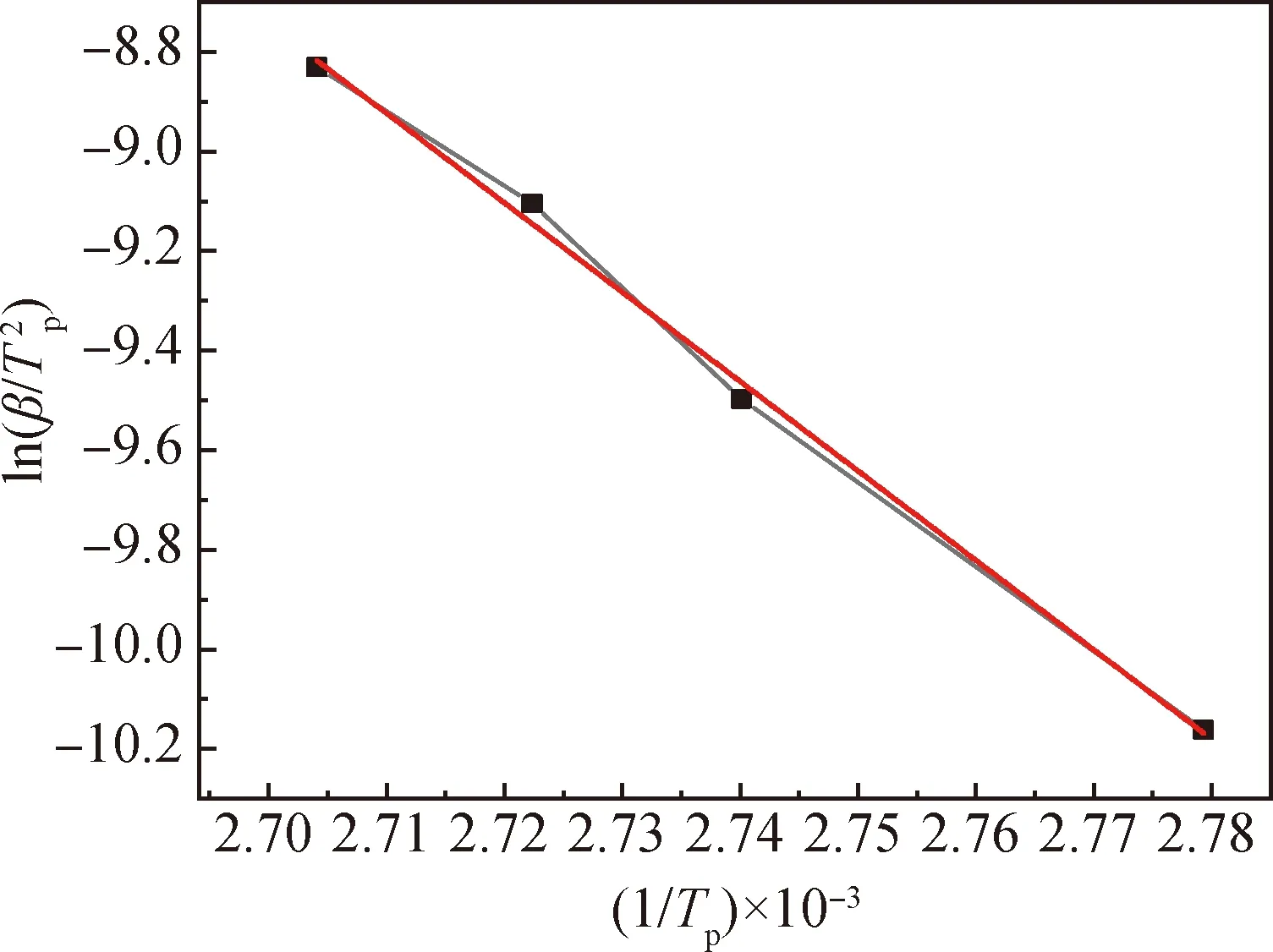
图7 Kissinger法中的ln(β/T 2p)与1/Tp拟合曲线Fig.7 Fitting curve of ln(β/TT2p) and 1/Tp in Kissinger method

图8 FWO法中的lg β与1/Tp拟合曲线Fig.8 Fitting curve of lg β and 1/Tp in FWO method

表1 使用Kissinger法和FWO法计算所得到的第二步脱水动力学参数Table 1 Second step dehydration kinetic parameters calculated by Kissinger and FWO methods

表2 等转化率下不同升温速率对应的温度Table 2 Temperatures at different heating rates at equal conversion rate
为推断出K2Ba[B4O5(OH)4]2·8H2O中第二步结晶水脱失过程中的热分解反应机理,选取30种动力学函数[33]作为待选函数,根据atava-estk法中的方程式(9),计算出不同升温速率β下热分解过程中转化率α所对应的lgG(α)值,再以lgG(α)对1/T作图,并对其进行线性拟合,利用拟合曲线的斜率和截距求取Es和lgAs,计算结果如表3所示。
根据表3的计算结果,对机理函数进行筛选。将Es、lgAs分别与FWO法计算得到的E和Kissinger法得到的lgA进行比较,筛选出满足|(Es-E)/E|≤0.1与|(lgAs-lgA)/lgA|≤0.2的机理函数,满足上述条件要求的为3号机理函数,结果见表4。K2Ba[B4O5(OH)4]2·8H2O的第二步结晶水脱失过程行为为三维扩散,其机理函数的微分形式为G(α)=(1-2α/3)-(1-α)2/3,相应的活化能Es为151.94 kJ/mol,指前因子的对数值lgAs为21.25 min-1。
表3 atava-estk法动力学方程计算结果Table 3 atava-estk dynamic equation calculation results

表3 atava-estk法动力学方程计算结果Table 3 atava-estk dynamic equation calculation results
No.β=5 K/minβ=10 K/minβ=15 K/minβ=20 K/minEs/(kJ·mol-1)lg As/min-1R2Es/(kJ·mol-1)lg As/min-1R2Es/(kJ·mol-1)lg As/min-1R2Es/(kJ·mol-1)lg As/min-1R21109.3314.790.756 0117.6619.120.840 9125.8217.350.825 5122.9917.470.902 42130.9017.760.790 1140.1522.200.869 7150.0420.660.855 7145.9020.780.925 83140.6218.580.805 1150.2023.050.882 0160.8721.620.868 6156.0721.740.935 44160.6521.620.830 8170.8926.160.902 7183.1924.940.890 5176.9925.070.951 0540.165.050.830 842.728.640.902 745.806.200.890 544.256.320.951 0636.514.620.813 138.958.190.888 641.735.710.875 640.435.840.940 5794.5711.540.743 7101.9615.760.830 2108.9813.840.814 3106.7113.960.893 3881.219.470.730 087.7313.580.818 193.7411.520.801 791.9511.650.882 7996.8113.410.862 8102.4217.370.927 4109.9215.520.916 9105.6115.640.968 51064.548.770.862 868.2812.500.927 473.2810.310.916 970.4110.430.968 51148.416.480.862 851.2110.100.927 454.967.740.916 952.817.870.968 51232.274.250.862 834.147.750.927 436.645.230.916 935.205.350.968 513387.2456.210.862 8409.6962.200.927 4439.6763.350.916 9422.4663.470.968 51424.203.170.862 825.616.610.927 427.484.010.916 926.404.130.968 515193.6227.580.862 8204.8432.210.927 4219.8431.360.916 9211.2331.480.968 516290.4341.870.862 8307.2747.180.927 4329.7647.330.916 9316.8447.450.968 51773.039.560.813 177.9013.440.888 683.4611.330.875 680.8711.450.940 51817.792.300.538 119.775.820.638 320.983.130.617 221.143.250.716 91930.753.950.638 633.677.600.735 535.875.040.716 335.655.160.809 72010.641.470.459 811.964.900.558 212.662.140.536 812.882.270.636 4

续表
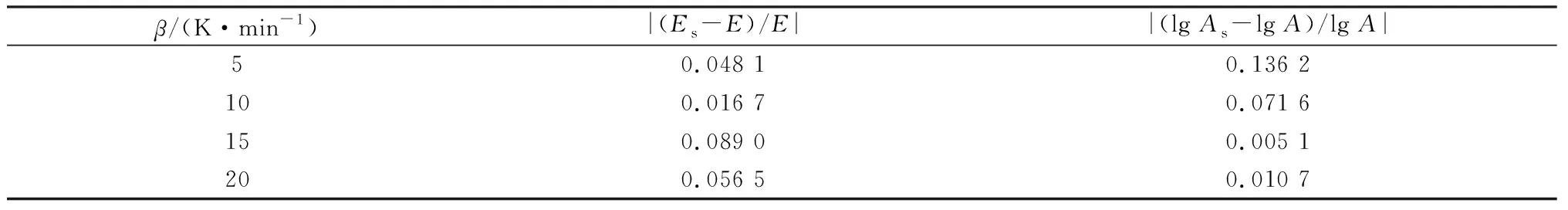
表4 动力学方程筛选结果Table 4 Dynamic equation screening results
3 结 论
本文利用溶液法制备了K2Ba[B4O5(OH)4]2·8H2O前驱体,并将前驱体进行热处理制备得到了KBaB5O9。通过前驱体在不同热处理温度下产物的物相分析,并结合其热分析结果研究了由K2Ba[B4O5(OH)4]2·8H2O热处理制备KBaB5O9过程中的物相变化过程,其物相变化主要经历脱结晶水、脱羟基、重结晶、再分解、熔融再结晶5个过程,其中结晶水分两步脱失。通过使用Kissinger法、Flynn-Wall-Ozawa法、atava-estk法对K2Ba[B4O5(OH)4]2·8H2O结晶水第二步脱失过程的动力学参数进行了计算,确定了其结晶水第二步脱失过程机理函数:G(α)=(1-2α/3)-(1-α)2/3,同时活化能Es为151.94 kJ/mol,指前因子的对数值lgAs为21.25 min-1。
