石榴石型固态电解质Li7La3Zr2O12的改性研究现状
2022-09-08李金瑶董生德马路祥
李金瑶,董生德,马路祥,周 园
(成都理工大学材料与化学化工学院,成都 610059)
0 引 言
目前,世界各国都面临着不同程度的能源危机、环境污染以及温室效应等问题。此外,新能源电力技术的大规模应用、电网规模储能站的建设、电子产品产业的扩大,以及国家“十三五”规划对新能源汽车的重视都亟待高能量密度、高安全性、低成本的先进储能技术,在众多解决方案中,锂金属电池被视为制造高能量密度储能器件的关键[1]。但是,锂金属电池在安全、稳定性等方面面临着诸多挑战,因此研究员们将目光投向了具有高安全性、长循环寿命、宽电化学窗口、高稳定性的全固态锂电池。全固态锂电池使用固态电解质代替传统碳酸乙烯酯、碳酸二乙酯等有机液态电解质,在提高电池能量密度及安全性的同时,也为开发新型锂空气电池、锂硫电池提供了可能性[2]。
由于部分固态电解质的离子电导率及活化能数值可与液态电解质相媲美,因此,其又被称为超离子或快离子导体[3]。图1为固态电解质分类示意图,固态电解质大致可分为聚合物类和无机物类,而无机物类又可根据阴离子类型分为氧化物类和硫化物类[4]。室温下聚合物类玻璃化转变温度高,结晶度高,室温离子电导率(<10-6S/cm)低,电化学稳定窗口(<4 V)窄,力学性能差,远不能满足实际应用的需求。而硫化物类虽离子电导率高,可达10-2S/cm,但其制备条件复杂,充放电稳定性低,环境稳定性差,与电极界面接触性差,因此具有一定的应用局限性。与硫化物类相比,氧化物类固态电解质电化学稳定性及热稳定性好,机械强度大,制备工艺简单,其中氧化物类中的石榴石型固态电解质Li7La3Zr2O12(LLZO)凭借良好的金属锂稳定性、较高的温度稳定性以及较高的离子电导率(>10-4S/cm)、较宽的电化学窗口(>6 V)等优点,成为了目前最具有前景的固态电解质之一,但存在脆性大、固-固接触阻抗大、制备工艺较烦琐、难以大规模生产等缺点。2007年,Thangadurai团队[5]首次烧结制备出纯立方相LLZO,其室温总体电导率和体相电导率都可达10-4S/cm,使氧化类固态电解质的电导率数量级达到了新的台阶。目前针对石榴石型固态电解质LLZO的研究主要集中在LLZO的合成方法及其改性、电解质与电极之间的界面接触、固态电解质的锂枝晶生长动力学等方面[6-9]。本文总结了石榴石型固态电解质LLZO的发展历程,从晶体结构、改性方式等方面来探究其面临的机遇与挑战。
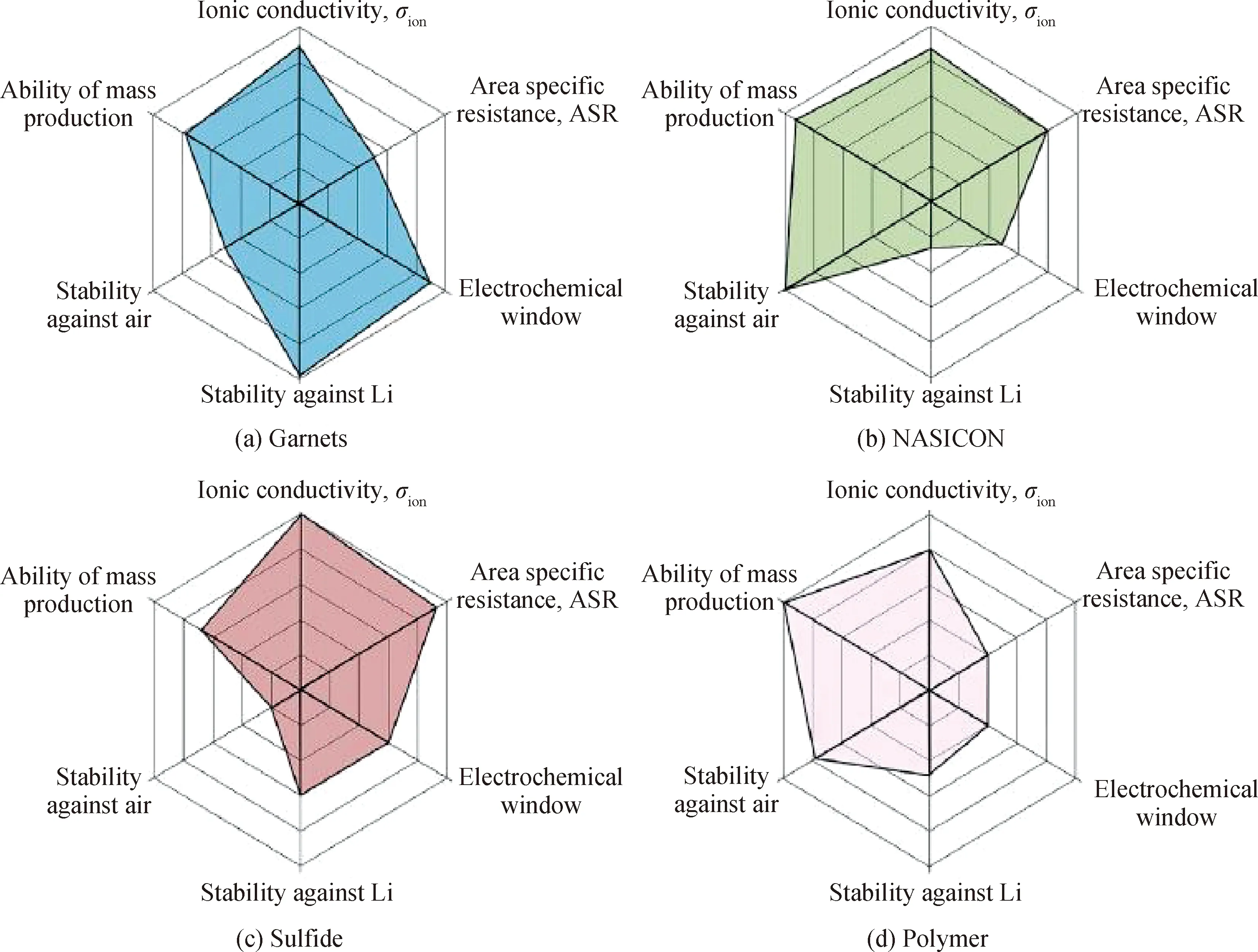
图1 几种常见固态电解质性能指标网状图[10]Fig.1 Network diagram of several common solid electrolyte performance indicators[10]
1 石榴石型固态电解质的结构
理想石榴石型晶体结构的表达式为A3B2(XO4)3,为面心立方晶体结构(空间群为Ia3d),图2是石榴石型晶体结构示意图,其中A可为Ca、Mg、Y、La以及稀土元素,有八个氧配位;B可为Al、Fe、Ga、Ge、Mn、Ni、V,有六个氧配位;X可为Si、Ge、Al,有四个氧配位,当X为Li+时,晶体就具备了Li+传导能力[11]。Cussen[12]利用中子衍射研究证实了石榴石型晶体结构中Li+可分布在三个不同的间隙位置:四面体(24d)、八面体(48g)、扭曲八面体(96h)。在结构上,四面体与八面体的连接方式是每个八面体连接两个四面体,而每个四面体通过共享面连接到四个八面体[13]。
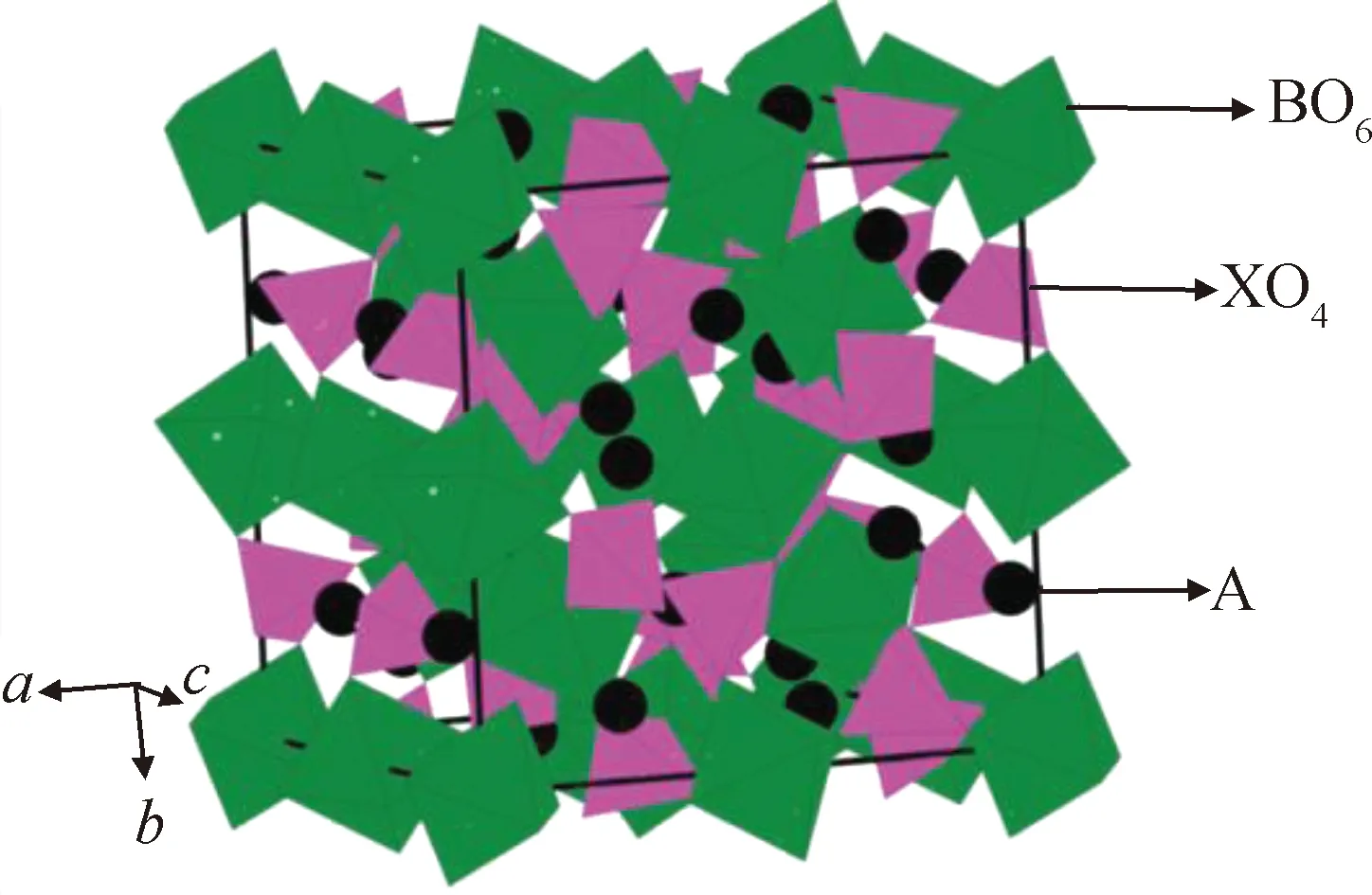
图2 石榴石型晶体结构示意图[14]Fig.2 Schematic diagram of garnet crystal structure[14]
按晶体中每晶胞单元含有的Li+数量可以将石榴石型晶体分为四种类型:Li3、Li5、Li6、Li7。研究[14]发现在一定的锂含量范围内,石榴石型晶体的离子电导率随锂含量的增加呈指数型增长。O’Callaghan等[15]发现了石榴石型晶体的Li3体系Li3Ln3Te2O12(Ln=Y、Pr、Nd、Sm、Lu),在该体系中,晶格常数随Ln离子半径增大而增大,Li+全部位于四面体中,由于在四面体中的Li—O键较强,Li+位置是固定的,几乎没有移动性,对离子电导率没有贡献,因此Li3体系的石榴石型晶体具有低的离子电导率。
石榴石型晶体中的Li5、Li6以及Li7又被称为锂填充(富锂)石榴石,富锂石榴石型晶体中的Li+在占据部分四面体位点后,剩余的Li+填充在八面体位点上。与占据四面体位点不同的是,处于八面体上的Li+被认为是可迁移的,此外,Li+在四面体上的传输空位增加,也将获得更多的Li+迁移路径。Li5体系Li5La3M2O12(M=Nb、Sb、Ta)的石榴石型晶体结构中,Li+占据了80%的四面体位点,40%的八面体位点,离子电导率较Li3体系有所提升。但由于八面体中的Li+含量较低,因此Li5体系的离子电导率仍较低。
通过二价碱土离子部分取代La3+,可以进一步得到Li+浓度增加的Li6体系的石榴石型晶体Li6ALa2M2O12(A=Mg、Ca、Sr、Ba,M=Nb、Ta)[16]。二价碱土金属的取代使晶体结构中八面体占有率增加,四面体占有率减少,较Li5体系具有更多四面体Li+空位。但大多碱土金属离子半径都小于La离子半径,导致取代后石榴石型晶体晶胞尺寸缩小,Li+传输通道变窄,因此,离子电导率提升并不显著[17]。
通过在Li5La3M2O12(M=Nb、Sb、Ta)中以Zr取代M,同时填充Li+维持电荷平衡,得到了Li7体系的石榴石型晶体Li7La3M2O12(M=Zr、Sn、Hf)。2007年Murugan采用固相法在1 230 ℃合成了空间群为Ia3d的立方相结构的Li7La3Zr2O12(c-LLZO)[5]。然而,Awaka等[18]发现当烧结温度仅为980 ℃时,Li7La3Zr2O12会形成部分空间群为I41/acd的四方相晶体结构(t-LLZO),且离子电导率较低。Percival等[19]则报道当烧结温度提高到750 ℃以上时,就能观察到晶体结构由四方相向立方相转变。这表明LLZO具有在适当条件下可发生相转变的立方相和四方相两种晶体结构,如图3所示,且在低温下一般以四方相晶体结构的形式存在[20]。Awaka等[18]还解释了两种晶体结构具有不同离子电导率的原因,其中在立方相晶体中Li+仅有Li1和Li2两种占据方式,因此立方相晶体中含有较多的Li+空位,而四方相晶体中Li+则完全占据了Li1、Li2、Li2′三种位点,导致Li+的可移动位点较少,传输速率较低,离子电导率较低。同时,在四方相晶体结构中Li+与空位都呈有序排布,而立方相晶体结构中Li+呈无序分布,Li+传输自由度的增加将提高离子电导率[13,18]。此外,相比于立方相晶体结构中的Li-Li距离,四方相晶体结构中的Li-Li距离也较长,而跃迁距离也是影响离子电导率的因素之一。

图3 LLZO的两种晶体结构[20]Fig.3 Two crystal structures of LLZO[20]
2 石榴石型固态电解质的改性方式
c-LLZO 虽具有众多优势,但还存在室温下立方相晶体结构不稳定、与电极界面接触性差、固-固界面阻抗高、离子电导率较低(与液态电解质相比)等问题。为了有效稳定c-LLZO晶体、减小与正负电极固-固接触的界面阻抗、提高烧结效率、增加Li+传输通道等,可采取掺杂元素、优化合成工艺、设计制备复合固态电解质等方式进行改性。
2.1 元素掺杂
元素掺杂工艺简单,成本低廉,易于操作,是提高石榴石型固态电解质离子电导率最有效、最常见的方法之一。通过选择其他不同离子价态及半径的元素对LLZO进行部分Li位、La位、Zr位、O位掺杂,引入更多的锂空位使锂排布更加紊乱,最后得到无序立方相,从而提高离子电导率,目前认为稳定立方相所需的锂空位数值范围为每单位0.125~0.500 mol[21]。通过密度泛函数理论计算得出可进行Li位掺杂的元素有Al3+、Ga3+、Fe3+等,为了维持晶格内电荷的平衡,一个Al3+取代一个Li+同时会产生两个锂空位,在一定程度上提高离子电导率。但掺杂的Al3+会进入到Li+通道中,堵塞其传输路径,离子电导率减小,所以在进行Li位元素掺杂时,需要合理控制掺杂量[22]。通过中子衍射研究表明,立方相石榴石晶体中锂含量最高可达7.5,当锂含量为6.4±0.1时,Li+电导率最高[23]。Guo团队发现当使用Al、Ga对Li位进行掺杂时,最佳掺杂量为0.25~0.3,此时合成的纯c-LLZO在室温下离子电导率数量级超过了10-4S/cm[24]。目前可进行La位掺杂的元素有Ca2+、Ba2+、Mg2+、Sr2+等,其中Liu等在1 000 ℃下成功合成了Mg掺杂的立方相LLZO,室温下离子电导率可达5.56×10-5S/cm,烧结温度比未掺杂Mg的LLZO低约230 ℃,此外Mg掺杂的LLZO对500~800 nm可见光的透射率能达到10%~12%,为未来透明固态电解质的应用提供了参考[25]。但由于La位掺杂在一定程度上会改变Li+迁移通道大小,从而改变Li+的迁移路径,影响Li+传输速率,因此目前针对La位掺杂的研究还比较少。此外,还可在Zr位进行元素掺杂,如Mo6+、Nb5+、Ga3+、Ta5+等,掺杂离子的价态与半径对LLZO的性能有很大影响,部分高价金属离子的掺杂能增加晶体结构中锂空位浓度,Li+更容易发生迁移,同时还可稳定立方相结构。Huang等[26]选取Sr2+和Mo6+共掺杂,在1 100 ℃下成功制备了Li6.65La2.95Sr0.05Zr1.8Mo0.2O12,离子电导率可达6.43×10-4S/cm,相对密度为95%,其中Mo6+掺杂可有效保证立方相的形成,Sr2+掺杂可提高样品的离子电导率和相对密度。可进行O位掺杂的元素是F,F的电负性比O高,与La、Zr之间的离子键特性更强,更有利于Li+的传导迁移。研究[27]发现,通过适量的氟化物掺杂不仅能获得纯c-LLZO,还能消除电解质内部晶界,获得致密显微结构,提升离子电导率。
2.2 烧结制度
LLZO需要在1 200 ℃左右的高温下长时间烧结才能获得致密的烧结体,但Li2O在1 000 ℃以上会升华,因此在较高温度下长时间烧结会产生严重的“失锂”问题,生成低导电性的La2Zr2O7[28]。传统的解决方法是在氧化铝坩埚中埋入大量的“母粉”生坯,以补偿锂损失,但母粉中含有昂贵的稀土元素,会使原料成本较高。此外,在长时间的高温烧结过程中,晶体会发生异常晶粒生长现象,降低产物致密度和机械强度。为获得致密石榴石型固态电解质LLZO,目前主要采用添加助烧结剂、优化烧结工艺、氧气气氛烧结、锂补偿和提高细粉质量等策略。Dermenci[29]报道了在LLZO中添加质量分数为1%的Li1.5Al0.5Ge1.5(PO4)3(LAGP)助烧结剂,能提升样品的致密度和电化学性能,室温离子电导率可达到0.78 mS/cm,活化能为0.17 eV,这是因为LAGP处于LLZO晶粒间,保持了离子导电的连通性。而优化烧结工艺则可通过,如热压(HP)、火花等离子烧结(SPS)、场辅助烧结(FAST)等来实现,此时LLZO将在高压密闭环境中被压实烧结,得到较为致密的结构[30-33]。但这些方法所使用的设备复杂、昂贵,且生产效率低,因此不利于商业化。He等则研究了LLZO孔隙形成的原因,发现通过简单的氧辅助烧结可以获得更为致密的、消除孔隙的LLZO,相对密度大于97%,维氏硬度大于8.85 GPa[34]。Wang团队认为无母粉法制备的样品比母粉法制备的更具有优势,在没有母粉的情况下,LLZO块体中多余的Li可自补偿于高温下损失的Li,此方法成本低,操作简单,制得的样品晶粒小,晶界致密,导电性高[35]。但该方法制备的LLZO重现性不佳,收率较低,因此Wang团队又提出了一种相互补偿锂损失的方法来有效制备高导电性的LLZO,得到的样品具有致密显微结构、高相对密度、高含锂量、高电导率等优势,此外,该方法还可同时烧结10片以上LLZO电解质片,大大提高了烧结效率[36]。
2.3 LLZO/聚合物复合改性
无机固态电解质LLZO刚性强,与正负电极接触差;聚合物固态电解质室温离子电导率低,电化学窗口窄。为解决固态电解质所面临的问题,科研人员将无机固态电解质和含锂盐的聚合物固态电解质复合,得到了具有高离子电导率、高机械强度以及与正负极良好界面接触等优点的复合固态电解质。在这种复合体系中,Li+被认为可通过聚合物基体、无机填料、复合界面进行传输,其中,Li+传输通道、活性Li+浓度和Li+迁移率共同决定了复合固态电解质的离子电导率[37]。因此,在制备复合固态电解质时,需严格控制无机固态电解质LLZO的含量,因为过量的LLZO颗粒会发生团聚,破坏Li+传输路径,复合固态电解质离子电导率下降,界面阻抗增大[38]。常见的聚合物电解质基质有聚氧化乙烯基(PEO)、聚偏氟乙烯基(PVDF)、聚丙烯腈基(PAN)、聚甲基丙烯酸甲酯基(PMMA)等,PEO以其对金属锂良好的稳定性成为了最早受到科研人员关注的聚合物电解质基质,但其室温下结晶度高,导致离子电导率较低。因此,Sun团队对其进行改性,制备了Li6.4La3Zr1.4Ta0.6O12(LLZTO)-PEO复合固态电解质,将粒径为200 nm的LLZTO颗粒与PEO复合,获得了较高的室温离子电导率(1.6×10-4S/cm),并在此基础上研究了具有不同粒径LLZTO颗粒的复合固态电解质对锂枝晶的抑制效果[39]。而Goodenough团队所制备的LLZTO-PEO复合材料优越性表现在,对锂金属电极的界面稳定性增强,具有较高的柔韧性及抑制锂枝晶生长的能力[40]。PEO-LLZTO复合固态电解质示意图如图4所示,作者还发现不同比例的无机填料与聚合物复合将得到截然不同的效果,LLZTO占比10%(质量分数)的复合固态电解质具有更大的灵活性和更低的成本,可适用于小型柔性储能装置,而LLZTO占比80%(质量分数)的复合固态电解质具有更高的机械强度和更好的安全性,可适用于电动汽车内的大型电池。Hu等则报道了利用细菌纤维素为模板制备的三维纳米LLZO-PEO复合固态电解质,良好网络结构的LLZO通过构建高速传输Li+通道以及促进聚合物基质与锂盐的解离显著提高了离子电导率,室温下为1.12×10-4S/cm[41]。此外,复合固态电解质的稳定窗口可达6.0 V,能满足市面上绝大部分高压锂金属电池的需求,同时具有极佳柔韧性,能有效解决无机固态电解质所面临的脆性问题。总之,复合固态电解质集无机与聚合物电解质优势于一体,有望突破固态电解质的困境。
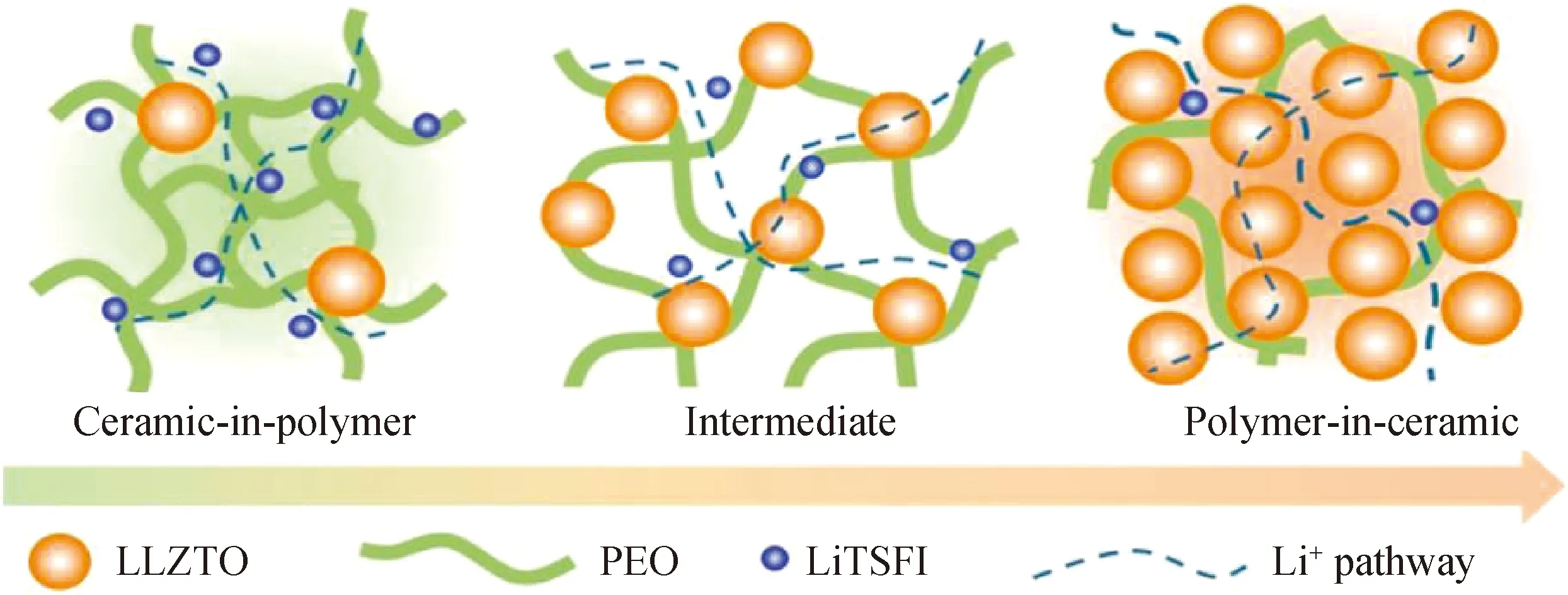
图4 PEO-LLZTO复合固态电解质示意图[40]Fig.4 Schematic diagram of PEO-LLZTO composite solid-state electrolyte[40]
2.4 包覆修饰改性
通过原子层沉积、等离子沉积、气相沉积等技术对固态电解质进行包覆修饰,在其表面构建超薄锂离子导体,这层锂离子导体能实现电解质表面从疏锂到亲锂的转变,使电解质与电极之间形成紧密的界面接触,降低界面阻抗,同时还能提高固态电解质的电化学稳定性。Hu等研究表明,Sn、Ge、Mg等金属可与熔融Li反应形成合金,提高电极与电解质间的接触性,同时还研究了不同金属沉积厚度对界面阻抗的影响,发现极微量的金属沉积层也能起到改善界面湿润性的效果,但该方法实验过程较长,成本较高,难以满足工业生产的需要[42]。此外,他们通过原子层沉积法在电解质表面沉积能被锂化的Al2O3,得到的Li-Al2O3有效地改善了LLZO与金属锂电极的界面接触问题,将界面阻抗从1 710 Ω·cm2降低到1 Ω·cm2[43]。Liu团队则提出了一种新思路,用转换型电极材料来改性LLZO与金属锂电极的接触界面,使用MoS2来包覆LLZO,当Li与MoS2接触后将反应生成Li2S/Mo中间过渡层,中间过渡层可通过调节电流分布和锂沉积来降低界面阻抗和抑制锂枝晶,最终界面阻抗仅有14 Ω·cm2,这项工作为优化中间过渡层以设计高性能固态电池开辟了一个新的研究方向[44]。
总之,石榴石型固态电解质LLZO在能量密度、电化学稳定性、温度稳定性和安全性等方面具有极大潜在优势,被认为是最有发展前景的固态电解质之一。但目前已有文献报道指出石榴石型固态电解质的离子电导率上限可能为10-3S/cm,仍比有机液态电解质低一个数量级。因此,针对LLZO的改性还有大量研究空间,其中,将各个改性手段综合利用,相互协调,是未来固态电解质的发展方向。
3 结语与展望
固态电池已成为未来锂电池发展的必经之路,电解质作为电池最主要的部件,其性能的好坏直接决定了电池性能的优劣。石榴石型固态电解质LLZO因其较高的离子电导率、较宽的电化学窗口以及与负极锂较好的相容性等优势吸引了大批研究人员的目光,但与传统有机液态电解质相比,LLZO还存在着离子电导率低以及与电极固-固界面接触等问题。目前可通过掺杂包覆、优化烧结方式、制备复合固态电解质等方式来对其进行改性,但实验操作过程复杂,成本高,并不利于实际应用和商业化。因此,研制出离子电导率高、安全性高、电化学窗口宽、成本低的理想型固态电解质LLZO仍有较长的路要走。未来可采用构建固态电解质离子运输模型,深入了解LLZO晶体结构,通过元素掺杂对石榴石型晶体结构进行优化,并寻找新型掺杂元素以及探究多元掺杂对固态电解质LLZO结构性能的影响。同时研究具有高离子传输能力,能均匀化界面阻抗并隔绝电子的缓冲材料,来有效抑制锂枝晶生长,降低界面阻抗,提高临界电流密度,解决固态电解质与电极固-固界面接触的问题,双管齐下,得到离子电导率高且与电极界面接触良好的固态电解质。另外,可将具有不同特点的电解质进行复合,设计出渗流结构优异、制备工艺简单、离子电导率高、强度高以及与电极界面兼容性优异等特点的复合固态电解质,以满足规模化生产应用的需要。据了解,未来电池的结构将朝着小型、轻量、柔性的方向发展,但目前固态电解质的薄膜化技术仍无法解决机械强度与阻抗相矛盾的问题,因此需深入探究柔性固态电解质薄膜内部结构关系并优化薄膜沉积技术、流延技术等相关工艺,以实现高强度、低阻抗LLZO薄膜的制备及大规模生产的目标。最后,还需要抓住计算机科学技术的发展优势,利用高通量材料集成计算,整合材料设计过程中的数据、代码等以获得固态电解质组分、结构与物性之间的关系,高效、准确地研发出理想化的固态电解质。
由于科研工作者的不断努力,全固态锂电池技术正在逐步被完善,在此,希望相关技术能尽快突破瓶颈,实现全固态锂电池的产业化,人类的储能技术将翻开崭新的一页。
