煤渣制备NaP型沸石的响应面法优化工艺研究*
2022-09-08滕柳梅马健坤卜亦凡
滕柳梅,张 强,吴 杰,马健坤,卜亦凡
(1. 重庆文理学院 材料科学与工程学院,重庆 永川 402160; 2. 龙佰四川钛业有限公司,四川 德阳 6182093;3. 重庆市计量质量检测研究院,重庆 渝北 401120)
0 引 言
随着社会经济的发展,人类对电能的需求逐步增加。虽然太阳能、风能、氢气等可再生能源的大规模使用可以有效减少化石燃料的使用,但是煤基燃料在能源结构中的主导地位短期内仍无法动摇[1-4]。一般而言,煤渣的主要成分为SiO2、Al2O3、Fe2O3、CaO、MgO以及Pb、Cd、Hg等重金属[5]。煤渣的主要矿物相为莫来石(Al6Si2O13)、石英(SiO2)、磁铁矿(Fe3O4)、石灰(CaO)。根据煤渣中Al2O3的含量,可分为高铝煤渣和低铝煤渣。某些高铝煤渣中Al2O3含量甚至可以达到50%以上,与某些低品位铝土矿中的Al2O3含量相当[6],具有很大的利用价值。
目前,人们对粉煤灰的高价值转化的研究有很多,最为常见的方法就是用制备沸石[7]。沸石是一种铝硅酸盐型微孔材料[8],广泛应用于催化、吸附和干燥等领域[9-10]。粉煤灰制备沸石的方法有很多种如:水热法[11-12]、机械活化[13]、微波辅助[14]、热声化学[15]和无溶剂法[16]等。而针对煤渣的高价值转化的研究较少,多数的煤渣被用于建筑行业,其余主要存储在垃圾填埋场,导致土壤和地下水污染[17]。因此,对煤渣的高价值利用势在必行。
因此本文提出了以煤渣为原料,采用水热法一步合成NaP型沸石。通过响应面法确定了合成沸石的最佳实验条件和回归模型。采用X射线衍射(XRD)、扫描电子显微镜(SEM)、和Brunauer-Emmett-Teller(BET)对样品进行了表征。基于本研究的结果,可以为利用煤渣生产高附加值产品提供了一个简单、合适的方法。
1 实 验
1.1 沸石的制备
1.1.1 实验试剂
实验过程中所用的煤渣取自广西百矿公司,经过球磨预处理后得到粉末(长沙米淇YXQM-4L球磨机200 rpm,30 min)。其主要成分通过X射线荧光光谱法(XRF)分析得知,主要含有57.07%(质量分数)SiO2,27.88%(质量分数)Al2O3和其他化合物(见表1)。NaOH为分析纯,购于成都科隆公司。

表1 煤渣化学成分(%)(质量分数)
1.1.2 沸石制备
称取1 g煤渣与0.2~1.0 g的NaOH粉末混合,置于盛有10 mL去离子水的反应釜中,放入搅拌子后将反应釜转移至90~130 ℃油浴锅中反应2~10 h(搅拌速率10 r/min)取出,待反应产物冷却后过滤,滤渣洗涤至中性后干燥24 h存放备用。
1.2 样品的性能及表征
实验原料的成分用美国ARL Perform’X X射线荧光光谱仪;样品物象和结构分析采用日本Rigaku D/Max 120X射线衍射仪(Cu Kα辐射,波长为0.154056 nm);样品的形貌采用日本Hitachi S-4800扫描电子显微镜;样品的比表面积采用美国Micromeritics ASAP 2020比表面积测试仪。
2 结果与讨论
2.1 响应面对水热法制备沸石工艺优化
2.1.1 响应面法实验设计和数据处理
采用 Design Expert 8.0.5 软件中的 Box-Behnken实验设计法对沸石的合成条件进行优化,实验设计三因素五水平的响应面分析实验,分别用 A,B,C 表示 3 个关键因素,分别以-2,-1,0,1,2 编码代表每一个自变量的实验水平,以相对结晶度为响应值。具体实验设计见表2 。

表2 Box-Behnken实验因素水平及编码
式中,Izi为沸石样品的主峰强度,Isi为标准沸石的主峰强度。相对结晶度用2θ=12.48、17.76、20.88、21.66、28.1和33.38°的6个主要峰计算相对结晶度[18]。
通过Box-Behnken实验方法设计了20组实验,将实验制得的滤渣进行XRD表征,并对实验数据进行处理,得到响应因子面积的BBD模型测量值和预测值如表3所示。从表3可以看出,实验号3、4、6、7、12、15为零点实验,以减少计算实验的随机误差,其余为分析因子实验。当T=100 ℃、CNaOH=1.75 mol/L、t=4 h时,样品的相对结晶度仅为19.19%(实验号3),水热时间增加到8 h时,结晶度显著增加至51.16%(实验号4),增加了1.67倍;而当T=120 ℃、CNaOH=1.75 mol/L时,水热时间从4到8 h,样品的相对结晶度仅增加了0.27倍(实验号16、18)。说明在反应温度较低的条件下,较长的反应时间更能促进了P型沸石的形成;在高温条件下,水热时间对分子筛结晶的影响减小。在较低温度T=100 ℃,碱溶液浓度从1.25 mol/L增加到1.75 mol/L,样品的结晶度增加了1.3倍(实验号2、3),而温度T=120 ℃的相当条件下,结晶度依然增加了1.3倍(实验号17、18);说明碱溶液浓度影响对结晶度的影响不受温度变化而变化。当水热时间和碱溶液浓度一致时,反应温度的升高导致结晶度大幅度的增加(实验号10、20),说明反应温度对合成沸石有较大的影响。在水热时间为6 h, NaOH浓度为1.5 mol/L,水热温度为130 ℃时,得到峰强度最高的相对结晶度(79.2%)(实验号20)。
根据表3中的实验数据,采用design-Expert 8.0.6软件进行二次回归拟合,得到水热时间(A)、碱溶液摩尔浓度(B)、水热温度(C)的二次多元回归方程如式(1)所示。
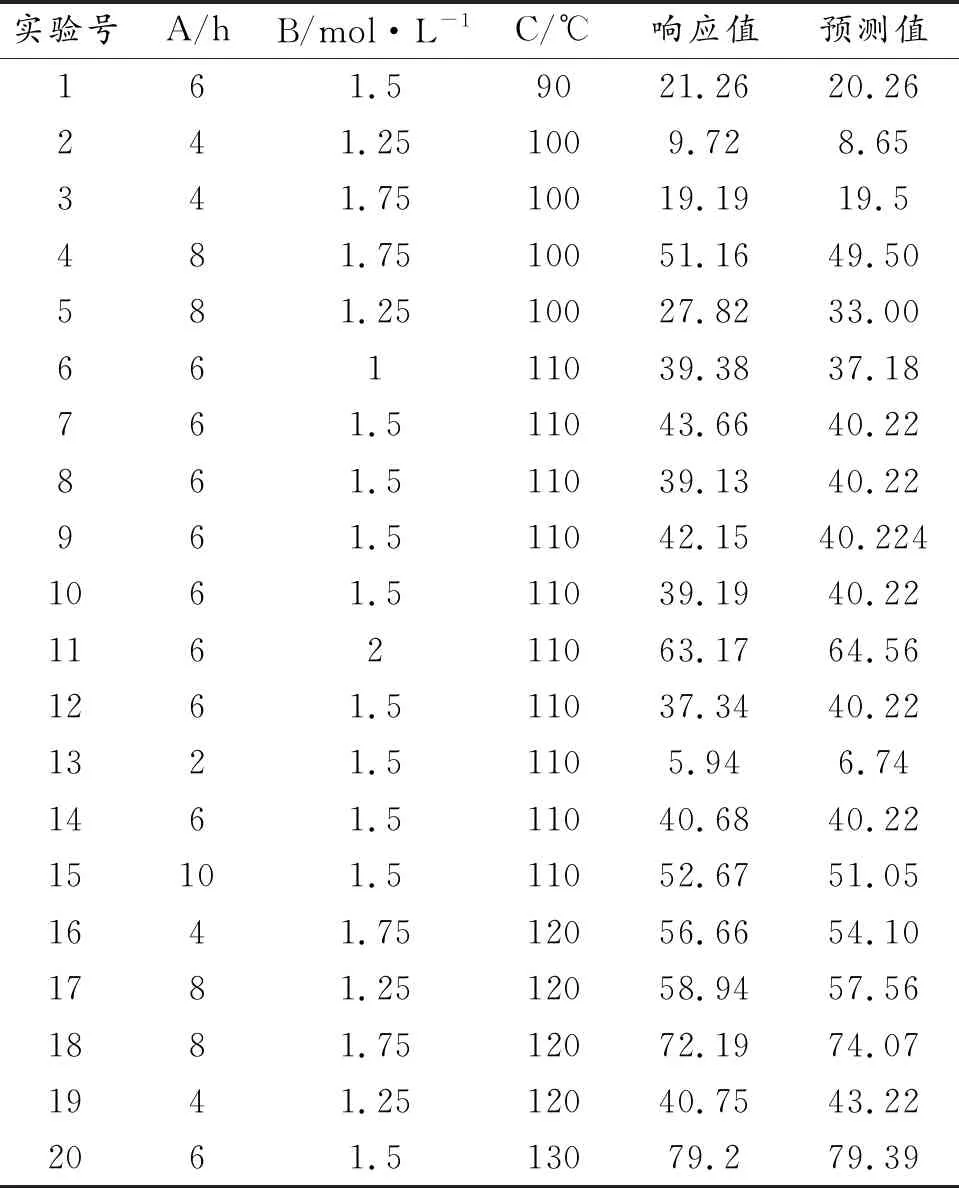
表3 Box-Behnken实验设计方案及结果
Y=40.22+11.08A+6.85B+14.78C+1.4AB-2.04AC-0.46BC-2.83A2+2.66B2+2.4C2
(1)
从回归方程中看A、B、C的系数为正,说明对反应因子的影响是正向影响。根据各系数的取值,各因素的显著性顺序为水热温度(C) >水热时间(A) >碱性溶液的摩尔浓度(B)。
2.1.2 方差分析
采用二次多元回归方程模型进行方差分析,分析结果如表4所示。
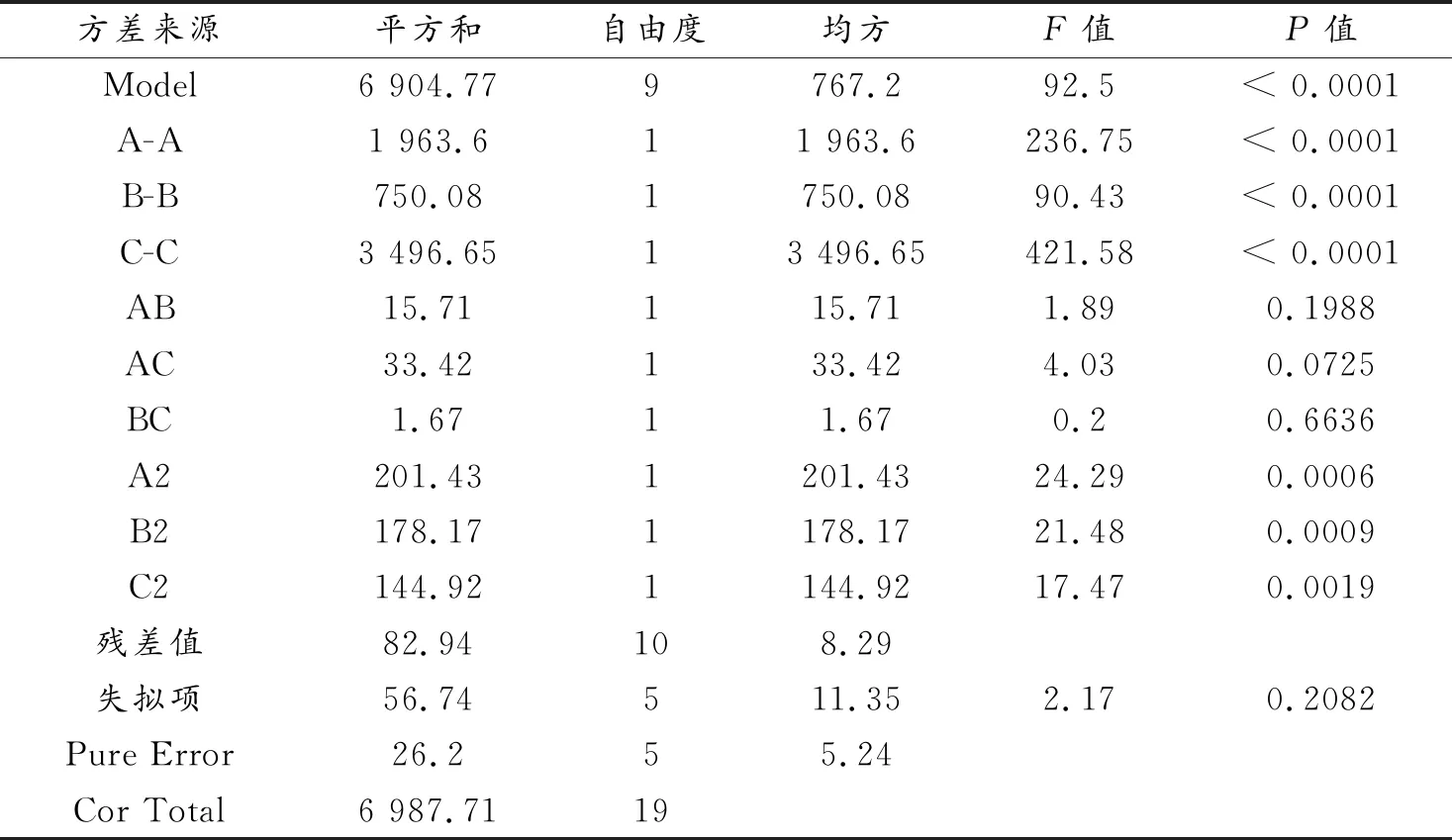
表4 方差分析结果
R2=0.9881,R2(adj)= 0.9774,R2(pred)=0.934,信噪比=35.674,变异系数CV=6.86
由表4可知,该方程回归模型P值<0.001达到了极显著水平;相关系数R2=93.4%,失拟检验值0.2082>0.05,影响不显著,由于失拟项是反映实验数据与模型不相符的概率,从而证明此实验设计合理。从表4所示的分析数据来看,A、B、C、A2、B2、C2项(P值<0.01)都是极显著项,其他模型的项不显著(P值>0.05)。结果表明,水热时间、碱溶液浓度、反应温度3个单因素对沸石合成有显著影响,进一步证明了3因素对响应值影响的顺序为反应温度>水热时间>碱溶液浓度(C>A>B),而三因素的交互作用对沸石合成无显著影响。
2.1.3 残差分析
在图1(a)中呈现了沸石相对结晶度实际值与预测值的点基本分布在拟合直线上,决定系数R2=0.934,说明在实验范围内93.4%的沸石合成数据的离散情况均可以用此模型来解释[19],因此此模型可以较好的描述各变量和响应值之间的关系。图1(b)中证明了实验组的随机性,且拟合效果好,无异常点,实验结果可信性强。图1(c)中残差分析与预测值之间的关系可以直观的看出,实验点均在规定范围内,只有少数点偏离了直线,大部分实验点都靠近直线两侧,即表示模型可行性较高,拟合程度好[20]。

图1 相对峰强度的诊断图 (a) 预测值与实际值的关系图, (b) 残差与预测值关系图,(c) 残差与正态分布关系图
2.1.4 响应面分析
三维响应面分析图是回归方程的直观反映。它能直观地反映各因素在响应面上的影响程度以及两个因素之间的交互作用程度。从图2中曲线的陡度可以看出各种因素对沸石合成的影响。曲线越陡,该因素对沸石合成的影响越显著。曲线越平,对沸石合成的影响越小。从图2的响应轮廓图和响应面图可以看出,这3个因素都与沸石合成呈正相关关系,两者组合对沸石合成的交互作用不显著。

图2 响应面交互作用与相对强度的关系图
2.2 不同时间制备沸石的性能表征
2.2.1 XRD表征
图3是在CNaOH=1.5 mol/L、T=130 ℃、不同时间条件下合成沸石的XRD图。从图3中可以得知,煤渣中主要的物相是SiO2,当与NaOH溶液混合反应30 min后,物相几乎没有发生变化,证明沸石还未形成。当反应时间增加至1 h,物相开始在2θ= 12.48、17.76、20.88、21.66、28.1和33.38°的位置出现很弱的衍射峰,并且几乎没有其他杂质峰出现;这些衍射峰正好对应着P型沸石的产生[16],说明在反应1h时,沸石已经开始生长。随着反应时间的延长,沸石的特征峰越来越明显,证明长成的沸石越来越多,当t>6 h后,沸石的衍射峰几乎没有变化,这可能是因为沸石没有再继续生长。因此可以从XRD图中得出结论:当CNaOH=1.5 mol/L、T=130 ℃时,t=6 h可能是煤渣转化P型沸石效率最高。
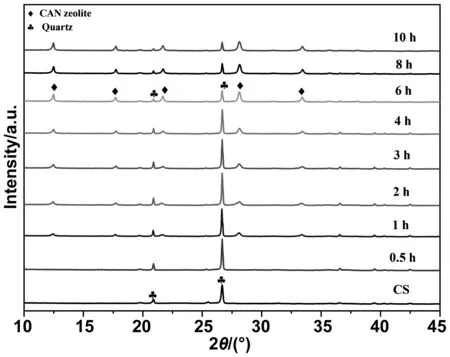
图3 煤渣和不同时间条件下样品的XRD图(130 ℃, 1.5 mol/L)
2.2.2 电镜表征
图4是煤渣和不同时间下制备的沸石样品的SEM图。从图4中可以看出,煤渣形状不规则且表面光滑。与碱溶液混合反应0.5 h后,煤渣被NaOH侵蚀,出现粗糙的表面并形成了共融体。反应1 h后沸石开始生长,随着反应时间延长形成的沸石越来越多,特别是在反应时间6 h时,可以明显看出在煤渣上长出了大量沸石。在反应时间大于6 h后,沸石的形状几乎没有变化。这与XRD的检测结果一致,进一步证明了反应时间6 h是煤渣转化为沸石的最佳反应时间。

图4 煤渣和不同时间条件下样品的SEM图(130 ℃,1.5 mol/L)
2.2.3 BET表征
采用N2等温脱附试验对原料和合成沸石的比表面积、孔容和平均孔径进行了分析。结果如图5和表5所示。在煤渣和最优条件下合成的沸石对应的比表面积分别是6.76和42.42 m2/g,孔容分别是0.028和0.13 cm3/g。沸石的表面积和孔容都有显著增加,主要是由于在煤渣表面形成了P型沸石,而沸石具有较高的孔隙率增加了煤渣的表面积和孔容。图5中所有样品的N2吸附-脱附等温线均为I型等温线[21]。根据应用化学(IUPAC)等温线分类,图5中最优条件制备的沸石样品为II型等温线,可能是由于杂质占据了沸石的孔隙和通道,使得N2在孔隙内的吸附量有限。

表5 煤渣和沸石的比表面积和孔容

图5 煤渣和P-沸石的BET图
3 结 论
(1)本文采用一步水热法合成了NaP型沸石,合成的NaP型沸石具有多孔结构及较大的比表面积,可用于催化剂载体、吸附等领域,该方法为高价值利用煤渣提供了新的途径。
(2)通过响应面法分析,确定了制备NaP型的最佳工艺条件为反应温度130 ℃,碱溶液浓度1.5 mol/L,反应时间6 h。通过对不同时间下合成的沸石进行了性能表征和分析,结果与响应面法选择的最佳工艺条件一致。
