Epothilone D对体外培养的BTBR小鼠皮质神经元兴奋性突触结构的影响*
2022-09-07陈永红刘永峰蔚洪恩
陈永红 杨 桦# 刘永峰 雷 强 蔚洪恩△
(山西医科大学,1 第五临床医学院神经内科,2 基础医学院,太原 030012)
孤独症谱系障碍(autism spectrum disorder,ASD)是一种神经发育障碍性疾病,患病率呈逐年上升趋势,其病因和发病机制尚未阐明。兴奋性突触的发育和功能是脑发育过程中的重要事件,研究表明突触功能障碍参与了ASD的发病机制[1]。微管作为细胞骨架中最大的一种,参与调节神经元和大脑发育的所有过程[2],微管的稳定性对神经元突触发育起着重要作用[3-4]。研究表明ASD的发病与微管的稳定性有着密切的联系[5]。微管稳定剂埃博霉素D(epothilone D,Epo D)具有促进微管蛋白聚合和微管装配的作用,可以减轻STOP基因敲除小鼠的行为缺陷和改善突触功能异常[6]。据此,本研究拟探讨微管稳定剂 Epo D对体外培养的ASD模型 BTBR小鼠皮质神经元兴奋性突触结构的影响及机制,以期为ASD的治疗提供新的理论基础和药物靶标。
1 材料和方法
1.1 实验动物和主要试剂
BTBR小鼠(购自南京大学模式动物研究所,饲养于山西省人民医院实验动物中心);埃博霉素D(MedChemExpress公司);DMSO(索莱宝公司);Neurobasal培养液、DMEM高糖培养基、神经生长因子B27、青霉素-链霉素、0.25%胰酶、胎牛血清及胎马血清(美国Gibco公司);多聚-D-赖氨酸氨溴酸盐(美国Sigma公司);SDS-PAGE凝胶制备试剂盒、BCA蛋白测定试剂盒(BOSTER公司);抗MAP2、STOP、α-tubulin、PSD95、GluN2B、mGluR5抗体(CST公司);抗acetyl-tubulin抗体(美国Sigma公司);抗VGLUT1抗体(Synaptic Systems公司);抗GADPH抗体(Bioworld公司);羊抗兔 IgG、羊抗鼠 IgG(EarthOx公司);FITC羊抗兔IgG(ABclonal公司)。
1.2 BTBR小鼠原代皮质神经元细胞的分离培养
取孕15~16 d孕鼠脱臼处死,无菌条件下快速取出胚胎置于解剖液中,在体视显微镜下解剖分离且剥除脑膜和血管,将大脑皮质组织置于培养皿中,胰酶消化,吸管反复轻柔吹打组织团块,用细胞筛分散成单细胞悬液,计数、铺板,调节细胞浓度,取适量细胞接种于经多聚赖氨酸包被的培养皿,放入37℃、5%CO2培养箱中培养,4 h后换液,培养液换成含B27、青霉素-链霉素和L-谷氨酰胺的无血清Neurobasal培养基,以后每3天半量换液,培养10~14 d。
1.3 BTBR小鼠皮质神经元免疫荧光染色及鉴定
观察神经元的生长状态,培养至7 d皮质神经元已成熟,胞体饱满,可用于鉴定。4%多聚甲醛固定30 min,0.2% Triton X-100 作用20 min,5%BSA封闭20 min,加入 抗MAP2抗体(1∶100)于4 ℃孵育过夜,次日加入FITC标记的荧光二抗(1∶100)于37 ℃避光孵育1 h,二抗孵育结束后,加入DAPI染液避光孵育15 min,抗荧光衰减剂封片,后共聚焦显微镜观察并拍照。
细胞纯度计数:高倍镜下每张爬片随机选取5个视野,进行免疫荧光阳性细胞计数。分别计数MAP2 阳性的神经元细胞数,以及经DAPI染核的细胞总数。每个视野下细胞的纯度=阳性细胞数/细胞总数×100 %。重复5次。
1.4 微管稳定剂Epo D药物干预
将培养至相对成熟(10 d)的皮质神经元随机分为实验组和溶剂对照组,实验组给予10 nmol/L Epo D DMSO溶解、溶剂对照组给予相同体积的0.1% DMSO溶剂,于培养箱培养24 h后移除含药物的条件培养基,用加热的无血清培养基清洗3次,后评估微管形态,检测微管稳定标志蛋白、微管相关蛋白、兴奋性突触结构相关蛋白及兴奋性谷氨酸受体蛋白的表达水平。
1.5 微管稳定性的形态学检测
对培养至10 d的小鼠皮质神经元随机分为实验组、对照组各2组,分别经10 nmol/L Epo D和相同体积的溶剂干预后,吸弃条件培养基,加热的无血清培养基清洗3次。一组继续保持于培养箱37℃,90 min,另一组给予 4℃冷处理90 min,后迅速细胞固定,进行兔抗α-tubulin抗体(1∶100)免疫荧光染色标记微管,倒置荧光显微镜下观察微管形态,考察神经元在冷处理干预下的稳定性,并比较微管稳定剂Epo D干预后微管稳定性的变化。
1.6 免疫印迹检测蛋白表达
实验组给予10 nmol/L Epo D、对照组给予相同体积溶剂干预24 h后,评估微管稳定标志蛋白、微管相关蛋白、兴奋性突触结构相关蛋白及兴奋性谷氨酸受体蛋白的表达水平。后裂解细胞提取总蛋白,采用BCA法检测蛋白浓度,每孔上样40 μg蛋白质行凝胶电泳,电泳完成后进行电转将蛋白转移至PVDF膜,5%奶粉封闭,然后用一抗acetyltubulin(1∶5 000)、α-tubulin(1∶1 000)、MAP2(1∶1 000)、STOP(1∶750)、PSD95(1∶1 000)、VGLUT1(1∶4 000)、GluN2B(1∶1 000)、mGluR5(1∶1 000)、GAPDH(1∶10 000)孵育过夜,洗膜4次后二抗(1∶20 000)孵育l h,PVDF膜置于凝胶成像分析系统中,均匀滴加显影剂,显影。
1.7 统计学处理
使用Image J软件、Graphpad Prism 8.0对免疫印迹图像进行分析,所有实验数据使用SPSS 22.0软件分析,所有计量资料结果均以±s表示。两组之间的差异性比较采用t检验,取a=0.05为检验水准,P<0.05为差异有统计学意义。
2 结果
2.1 胎鼠皮质神经元原代培养形态学观察
倒置相差显微镜下观察大脑皮质神经元生长形态变化(图1),接种培养2 d后大部分神经元伸出突起,胞体多呈锥形,细胞突起之间、突起与胞体之间开始形成少量连接(图1A);培养至4 d可见大脑皮质神经元细胞体积变大,突起生长增多,胞体饱满,细胞间形成疏散的神经网络结构(图1B);培养至5 d后,神经元胞体变大,突起连接形成的网状结构也更加明显(图1C);培养至7 d神经元突起分支明显延长,胞体更加饱满,形成紧密的神经网络(箭头所示),大脑皮质神经元成熟,可用于后续实验(图1D)。
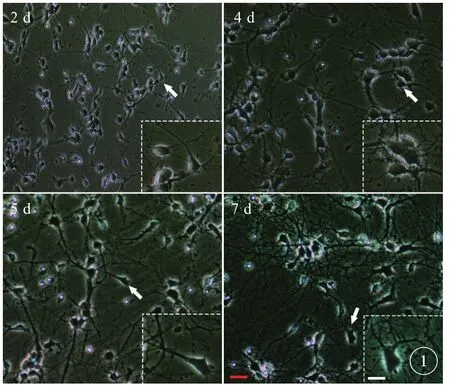
图1 倒置相差显微镜观察,原代培养的BTBR胎鼠大脑皮质神经元2~7 d的形态学变化。红色标尺=100 µm,白色标尺= 50 µm.
2.2 皮质神经元免疫荧光染色及鉴定
选取培养7 d的大脑皮质神经元进行免疫荧光染色鉴定(图2),通过对神经元特异性标志蛋白MAP2进行免疫荧光染色,共聚焦显微镜拍摄观察染色结果。观察可见,细胞经MAP2特异性染色和DAPI非特异性染色后,细胞在显微镜下细胞体和突起呈现绿色荧光、细胞核呈现蓝色荧光,蓝色荧光的细胞核大部分位于绿色荧光的细胞体中央。计数结果显示神经元纯度可达到70%以上,且生长状态良好,可用于后续实验。
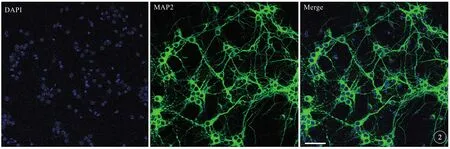
图2 免疫荧光鉴定原代培养胎鼠大脑皮质神经元纯度:MAP2(神经元特异性标志蛋白)、DAPI非特异性标记细胞核。图片中杂细胞细胞核较少,神经元纯度>70%。标尺=100 µm.
2.3 微管稳定性的形态学检测
结果显示(图3),在正常的皮质神经元细胞中,α-tubulin染色均匀地分布在神经元胞体、突起中,当经过低温刺激后,显示在Epo D组小鼠皮质神经元细胞中微管能抵抗低温刺激,α-tubulin染色未见明显变化。相反,在溶剂对照组小鼠皮质神经元细胞中,α-tubulin的均一性染色消失,神经元突起中的微管结构似乎断裂成许多颗粒状结构,出现广泛的微管解体。

图3 BTBR胎鼠皮质神经元微管的形态变化,一组保持在37 ℃,另一组暴露在低温(4 ℃,90 min)中。微管用α-tubulin(绿色)标记。标尺=50 µm.
2.4 免疫印迹检测相关蛋白表达
2.4.1 微管稳定的标志蛋白和微管相关蛋白的表达 结果显示(图4),与溶剂对照组相比,Epo D实验组acetyl-tubulin、α-tubulin和STOP蛋白表达水平显著升高,差异有统计学意义(P<0.05,P<0.01)。MAP2蛋白差异无统计学意义。

图4 免疫印迹检测Epo D干预后BTBR小鼠原代皮质神经元acetyl-tubulin、α-tubulin、STOP和MAP2蛋白的表达
2.4.2 兴奋性突触结构相关蛋白的表达 结果显示(图5),与溶剂对照组相比,Epo D实验组PSD95蛋白表达水平升高,差异有统计学意义(P<0.01);VGLUT1蛋白表达差异无统计学意义。2.4.3 兴奋性谷氨酸受体的表达 结果显示(图6),与溶剂对照组相比,Epo D实验组GluN2B蛋白和mGluR5蛋白表达水平均升高,差异有统计学意义(P<0.05)。

图5 免疫印迹检测Epo D干预后BTBR小鼠原代皮质神经元突触结构相关蛋白PSD95和VGLUT1蛋白的表达
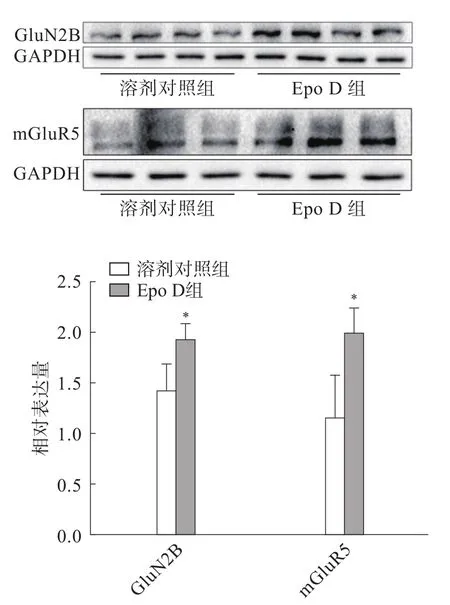
图6 免疫印迹检测Epo D干预后BTBR小鼠原代皮质神经元兴奋性谷氨酸受体GluN2B和mGluR5蛋白的表达
3 讨论
ASD是一种神经发育障碍性疾病,是自幼儿阶段即表现出的基于2大领域的损害:持续的社会交流和社会交往障碍;限制性的兴趣和重复行为,通常伴随着感觉异常和语言发展的延迟或缺失[7]。ASD患者社会适应差,生活不能自理,需要终身照顾,给社会和家庭带来巨大的经济和精神负担。虽然遗传和环境因素及其相互作用被普遍认为与ASD的发病有关,但其确切的病因和发病机制仍不清楚,仍缺乏有效的治疗方法和预防措施[8]。目前对ASD的研究大多基于整体动物模型。本研究以体外培养的ASD模型BTBR小鼠皮质神经元为研究对象,通过给予微管稳定剂Epo D对ASD可能的发病机制进行了初步探索。研究结果表明Epo D可增加BTBR小鼠皮质神经元微管的冷稳定性及微管稳定的标志蛋白、微管相关蛋白的表达;可以增加BTBR小鼠皮质神经元兴奋性突触结构、兴奋性谷氨酸受体相关蛋白的表达(图7)。本研究结果进一步验证了微管稳定性在ASD发病机制中的重要作用,为ASD的治疗提供了新的可能。

图7 微管稳定剂Epothilone D对孤独症谱系障碍BTBR小鼠皮质神经元兴奋性突触结构的影响及机制
稳定的微管可以抵抗解聚条件,如寒冷刺激和一些解聚药物[9]。微管功能障碍是神经精神疾病的共同特征,这可能导致了神经精神疾病的发生[10]。靶向微管药物的研究正在成为治疗各种神经精神疾病(如帕金森氏病、阿尔茨海默病和精神分裂症)的一种策略[11-14]。研究表明,细胞骨架和微管稳定性在ASD的发病机制中起着重要作用[5]。微管相关蛋白(MAPs)是一类结合和稳定微管的蛋白质,MAPs可以稳定微管,这被认为是神经元回路的发育、维持和功能所必需的[4]。其中MAP6(也称为STOP蛋白)是一种钙调节蛋白,负责神经元微管的高度稳定以及神经元结构和突触可塑性的建立,被认为与神经元微管对寒冷刺激和药物的稳定性相关[15]。研究表明与对照组相比,ASD患者血浆和BTBR小鼠大脑皮质中的STOP显著减少[1,15]。这些结果提示STOP基因与ASD发病有关。
Epo D是一种天然存在于纤维素黏杆菌中的化合物,可以促进微管形成和稳定,抑制微管解聚,并且很容易透过血脑屏障,这使其广泛应用于神经精神疾病的治疗[10]。Epo D具有广泛的效果,这取决于其所针对的疾病、涉及的细胞类型以及药物在实验中所采用的剂量和作用时间[16]。高浓度时,微管稳定剂高度稳定微管并干扰其正常破坏,是靶向和治疗各种类型恶性肿瘤的手段之一。然而,在低浓度时这些药物可以稳定足够的微管,以防止它们去极化和溶解,甚至促进它们的极化,这对于脑损伤的治疗非常重要[17]。10 d的原代皮质神经元被认为是相对成熟的,突触蛋白、谷氨酸受体、轴突/树突连接的增加和电生理特性的改变在这一时间段发生[16]。因此,本研究选择10 d的BTBR小鼠原代皮质神经元作为研究对象。Acetyl-tubulin是一种广泛应用的稳定聚合微管的标记物,在稳定的微管中,α-tubulin在赖氨酸-40位点发生乙酰化,反之,α-tubulin在非聚合微管中迅速去乙酰化[17]。本研究结果表明,Epo D可提高BTBR小鼠大脑皮质神经元微管的冷稳定性,可增加微管稳定的标志蛋白和微管相关蛋白的表达。
兴奋性突触的发育和功能在ASD的发病机制中起着重要作用[1]。VGLUT1作为兴奋性突触前膜标志物,对于兴奋性神经递质传递和正常突触功能必不可少[18-19]。PSD-95是兴奋性神经元中突触后致密物中重要的支架蛋白,调节谷氨酸的运输和定位,参与突触的发育和可塑性[20]。谷氨酸是最重要的兴奋性神经递质之一,通过与谷氨酸受体结合而引起兴奋性突触传递[21]。研究表明,兴奋性和抑制性突触之间的失衡导致大脑功能障碍,并参与ASD的病理过程[21-22]。BTBR小鼠大脑皮质的谷氨酸释放水平低于B6小鼠,而STOP基因敲除小鼠的突触囊泡密度较低,释放到突触间隙中的谷氨酸也较少[21,23]。本研究结果表明,10 nmol/L Epo D可使BTBR小鼠皮质神经元中兴奋性突触结构相关蛋白、谷氨酸受体蛋白的表达水平增加。
综上所述,微管稳定剂Epo D能改善体外培养的ASD模型BTBR小鼠皮质神经元的兴奋性突触结构,其机制可能与增加微管的稳定性有关,有望成为治疗ASD的有效药物。