脯氨酸羟化酶抑制剂FG-4592抑制脂多糖诱导的星形胶质细胞炎症反应
2022-09-07阮倩倩耿亚楠史子毕朱玲玲侯筱宇
阮倩倩,赵 名,耿亚楠,胡 月,史子毕,朱玲玲,侯筱宇
(1.徐州医科大学生物化学与分子生物学研究中心,江苏 徐州 221004;2.军事科学院军事医学研究院军事认知与脑科学研究所,北京 100850;3.中国药科大学天然药物活性组分与药效国家重点实验室,江苏 南京 211198)
神经炎症是指以中枢神经系统为主的炎症反应,参与多种神经系统疾病的发生发展,如缺血性卒中、细菌感染、创伤性脑损伤和神经退行性疾病等[1-2]。星形胶质细胞是中枢神经系统中数量最多的一类细胞。生理状态下,星形胶质细胞与神经元之间密切联系,在调节神经系统发育、突触传递、信息处理与信号传递及神经和突触的可塑性等方面发挥重要作用;病理状态下,星形胶质细胞转变为反应性星形胶质细胞,不但丧失对神经元的保护功能,而且会加剧损伤[3-5]。因此,抑制星形胶质细胞介导的神经炎症的发生和发展对治疗相关疾病具有重要意义。
低氧诱导因子1(hypoxia-inducible factor-1,HIF-1)是细胞感知低氧信号的关键蛋白,其表达水平受脯氨酸羟化酶(proline hydroxylase,PHD)调控,小分子PHD抑制剂可通过PHD/HIF-1通路参与血管发生、能量代谢和细胞存活等,如促进红细胞和血管的发生及抗低氧性组织损伤等。FG-4592属于喹啉及其衍生物类PHD抑制剂,目前已被珐博进/安斯泰来/阿斯利康(FibroGen/Astellas/AstraZeneca)3家公司联合开发成口服药物罗沙司他(roxadustat),用于治疗慢性肾病引起的贫血[6]。本研究利用脂多糖(lipopolysaccharides,LPS)诱导的星形胶质细胞系C8-D1A细胞和小鼠原代星形胶质细胞建立炎症模型,评价FG-4592对神经炎症的影响,并对其分子机制进行初步探讨。
1 材料与方法
1.1 药物、试剂和主要仪器
FG-4592,纯度为99.95%,美国MedChemEx⁃press公司,以DMSO配制成浓度20 mmol·L-1的母液备用。CCK-8试剂盒,日本同仁化学研究所;Trizol,美国Thermo-Fisher公司;实时定量多聚酶链反应(quantitative real-time polymerase chain reaction,RT-qPCR)反应预混液ChamQ TM SYBR qPCR Master Mix和逆转录试剂盒HiScriptⅢRT SuperMix for qPCR,南京诺唯赞生物科技股份有限公司;Laemmli样品缓冲液,美国Bio-Rad公司;BCA蛋白定量试剂盒,北京普利莱基因技术有限公司;Hank′s液、DMEM和LPS,美国Sigma-Adrich公司;胎牛血清,中国ExCell Bio公司;兔抗小鼠磷酸化NF-κB抑制因子α(phosphorylated inhibitor of NF-κB α,p-IκBα)单克隆抗体(2859S)、兔抗小鼠p-P65单克隆抗体(3033S)、辣根过氧化酶标记的山羊抗小鼠IgG抗体(7076S)和山羊抗兔IgG抗体(7074S),美国Cell Signaling Technology公司。
细胞培养箱和酶标仪(MULTISKAN GO),美国Thermo Fisher Scientific公司;超净工作台,北京亚太科隆仪器技术有限公司;倒置荧光显微镜(IX70),日本Olympus公司;电泳仪(Mini-protean)、电转仪(Mini-protean)和荧光qPCR仪(CFX96),美国Bio-Rad公司;化学成像发光仪(Tanon4600),上海天能科技有限公司;超微量分光光度计(UV5),美国METTLER TOLEDO公司。
1.2 原代小鼠星形胶质细胞的分离和处理
新生1 d的C57BL/6小鼠,购自维通利华公司,动物许可证号:SCXK(京)2016-0006,经75%乙醇消毒后移至超净台内,眼科剪剪开头皮和头骨,小心取出全脑,解剖镜下去除脑膜,剥离出双侧大脑皮质放置于预冷的Hank′s液中,用眼科剪剪成小块,加0.25%胰蛋白酶置于37℃孵箱消化15 min,而后加入完全培养液(95%DMEM+10%胎牛血清)终止消化,1379×g离心5 min,弃上清,用完全培养液重悬,静置3 min,吸去上层已经离散的细胞悬液,用300目筛网过筛。下层尚未离散的组织团块再次加入完全培养液吹打重悬和过筛,如此重复3~4次后将细胞悬液移入培养瓶,置37℃,5%CO2饱和湿度培养箱中常规培养。24 h后换全液,而后根据细胞生长状态和培养液颜色变化程度,每2~3 d半量换液1次。待星形胶质细胞铺满培养瓶底部,置37℃摇床振摇30 min,弃上层培养液(内含小胶质细胞),以此获得星形胶质细胞。
将原代小鼠星形胶质细胞分为细胞对照组、FG-4592组、LPS模型组和LPS+FG-4592组。LPS+FG-4592 组 先加入 FG-4592 40 μmol·L-1处理 1 h,再加入 LPS 100 μg·L-1共同处理 6 h;FG-4592组加入FG-4592 40 μmol·L-1处理7 h;LPS模型组加入LPS 100 μg·L-1处理6 h。
1.3 C8-D1A细胞培养
C8-D1A细胞为来源于小鼠脑组织、高度纯化的具有星形胶质细胞特性的克隆细胞系,购自武汉大学中国典型培养物保藏中心。细胞培养于含10%胎牛血清的DMEM完全培养液中,在37℃,5%CO2培养箱中饱和湿度条件下常规培养,每2~3 d传代或换液1次。
1.4 CCK-8法检测C8-D1A细胞存活率
将生长良好的C8-D1A细胞用胰酶消化、计数,以每孔5000个细胞接种于96孔板,置37℃,5%CO2培养箱培养24 h后,将细胞分为细胞对照组和FG-4592组,每组设3复孔,分别加入FG-4592 0(细胞对照组),10,20和40 μmol·L-1处理细胞6 h。另设空白对照组,只加细胞培养基和CCK-8试剂,不接种细胞。根据CCK-8试剂盒说明书,每孔加入10 μL CCK-8试剂,置细胞培养箱内继续孵育1 h后,用酶标仪测450 nm吸光度(A450nm)值,计算各组细胞存活率。细胞存活率(%)=(实验组A450nm-空白组A450nm)/(细胞对照组A450nm-空白组A450nm)×100%。实验重复3次。
1.5 RT-qPCR检测C8-D1A细胞HIF-1 α蛋白靶基因和炎症因子相关基因mRNA表达水平
C8-D1A细胞按1.4分组处理,检测细胞HIF-1α蛋白靶基因葡萄糖转运蛋白1(glucose transporter type 1,Glut 1)、血管内皮生长因子(vascular endo⁃thelial growth factor,VEGF)和促红细胞生成素(erythropoietin,EPO)mRNA表达水平;C8-D1A细胞除LPS+FG-4592组FG-4592剂量为10,20和 40 μmol·L-1外,其他组药物处理同 1.2,检测C8-D1A细胞炎症因子白细胞介素6(interleukin-6,IL-6),IL-1β和肿瘤坏死因子 α(tumor necrosis factor-α,TNF-α)mRNA表达水平;原代小鼠星形胶质细胞按1.2分组处理,检测细胞HIF-1α,IL-1β,IL-6和TNF-αmRNA表达水平。
Trizol法提取细胞总RNA,采用紫外可见分光光度计进行定量。取1 μg总RNA,采用逆转录试剂盒HiScriptⅢRT SuperMix for qPCR进行cDNA合成反应,然后在荧光qPCR仪上采用ChamQ TM SYBR qPCR Master Mix反应体系进行qPCR反应。目的基因引物序列如表1所示。PCR程序参照试剂盒提供的两步法进行:95℃30 s,95℃5 s,60℃30 s共40个循环。各组实验重复3次。以β肌动蛋白作为内参基因,采用2-ΔΔCt法计算目的基因的相对表达水平。
1.6 Western印迹法检测C8-D1A细胞HIF-1 α,TLR4,p--I κB α和p--P65蛋白表达水平
C8-D1A细胞分组和药物处理同1.4,原代小鼠星形胶质细胞分组和药物处理同1.2,检测HIF-1α蛋白表达水平;C8-D1A细胞分组和药物处理同1.2,检测 Toll样受体 4(Toll like receptor 4,TLR4)、p-IκBα和p-P65蛋白表达水平。收取各组C8-D1A细胞,用Laemmli样品缓冲液充分裂解后煮沸变性10 min;然后16 543×g、4℃离心10 min,取上清,即为全细胞裂解液。BCA法进行蛋白定量。取20 μg蛋白进行SDS-PAGE电泳。PVDF膜湿转印后,5%脱脂奶粉室温封闭1 h。TBST洗涤3次,每次10 min。分别加入抗HIF-1α,TLR4,p-IκBα,p-P65和β肌动蛋白抗体(一抗)(均1∶1000稀释)4℃孵育过夜。TBST洗涤3次后加入相应二抗(1∶2000)室温孵育1 h,TBST再次洗涤3次后进行ECL显影。用Image J软件分析蛋白条带的积分吸光度,以目标蛋白与内参蛋白积分吸光度值的比值反映目标蛋白相对表达水平。
1.7 统计学分析
用GraphPad Prism 8.0软件进行统计分析,结果数据均用±s表示,组间差异使用单因素方差分析及Dunnettt检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 FG-4592对C8-D1A细胞存活率的影响
CCK-8检测结果(图1)显示,与细胞对照组比较,FG-4592 10,20和40 μmol·L-1组C8-D1A细胞存活率均无统计学差异,提示FG-4592 10,20和40 μmol·L-1不影响C8-D1A细胞存活。
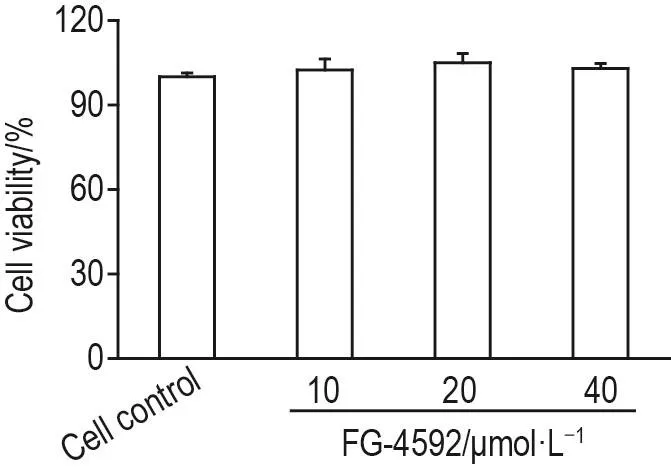
Fig.1 Effect of FG-4592 on C8-D1A cell viability by CCK-8 assay.C8-D1A cells were treated with FG-4592 for 6 h.±s,n=3.
2.2 FG-4592对C8-D1A细胞HIF-1 α蛋白表达水平的影响
Western印迹结果(图2)显示,与细胞对照组比较,FG-4592 10,20 和 40 μmol·L-1组 C8-D1A细胞HIF-1α蛋白水平均显著上升(P<0.01)。
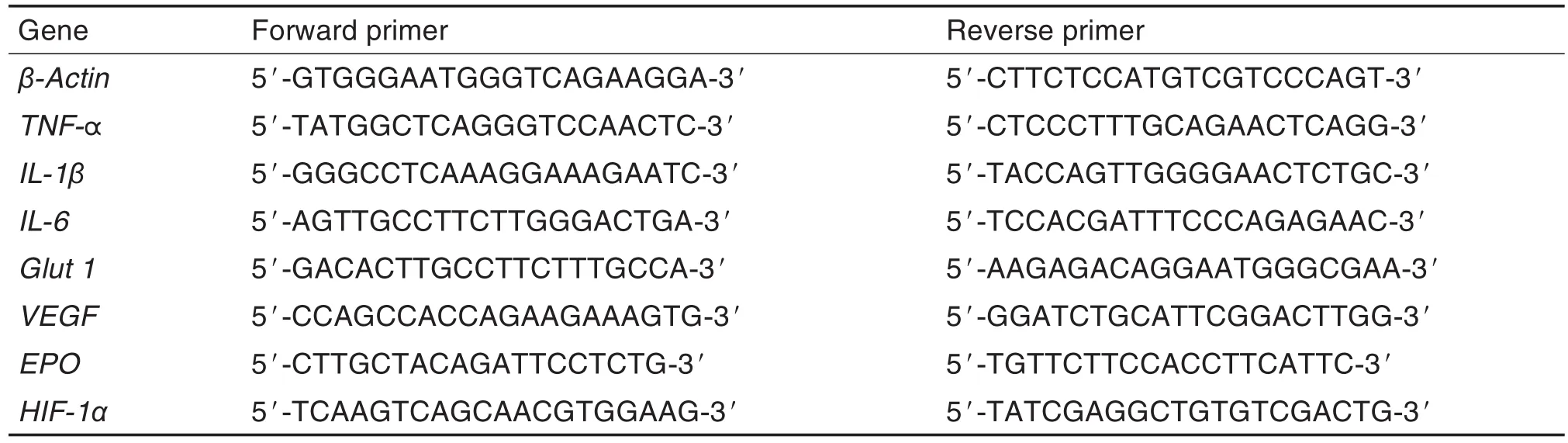
Tab.1 Sequences of primers for qPCR
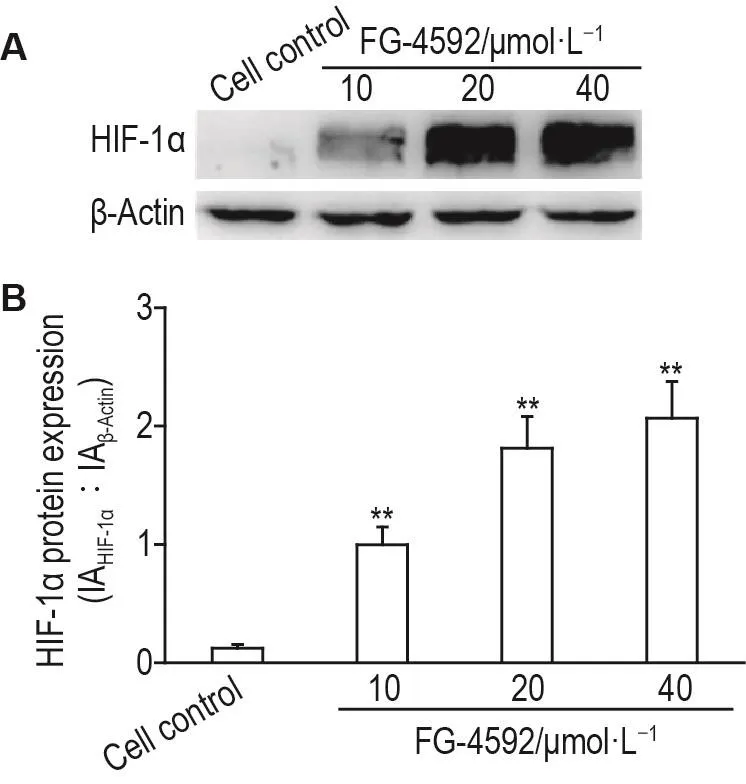
Fig.2 Effect of FG-4592 on expression of HIF-1 α protein in C8-D1A cells by Western blotting.See Fig.1 for the cell treatment.B was the quantitative result of A.IA:integrated absorbance.±s,n=3. **P<0.01,compared with cell control group.
2.3 FG-4592对C8-D1A细胞HIF-1 α蛋白靶基因Glut1,VEGF和EPO mRNA表达水平的影响
RT-qPCR结果(图3)显示,与细胞对照组相比 ,除 FG-4592 10 μmol·L-1组 C8-D1A 细 胞 中EPO mRNA表达水平无显著变化外,FG-4592 10,20和40 μmol·L-1组C8-D1A细胞中Glut1,VEGF和EPO mRNA表达水平均显著升高(P<0.01),表明FG-4592能激活HIF-1α蛋白靶基因的表达。
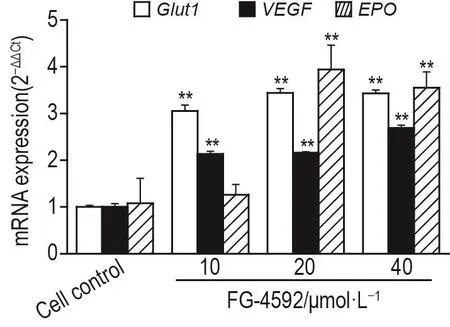
Fig.3Effect of FG-4592 on mRNA levels of Glut1,VEGF and EPO in C8-D1A cells by RT-qPCR.See Fig.1 for the cell treatment.±s,n=3.**P<0.01,compared with cell con⁃trol group.
2.4 FG-4592对LPS诱导C8-D1A细胞炎症因子IL-6,IL-1 β和TNF- α mRNA表达水平的影响
如图4显示,与细胞对照组比较,LPS 100 μg·L-1组C8-D1A细胞炎症因子IL-6,IL-1β和TNF-α mRNA表达水平显著上升(P<0.01)。与LPS模型组相比,LPS+FG-4592 10,20和40 μmol·L-1组的IL-6和IL-1β mRNA表达水平显著下降(P<0.01),10和40 μmol·L-1组TNF-α mRNA表达水平显著下降(P<0.05,P<0.01)。提示FG-4592对LPS诱导的C8-D1A细胞炎症具有抑制作用。

Fig.4 Effect of FG-4592 on mRNA levels of IL-6,IL-1 β and TNF- α in C8-D1A cells induced by lipopolysac⁃charides(LPS)by RT-qPCR.C8-D1A cells in FG-4592 group were treated with FG-4592 40 μmol·L-1for 7 h;C8-D1A cells in LPS model group were treated with LPS 100 μg·L-1for 6 h;C8-D1A cells in LPS+FG-4592 group were treated with FG-4592 10,20 and 40 μmol·L-1for 1 h,before co-incubation with LPS 100 μg·L-1 for 6 h.x ± s,n=3. **P<0.01,compared with cell control group;#P<0.05,##P<0.01,compared with LPS group.
2.5 FG-4592对LPS诱导的原代小鼠星形胶质细胞HIF-1 α蛋白和mRNA水平及炎症因子IL-6,IL-1 β和TNF- α mRNA水平的影响
与细胞对照组相比,FG-4592组原代小鼠星形胶质细胞HIF-1α蛋白水平显著上升(P<0.01,图5A),而mRNA水平变化无显著变化(图5B),提示FG-4592主要在蛋白水平上激活HIF-1信号通路。
与细胞对照组相比,LPS模型组原代小鼠星形胶质细胞炎症细胞因子IL-6,IL-1β和TNF-α mRNA表达水平显著上升(P<0.01,图5C-E)。与LPS模型组相比,LPS+FG-4592组的IL-6,IL-1β和TNF-α mRNA表达水平显著下降(P<0.01,图5C-E)。提示FG-4592对LPS诱导的原代小鼠星形胶质细胞炎症反应具有抑制作用。
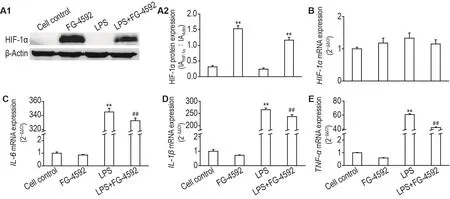
Fig.5 Effect of FG-4592 on expression of HIF-1 α protein(A)and mRNA levels of HIF-1 α(B),IL-6(C),IL-1 β(D)and TNF- α(E)in primary astrocytes induced by LPS.See Fig.4 for the cell treatment,except that the concentration of FG-4592 was 40 μmol·L-1.A was detected by Western blotting.A2 was the quantitative result of A1.B-E were detected by RT-qPCR.±s,n=3.**P<0.01,compared with cell control group;##P<0.01,compared with LPS group.
2.6 FG-4592对LPS诱导的C8-D1A细胞中TLR4,p-I κB α和p-P65蛋白表达水平的影响
Western印迹结果(图6)显示,与细胞对照组相比,LPS模型组C8-D1A细胞TLR4,p-IκBα和p-P65蛋白表达水平显著上升(P<0.05,P<0.01)。相对于LPS模型组,LPS+FG-4592组C8-D1A细胞TLR4,p-IκBα和p-P65蛋白表达水平显著下降(P<0.05,P<0.01)。
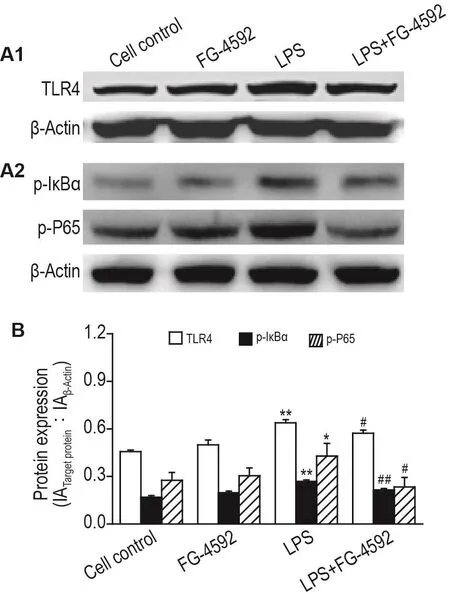
Fig.6Effect of FG-4592 on protein expressions of TLR4,phosphorylated inhibitor of NF- κB α(p-I κB α)and p-P65 in C8-D1A cells induced by LPS by Western blotting.See Fig.5 for the cell treatment.B was the quantita⁃tive result of A1 and A2.±s,n=3.*P<0.05,**P<0.01,compared with cell control group;#P<0.05,##P<0.01,compared with LPS group.
3 讨论
星形胶质细胞是中枢神经系统中功能最多样化的胶质细胞,其在神经系统中的作用受到越来越多的关注。其中,作为大脑中的免疫细胞,星形胶质细胞在调节免疫反应方面发挥着重要作用[7]。例如,星形胶质细胞可通过多巴胺D2受体调控神经炎症,进而调控帕金森病进展[8]。在缺血性卒中疾病模型中,星形胶质细胞释放多种促炎因子(如TNF-α和IL-1β),参与脑缺血-再灌注损伤;而白藜芦醇(pterostilbene)可通过抑制星形胶质细胞介导的神经炎症改善缺血性脑损伤[9]。赵晶晶等[10]研究发现,白藜芦醇可通过下调星形胶质细胞炎症因子TNF-α和IL-6的水平,对小鼠脑缺血损伤产生神经保护作用。星形胶质细胞介导的神经炎症也与抑郁症的发生发展密切相关,IL-1β受体拮抗剂可显著改善小鼠的抑郁样行为[11]。因此,抑制星形胶质细胞介导的炎症反应对多种神经系统疾病的防治具有重要意义。
在临床上,FG-4592已用于治疗慢性肾病性贫血,其分子机制是通过抑制PHD活性激活HIF-1通路,促进EPO生成,增加血红蛋白含量,从而发挥抗贫血作用[12]。此外,FG-4592在其他方面的作用也受到了广泛关注。研究发现,在顺铂诱导的小鼠急性肾损伤模型中,提前48 h每天ip给予FG-4592 10 mg·kg-1可缓解模型小鼠肾组织 IL-6、IL-1β、TNF-α、单核细胞趋化蛋白1和环氧合酶2等炎症因子水平的升高,抑制炎症反应,从而改善急性肾损伤[13]。在LPS诱导的MH-S细胞和MLE-12细胞炎症模型中,采用 FG-4592 25 μmol·L-1处理细胞可显著降低LPS诱导的促炎细胞因子IL-6,IL-1β和TNF-α的升高,从而减轻细胞损伤[14]。此外,FG-4592可通过抑制炎症预防缺血/再灌注引起的肾损伤[15]。已有研究表明,LPS可诱导星形胶质细胞炎症反应[16-17]。本研究结果显示,FG-4592对LPS诱导的星形胶质细胞炎症反应具有明显的抑制作用,提示FG-4592在抑制炎症方面也具有潜在的应用价值。
Glut1,VEGF和EPO是HIF-1信号通路经典的下游靶基因[18],HIF-1信号通路激活时可诱导这些基因的转录表达,因此其mRNA可作为HIF-1信号通路激活的标志物。本研究结果表明,FG-4592处理后,C8-D1A细胞HIF-1α蛋白水平以及Glut1,VEGF和EPO mRNA水平均显著升高,提示FG-4592可抑制C8-D1A细胞内PHD活性,并激活HIF-1信号通路。LPS是常用的体内外炎症反应激活剂,其与细胞膜上的TLR4结合后激活胞浆中的IκB 激酶(IκB kinase,IKK)复合体[19-20]。IKK 复合体分别磷酸化激活下游IκBα和P65/P50蛋白,p-IκBα经蛋白酶体通路降解,且p-IκBα对P65/P50蛋白复合体的抑制效应被阻断[21-23]。p-P65/P50蛋白复合体随后转移入核,与靶基因(如TNF-α,IL-6和IL-1β)相应的启动子结合,促进其转录表达[24]。因此,本研究对LPS诱导星形胶质细胞炎症反应后的TLR4蛋白水平及FG-4592预处理后TNF-α,IL-6和IL-1β mRNA水平进行检测。实验结果显示,LPS可诱导C8-D1A细胞TLR4蛋白水平上升;且在C8-D1A细胞和原代小鼠星形胶质细胞内,FG-4592预处理均能抑制LPS诱导的细胞炎症反应,表现为逆转LPS诱导的炎症因子IL-6,IL-1β和TNF-α mRNA水平及p-IκBα和p-P65蛋白表达水平的升高,表明FG-4592能通过激活HIF-1通路抑制星形胶质细胞炎症反应。
