稻瘟病菌假定核糖体生成因子MoRei1功能研究
2022-09-07汤帅徐喆吕务云童琪肖宇王政逸
汤帅,徐喆,吕务云,童琪,肖宇,王政逸
(浙江大学生物技术研究所,水稻生物学国家重点实验室,杭州 310058)
真核生物的蛋白质合成过程发生在80S核糖体上,而80S核糖体由60S核糖体大亚基和40S核糖体小亚基构成[1]。其中在60S 核糖体大亚基合成过程中,细胞核内完成组装修饰的Pre-60S 核糖体需在核输出因子与核孔复合体的作用下实现由细胞核到细胞质的转运,并在细胞质中进一步成熟[2-3];而结合在Pre-60S亚基表面的核输出因子在完成核输出后,则需在核糖体生成因子的作用下及时从核糖体亚基表面解离下来,重复利用。目前在酿酒酵母(Saccharomyces cerevisiae)中 已 鉴 定 出Nmd3[4]、Arx1[5]、Alb1[6]、Mex67[7]、Bud20[8]等 多 种 辅 助Pre-60S核糖体亚基跨膜运输的核输出因子,以及Rei1、Jjj1[9]、Yvh1[10]等核糖体生成因子。
稻瘟病(rice blast)由真菌界子囊菌门的稻瘟病菌(Magnaporthe oryzae)侵染所致,每年因稻瘟病导致的水稻产量损失达到水稻总产量的10%~30%[11]。由于防治稻瘟病对社会、经济的重要性以及稻瘟病菌在分子遗传上的可操作性,稻瘟病菌已成为研究植物病原真菌致病机制的模式真菌[12]。近年来研究发现,稻瘟病菌核糖体生成因子MoYvh1可通过影响活性氧(reactive oxygen species,ROS)清除的胞外蛋白合成与分泌,从而影响稻瘟病菌的致病性[13]。CAO等通过对稻瘟病菌C2H2锌指结构蛋白基因成员进行基因敲除发现,稻瘟病菌MoREI1基因缺失可影响稻瘟病菌的营养生长、无性孢子产生和致病性[14]。然而,MoRei1在病菌形态分化和致病过程中的其他生物学功能尚不明确。本研究通过MoREI1基因敲除、ΔMorei1突变体表型分析、基因互补及MoRei1 互作蛋白鉴定,进一步明确稻瘟病菌假定核糖体生成因子MoRei1 的生物学功能,为解析稻瘟病菌致病分子机制和研发新型杀菌剂提供一些基础数据。
1 材料与方法
1.1 供试菌株和寄主植物
稻瘟病菌(M. oryzae)野生型菌株Guy11 及有性生殖测试菌株TH3 由英国剑桥大学Talbot 教授实验室惠赠。稻瘟病菌MoREI1基因缺失突变体(ΔMorei1-22、ΔMorei1-23)及回补菌株(ΔMorei1-C)由本实验室获得。用于细菌转化的大肠埃希菌(Escherichia coli)菌株(Trans T1)购于杭州创试生物科技有限公司。酿酒酵母野生型菌株BY4741由浙江大学马忠华教授惠赠,酵母突变体菌株Δrei1由浙江大学陈云教授惠赠。酵母双杂交实验中的酵母菌株AH109购买于美国Clontech公司。
感病水稻品种为CO-39,感病大麦品种为黄金大麦(Golden Promise)。
1.2 供试质粒与培养基
用于基因敲除的pKOV21质粒由中国农业大学彭友良教授实验室惠赠,用于基因回补的pCB1532质粒由英国剑桥大学Talbot 教授实验室惠赠,用于酵母异源互补的pYES2载体由本实验室保存。
溶菌肉汤(lysogeny broth,LB)培养基包括5 g/L NaCl、5 g/L 酵母提取物、10 g/L 胰蛋白胨、15 g/L 琼脂粉,用10 mol/L NaOH 调节培养基pH 至7.0[15];完全培养基(complete medium,CM)配制、稻瘟病菌原生质体转化和突变体筛选均参照先前报道的方法[16-17];PTC 缓冲液包括60% PEG 4000、10 mmol/L Tris-HCl(pH 7.5)、10 mmol/L CaCl2;酵母菌尿嘧啶合成缺陷培养基(synthetic dropout medium-uracil,SD-URA)包括8 g/L URA、20 g/L 葡萄糖、15 g/L 琼脂粉,用10 mol/L NaOH 调节培养基pH 至5.8[15];燕麦培养基(oatmeal agar, OMA)为将50 g 燕麦片煮沸15 min,过滤得到的滤液定容至1 000 mL,然后添加15 g琼脂粉。
1.3 突变体表型测定与分析
有性生殖参数测定:将稻瘟病菌的野生型菌株Guy11 及突变体菌株ΔMorei1-22分别与对应交配型的测试菌株TH3 接种于燕麦培养基(OMA)上进行对峙培养,于25 ℃条件下光照14 h/黑暗10 h 培养至菌丝相互接触时,转移至19 ℃条件下持续光照培养30 d,检测菌落交界处的子囊壳形成情况。
大麦表皮穿透实验:收集生长10 d的各待测菌株的分生孢子,制备浓度为5×104个/mL的孢子悬浮液,吸取15 μL孢子悬浮液滴加于生长7 d的大麦叶片背面,于28 ℃、黑暗条件下保湿培养48 h后,撕取大麦表皮置于显微镜下观察并统计穿透与侵染菌丝扩展情况。
附着胞形成率统计:待统计的分生孢子悬浮液浓度同上,每次吸取15 μL 悬浮液滴加于疏水玻片表面,于25 ℃、黑暗条件下保湿培养24 h,随后置于显微镜下观察并统计附着胞形成情况。
致病性测定:待测定的分生孢子悬浮液浓度同上,将孢子悬浮液均匀喷雾于生长2 周的感病水稻品种CO-39 叶片表面,于25 ℃条件下光照14 h/黑暗10 h 交替培养5 d 后,观察水稻叶片表面的发病情况。上述每组实验独立重复3次,每处理设置3个生物学重复。
1.4 细胞壁完整性胁迫及氧化胁迫实验
在CM 中分别添加质量浓度为200、400 μg/mL刚果红(congo red,CR)或5、10 mmol/L H2O2。将各测试菌株接种于胁迫培养基表面,于25 ℃条件下光照14 h/黑暗10 h交替培养10 d后,测量菌株菌落直径并统计生长抑制率。每组实验独立重复3 次,每处理设置3个生物学重复。
1.5 糖原染色实验
收集生长10 d的各待测菌株的分生孢子,并将分生孢子悬浮液浓度调节为5×104个/mL,吸取15 μL孢子悬浮液滴加于疏水玻片表面,分别于黑暗条件下保湿培养0、2、4、8、12、24、48 h 后用KI/I2(60 mg/mL KI 和10 mg/mL I2)溶液染色,在显微镜下观察糖原分布情况并拍照。
1.6 异源基因互补与酵母双杂交实验
异源基因互补实验:以稻瘟病菌Guy11 菌株cDNA为模板,利用特异性引物扩增获得MoREI1基因的完整开放阅读框(open reading frame, ORF)。所用引物MoREI-F1 和MoREI-R1 信息见表1。通过聚合酶链反应(polymerase chain reaction,PCR)扩增片段并与酵母pYES2载体相连,在PTC介导下将构建好的回补载体导入酿酒酵母Δrei1突变体菌株,涂板于SD-URA上进行筛选。
酵母双杂交实验:同样以稻瘟病菌Guy11 菌株cDNA 为模板,利用特异性引物对MoREI1-F2/MoREI1-R2 和MoALB1-F1/MoALB1-R1(表1)分别扩增获得MoREI1和MoALB1基因完整开放阅读框序列。PCR 扩增片段分别与pGBKT7 和pGADT7 载体相连,再将对应质粒分别共转化至酵母AH109 菌株中,挑选在酵母菌亮氨酸-色氨酸合成缺陷培养基(synthetic dropout medium-leucinetryptophan,SD-Leu-Trp)(二缺培养基)上生长的转化子于酵母菌亮氨酸-色氨酸-腺嘌呤-组氨酸合成缺陷培养基(synthetic dropout medium-leucinetryptophan-adenine-histidine, SD-Leu-Trp-Ade-His)(四缺培养基)上再生长2~3 d,观察酵母菌落生长情况。

表1 本研究所用引物Table 1 Primers used in this study
1.7 MoAlb1亚细胞定位
将构建的C 端带有绿色荧光蛋白(green fluorescent protein,GFP)的MoALB1-GFP融合载体分别导入野生型Guyl1和ΔMorei1突变体菌株,获得转化子。待转化子在CM上生长10 d后分别收集分生孢子,并在孢子悬浮液中添加质量浓度为10 μg/mL 4',6-二 脒 基-2-苯 基 吲 哚(4', 6-diamidino-2-phenylindole, DAPI)染料,同时添加等体积的1%Triton。避光染色30 min 后在激光共聚焦显微镜(Zeiss Lsm 780)下观察细胞内荧光分布情况并拍照。
2 结果与分析
2.1 稻瘟病菌MoREI1基因的生物信息学分析结果
生物信息学分析结果显示,稻瘟病菌MoREI1基因(MGG_02505)序列全长为2 251 bp,包含2 个内含子,外显子序列长度为1 722 bp,编码包含573个氨基酸的蛋白质,其中分别在30~54、95~119、235~258、286~310氨基酸位点上含有一个C2H2锌指结构域。氨基酸多序列比对分析结果表明,稻瘟病菌MoRei1 蛋白与酿酒酵母(S. cerevisiae)Rei1 蛋白质序列一致性为24.53%,与禾谷镰刀菌(Fusarium graminearum)、粗糙脉孢菌(Neurospora crassa)、构巢曲霉(Aspergillus nidulans)这类丝状真菌的同源蛋白质氨基酸序列一致性分别为55.71%、43.73%、38.39%。同时,系统进化分析结果显示,稻瘟病菌的MoRei1 蛋白质与禾谷镰刀菌、粗糙脉孢菌等同源蛋白质的遗传关系较近(图1)。

图1 不同真菌Rei1同源蛋白质的系统进化分析Fig.1 Phylogenetic analysis of Rei1 homologs from different fungal species
2.2 稻瘟病菌MoREI1 基因对酵母Δrei1 突变体部分表型的恢复
为探究稻瘟病菌的MoREI1基因与酿酒酵母(S.cerevisiae)REI1基因(YBR267W)是否在功能上具有同源性,本研究将稻瘟病菌MoREI1基因导入酿酒酵母REI1基因缺失突变体Δrei1。有研究表明,酿酒酵母Δrei1突变体对低温环境敏感,在低温环境下不能正常生长[18],因此,可通过比较各测试菌株在低温环境下的生长来判断稻瘟病菌MoREI1基因是否可恢复酵母Δrei1突变体的表型。通过观测各参试菌株在酵母正常生长温度(37 ℃)及低温环境(21 ℃)中的生长情况发现,导入稻瘟病菌MoREI1基因的酵母REI1基因缺失突变体Δrei1在低温环境下恢复了部分生长缺陷表型(图2),说明稻瘟病菌MoRei1 与酵母Rei1 在功能上具有同源性,并可能具有与Rei1类似的核糖体生成因子功能。

图2 酵母野生型BY4741、突变体Δrei1及回补菌株Δreil/MoREI1在不同温度下的生长情况Fig.2 Growth status of the wild type BY4741, mutant Δrei1 and complementation strains Δreil/MoREI1 of S. cerevisiae at different temperatures
2.3 缺失MoREI1 对稻瘟病菌有性生殖的影响
通过同源重组的方法,获得了稻瘟病菌MoREI1基因敲除突变体(ΔMorei1-22和ΔMorei1-23),并将MoREI1基因重新导入ΔMorei1-22突变体得到回补菌株(ΔMorei1-C)。为探究MoREI1基因缺失是否影响稻瘟病菌的有性生殖,将ΔMorei1-22突变体及野生型菌株(Guy11)分别与不同的交配型测试菌株(TH3)进行对峙培养。结果表明:Guy11菌株与TH3菌株在菌落交界处形成了大量子囊壳,内含子囊和子囊孢子,而相同培养条件下在ΔMorei1-22与TH3菌株的菌落交界处未见有子囊壳的形成(图3),说明MoREI1对稻瘟病菌的有性生殖是必需的。

图3 稻瘟病菌野生型Guy11与ΔMorei1-22突变体的有性生殖测定Fig.3 Sexual reproduction tests of the wild type strain Guy11 and ΔMorei1-22 mutant of M.oryzae
2.4 缺失MoREI1 对稻瘟病菌致病性及附着胞形成率的影响
采用分生孢子悬浮液喷雾水稻幼苗叶片的方法来测定稻瘟病菌MoREI1基因缺失突变体ΔMorei1对水稻叶片的致病性,结果(图4)发现:野生型菌株Guy11 和回补菌株ΔMorei1-C处理的水稻叶片表面形成典型的稻瘟病病斑,而ΔMorei1突变体处理的水稻叶片形成小点状、非扩展病斑(图4A);在疏水玻片表面,野生型菌株Guy11 和回补体菌株ΔMorei1-C的附着胞平均形成率为85%,而ΔMorei1突变体的附着胞形成率仅为6%,且突变体菌株在附着胞形成过程中产生的芽管较长,为弯曲状,附着胞大小相对于野生型菌株也更小,说明MoREI1基因缺失可影响稻瘟病菌的附着胞发育(图4B~C)。同时,大麦表皮穿透实验表明,接种了野生型和回补体菌株分生孢子的大麦表皮所形成的4 级(类型4)侵染菌丝占总的侵染菌丝比例约为80%,而接种突变体菌株分生孢子形成的4级侵染菌丝比例仅为22%(图4D~E),说明MoREI1基因缺失使稻瘟病菌侵染菌丝在寄主组织内的扩展受到抑制。

图4 MoREI1基因缺失对稻瘟病菌致病性、附着胞形成及侵染过程的影响Fig.4 Influence of MoREI1 deletion on pathogenicity,appressorium formation and penetration of M.oryzae
2.5 缺失MoREI1 对稻瘟病菌细胞壁完整性及氧化胁迫因子敏感性的影响
为探究MoREI1基因缺失是否影响稻瘟病菌对细胞壁完整性和氧化胁迫因子的敏感性,本研究测试了ΔMorei1突变体在含细胞壁和氧化胁迫因子培养基上的生长情况。结果显示:ΔMorei1突变体在含200、400 µg/mL 刚果红(CR)的细胞壁胁迫因子培养基中的生长抑制率分别为13%、32%,显著高于野生型菌株(Guy11)的9%和13%的生长抑制率(图5A~B)。类似地,ΔMorei1突变体在含5、10 mmol/L H2O2培养基中的生长抑制率分别为29%、53%,同样显著高于野生型菌株的9%和38%的生长抑制率(图5A~B)。上述结果表明,MoREI1基因缺失导致稻瘟病菌对细胞壁完整性和氧化胁迫因子的敏感性增强。

图5 稻瘟病菌野生型菌株Guy11 与ΔMorei1-22 突变体在含细胞壁及氧化胁迫因子条件下的生长情况Fig.5 Growth status of the wild type strain Guy11 and ΔMorei1-22 of M. oryzae on the stress media that contain the cell wall or oxidative stress factors
2.6 缺失MoREI1 对稻瘟病菌附着胞发育过程中糖原移动和降解的影响
为探究MoREI1基因缺失是否影响稻瘟病菌附着胞形成过程中糖原的移动和降解,本研究对ΔMorei1突变体附着胞形成过程中的糖原进行KI/I2染色(图6A)。结果显示,在疏水玻片上诱导24 h后,野生型菌株(Guy11)中已有82%的分生孢子和95%的附着胞内观察不到糖原,而在突变体菌株(ΔMorei1-22)中仍有76%的分生孢子和82%的附着胞内存在糖原(图6A~C)。上述结果表明,MoREI1基因缺失导致稻瘟病菌附着胞发育过程中糖原的移动和降解速率减缓。

图6 MoREI1基因缺失对稻瘟病菌附着胞形成过程中糖原移动及降解速率的影响Fig.6 Influence of MoREI1 deletion on mobilization and degradation of glycogens during appressorium formation of M.oryzae
2.7 MoRei1 互作蛋白的鉴定
在酿酒酵母中,核糖体生成因子Rei1蛋白主要存在于细胞质中并与核输出因子Alb1 存在直接互作[6],进而促进Alb1 从Pre-60S 核糖体亚基表面解离。通过生物信息学分析发现,在稻瘟病菌基因组中存在酵母Alb1的同源蛋白MoAlb1(MGG_04322)。为探究稻瘟病菌中MoRei1 与MoAlb1 蛋白是否同样存在互作,进行了酵母双杂交实验。结果显示,在稻瘟病菌中MoRei1 与MoAlb1 蛋白间同样存在物理互作(图7)。

图7 MoRei1互作蛋白的鉴定Fig.7 Identification of the interaction protein of MoRei1
2.8 缺失MoRei1 对MoAlb1 细胞核定位的影响
在酿酒酵母中,Alb1 在核糖体生成因子Rei1的协助下从Pre-60S 核糖体亚基上解离后,需再次被转运至细胞核中参与下一轮Pre-60S 核糖体亚基的核输出。有研究表明,在酵母野生型菌株中Alb1 主要定位于细胞核中,而在Δrei1突变体中Alb1 因无法从核糖体亚基上解离而主要定位于细胞质中[6]。为了探究稻瘟病菌MoREI1基因缺失是否影响MoAlb1 的亚细胞定位,将C 端带有GFP 标签的MoAlb1 融合蛋白(MoAlb1-GFP)载体分别导入稻瘟病菌野生型菌株(Guy11)和突变体菌株(ΔMorei1-22)。共聚焦显微镜观察结果(图8)表明:在表达MoAlb1-GFP 的Guy11 菌株,绿色荧光主要集中于细胞核区域,同时细胞质中也有分布;而在表达MoAlb1-GFP 的ΔMorei1-22突变体中,绿色荧光则弥散分布于细胞质中,说明MoREI1基因缺失阻碍了MoAlb1 在稻瘟病菌细胞核中的定位。
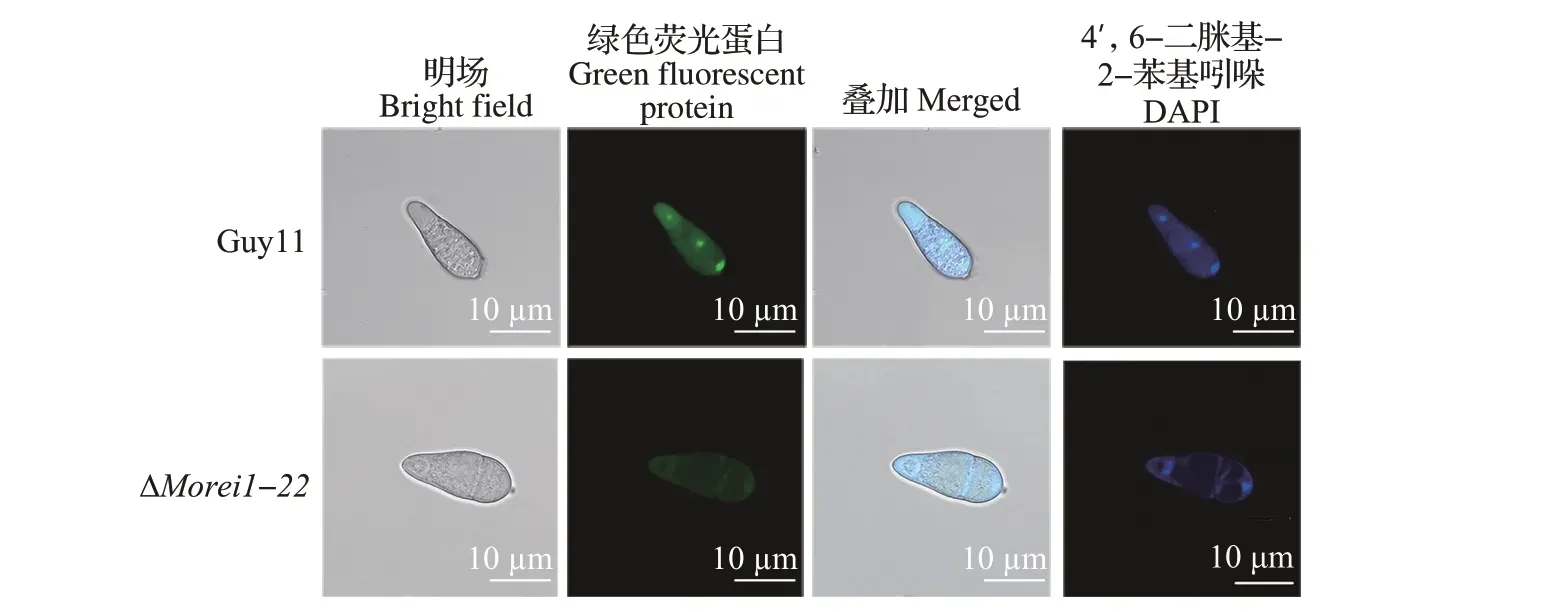
图8 MoREI1基因缺失对MoAlb1细胞核定位的影响Fig.8 Influence of MoREI1 deletion on the nuclear localization of MoAlb1
3 讨论
前人的研究发现,稻瘟病菌MoREI1基因在病菌的营养生长、无性孢子产生和致病性调控中起重要作用[14]。本研究发现,稻瘟病菌ΔMorei1突变体的有性生殖能力丧失,附着胞形成率显著下降,ΔMorei1突变体对细胞壁完整性和氧化胁迫因子的敏感性增强,附着胞形成过程中糖原的移动和降解速率减慢。酵母回补实验结果表明,MoRei1与酵母Rei1 在功能上具有同源性,MoREI1基因缺失同样影响稻瘟病菌中MoAlb1 蛋白的亚细胞定位,说明MoRei1可能也作为核糖体生成因子参与稻瘟病菌核糖体的形成。本研究结果进一步阐明了稻瘟病菌假定核糖体生成因子MoRei1在形态分化和致病性中的生物学功能,对认识稻瘟病菌致病分子机制有重要意义。
在本研究中,当ΔMorei1突变体与对应的测试菌株(TH3)进行对峙培养时,不产生子囊壳和子囊孢子,说明MoREI1基因缺失导致稻瘟病菌的有性生殖能力丧失。有研究发现,酿酒酵母的有性生殖起始于性细胞间的信息素识别,在信息素激活细胞表面受体后,再通过G蛋白通路进行信号转导并磷酸化激活转录因子Ste12,从而启动交配型基因的表达[19-21],促使有性生殖发生。而稻瘟病菌的MoREI1基因缺失是否影响信息素的分泌,并通过稻瘟病菌G蛋白信号通路和Mst12(Ste12同源蛋白)的磷酸化激活,从而调控有性生殖相关基因的表达,有待进一步研究。
本研究发现,稻瘟病菌ΔMorei1突变体相对于野生型菌株Guy11 对水稻叶片的致病力减弱,病状上主要表现为病斑小且为非扩展性病斑。该突变体致病力下降的原因可能有以下2方面:1)ΔMorei1突变体的附着胞形成率低。ΔMorei1突变体的附着胞形成率仅为6%,显著低于野生型菌株的85%,而形成正常的附着胞是稻瘟病菌穿透寄主表皮的关键步骤。此外,ΔMorei1突变体附着胞形成过程中糖原的移动和降解速率减缓也可能影响附着胞的形成及功能。已有研究表明,稻瘟病菌附着胞形成过程中糖原的移动和降解主要受环腺苷酸蛋白激酶A(cyclic AMP-protein kinase A, cAMP-PKA)信号途径和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)途径调节[22],因此,MoREI1基因的缺失可能影响上述2 条信号通路。2)ΔMorei1突变体的侵染菌丝生长受到限制。大麦表皮穿透实验发现,ΔMorei1突变体处理的第3、4 类侵染菌丝占总的侵染菌丝比例显著低于野生型菌株的处理。而根据ΔMorei1突变体在含H2O2培养基上的生长情况,推测突变体侵染菌丝在寄主植物体内的生长受阻,可能是由于MoREI1基因缺失降低了稻瘟病菌对氧化胁迫环境的耐受性。LIU 等发现,在氧化胁迫条件下,稻瘟病菌核糖体生成因子MoYvh1可在热激蛋白70 家族成员MoSsb1 和MoSsz1 的辅助下由细胞质转运至细胞核,并通过促进核糖体的形成从而加快清除ROS的胞外蛋白的合成与分泌,使得侵染菌丝在寄主组织内可正常扩展[13]。由此推测,ΔMorei1突变体的核糖体生成也可能受此影响,进而导致用于清除ROS的胞外蛋白合成受阻,使得侵染菌丝在寄主细胞内的扩展受抑制。另外,本研究也注意到稻瘟病菌ΔMorei1突变体菌落黑色素合成明显少于野生菌株。通过实时荧光定量PCR(real-time quantitative PCR, qRT-PCR)分析发现,ΔMorei1突变体的黑色素合成相关基因(ALB1、RSY1和BUF1)的转录表达水平显著下降(数据未显示),而黑色素合成障碍可能影响附着胞黑色素层的形成和膨压的产生[23],从而导致ΔMorei1突变体附着胞功能异常和致病力下降,有关机制有待进一步研究。
此外,本研究发现稻瘟病菌假定核糖体生成因子MoRei1 与预测的核输出因子MoAlb1 存在物理互作,且MoREI1基因缺失导致MoAlb1蛋白的亚细胞定位改变,由细胞核定位转变为细胞质定位,这些研究结果与酿酒酵母中的结果[6]一致。同时,通过异源互补实验进一步验证了稻瘟病菌MoRei1与酿酒酵母Rei1 具有类似功能,即MoRei1 可能作为核糖体生成因子参与稻瘟病菌的核糖体形成过程。在酿酒酵母中,Rei1 通过促进核输出因子Alb1 从Pre-60S核糖体亚基表面解离,从而使得Pre-60S亚基进一步成熟并与40S 亚基结合,以形成完整的80S 核糖体[9]。然而,我们尚没有MoRei1 直接参与稻瘟病菌核糖体生成的证据,今后有必要提取各菌株的核糖体并进行蔗糖梯度离心实验,通过检测ΔMorei1突变体的核糖体亚基比例来直接揭示MoREI1基因缺失对稻瘟病菌核糖体生成的影响。
值得注意的是,本研究中的稻瘟病菌MoALB1基因属于Alb家族基因,与目前研究更为深入的参与稻瘟病菌黑色素合成的ALB1基因(MGG_07219)并非相同[23]。为进一步探究MoALB1基因在稻瘟病菌形态分化和致病性中的生物学功能,我们对MoALB1基因进行了多次敲除,共获得了1 000多个转化子,但遗憾的是暂未获得敲除突变体。今后有必要对MoALB1基因进行继续敲除或通过RNA干扰等方法来探究MoALB1基因在稻瘟病菌中的生物学功能。
4 结论
本研究发现,稻瘟病菌的MoRei1 与酿酒酵母核糖体生成因子Rei1 具有功能同源性,MoREI1基因缺失导致稻瘟病菌有性生殖能力丧失,附着胞形成率下降,附着胞形成过程中糖原的移动和降解速率减缓,对氧化胁迫和细胞壁胁迫因子的敏感性增强,侵染菌丝扩展受阻。同时,发现MoRei1蛋白与预测的核输出因子蛋白MoAlb1 间存在物理互作,且MoREI1基因缺失影响MoAlb1 蛋白的细胞核定位。由此得出,稻瘟病菌假定核糖体生成因子MoRei1 对稻瘟病菌的有性生殖、胁迫适应、致病性及互作蛋白MoAlb1的亚细胞定位具有重要作用。
