不同百合种质资源对灰霉病的抗性
2022-09-07张铭芳韩东洋杜运鹏高俊莲张秀海
张铭芳, 李 卉, 韩东洋, 杜运鹏, 薛 静, 高俊莲, 张秀海
(1.北京市农林科学院草业花卉与景观生态研究所,农业农村部华北都市农业重点实验室,北京 100097; 2.北京林业大学园林学院,北京 100083)
百合(Liliumspp.)属于百合科(Liliaceae)百合属(Lilium),为多年生球根花卉,具有重要的观赏、食用、药用价值[1]。然而,在百合的栽培过程中均容易发生病害[2]。其中,灰霉病是百合的主要病害之一,百合感染灰霉病后主要危害叶片,也会危害花蕾、芽。初期在叶片形成椭圆形斑块,后期布满浅褐色灰霉状物,使叶片腐烂,花朵腐烂凋萎。灰霉病会造成百合年产量损失20%~30%,严重流行时可造成失收[3]。然而,目前针对百合不同种质资源的灰霉病抗性评价系统在灰霉病抗性育种方面的利用还较少。
灰霉病主要是由半知菌葡萄孢属菌侵染所引起的一类植物病害的总称,其中灰葡萄孢(Botrytiscinerea)危害最大,寄主范围最广。对于不同百合品种灰霉病抗性的鉴定,一般采用离体叶片菌丝块接种法和田间孢子喷雾法2种方法,统计相对病情指数,采用相对抗病性方法将百合对于灰霉病的抗性分为免疫、高抗、中抗、中感、高感5个等级[4-5]。灰霉菌能够引起寄主程序性细胞死亡[6],具有复杂的代谢系统,可产生毒素[7]、细胞壁降解酶、脱落酸[8]、多糖[9]、漆酶[10]等多种代谢产物。活性氧(ROS)是植物体内正常代谢的信号小分子,具有很强的氧化能力,参与植物和细胞内的分子、生化、生理反应,在植物的防卫反应和细胞程序性死亡过程中具有重要作用。植物叶片中的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)与植物抗病性有紧密的联系,被认为是植物抗病反应中的关键性酶。
因此,本研究拟对不同百合种质资源的灰霉病抗性进行系统评价,并结合形态学观察、ROS及酶活性测定,探讨其生理生化方面的抗病机制,以期为培育高抗病百合新优种质奠定基础。
1 材料与方法
1.1 试验材料
本研究的试验材料为11份百合种质资源(表1)。品种的种球从荷兰进口,野生种采集于中国百合不同分布区,种植于北京市农林科学院温室,给予适宜的日常养护管理。

表1 11份百合种质资源
1.2 百合叶片表面结构及病原菌生长进程电镜观察
选取健康的百合叶片,在扫描电镜下观察叶片正面、背面的细胞形态、气孔密度以及气孔大小。购买灰葡萄孢(Botrytiscinerea)菌株(ACCC37263),PDA(Potato dextrose agar)培养基28 ℃活化培养,并在扫描电镜下观察病原菌不同生长时期的生长情况、菌丝结构、孢子形态以及孢子数量。
1.3 不同百合种质资源的灰霉病抗病性鉴定
本研究采用叶片离体接种的方法来鉴定不同百合种质资源对于灰霉病的抗病性。选取百合植株中部、上部健康叶片,将活化后菌板用5 mm的打孔器打成菌块,分别接种在叶片背面,放置在相对湿度为90%以上的恒温培养箱中培养,对照组为不接种。统计不同百合种质资源的发病情况,并对百合灰霉病进行分级[11],具体标准见表2及表3。



表2 百合灰霉病叶部病斑分级标准
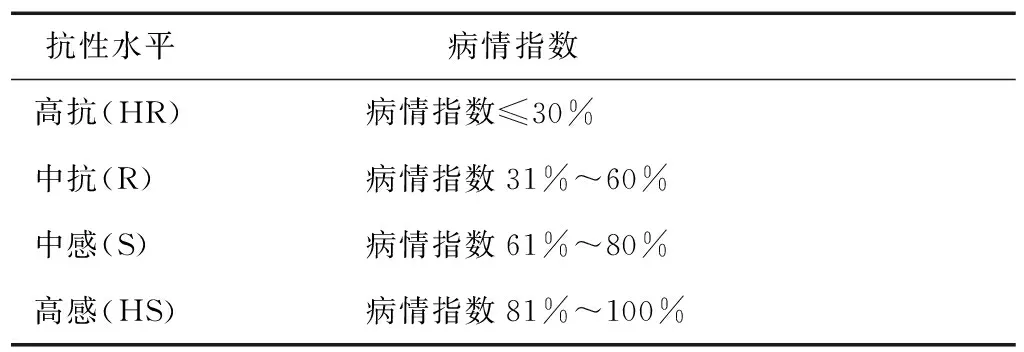
表3 百合抗灰霉病抗性水平分级标准
1.4 过氧化氢(H2O2)、超氧阴离子(O2·-)含量的测定
选择高抗(HR)、高感(HS)材料,在百合叶片表面喷洒浓度为1 ml 5×104个孢子的灰霉菌孢子液,对照组喷洒蒸馏水。扫描电镜下观察分生孢子在叶片上2 h、4 h、6 h、8 h、12 h、24 h、36 h、48 h、72 h时的生长、侵染情况,并按照时间节点取材,液氮速冻后置于-80 ℃冰箱贮藏,用于后续试验。
采用碘化钾分光光度法测定过氧化氢含量。先制作过氧化氢的标准曲线。然后在4 ℃条件下,称取0.2 g百合叶片,放入3.0 ml 0.1%三氯乙醇溶液(TCA)中,12 000 r/min离心15 min,取0.5 ml上清液,与0.5 ml 10 mmol/L磷酸缓冲液(PBS,pH=7.0)和1.0 ml的1 mol/L碘化钾(KI)溶液混合,暗反应1 h后,在分光光度计390 nm波长下检测,根据回归方程计算过氧化氢的含量[12]。
采用羟氨氧化法测定超氧阴离子含量。先制作超氧阴离子标准曲线。然后在4 ℃条件下,称取0.2 g百合叶片,与3.0 ml 50 mmol/L PBS(pH=7.8)混合,12 000 r/min离心15 min,取1.0 ml的上清液,与0.9 ml PBS和0.1 ml 10 mmol/L盐酸羟胺混合,25 ℃条件下反应1 h,之后试管内按顺序分别加入1.0 ml 17 mmol/L对氨基苯磺酸以及1.0 ml 1 mmol/Lα-萘胺,在25 ℃条件下继续反应20 min,最后在波长为530 nm分光光度计下检测,根据回归方程计算其含量[13]。
1.5 超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性的测定
在4 ℃条件下称取0.5 g百合叶片,加入10 ml pH为7.8的缓冲液(1 mmol/L乙二胺四乙酸,2 mmol/L盐酸羟胺和1%可溶聚乙烯吡咯烷酮的50 mmol/L PBS)混合,12 000 r/min离心15 min,上清液就是抗氧化酶的提取物。采用氯化硝基四氮唑蓝(NBT)光还原法测定超氧化物歧化酶活性[14],通过240 nm处由于过氧化氢分解而导致的吸光度降低来测定过氧化氢酶的活性[15]。
1.6 数据统计
所有试验设3个重复,数据通过Microsoft Excel 2010和SPSS软件进行统计分析。
2 结果与分析
2.1 叶片结构
不同百合种质资源的叶片气孔(×250显微镜下观察)及表面附属物观察结果(表4)显示,气孔密度最大的为卷丹百合,气孔密度最小的则是2065-1。气孔最大的为2065-1,气孔最小的是岷江百合-1。
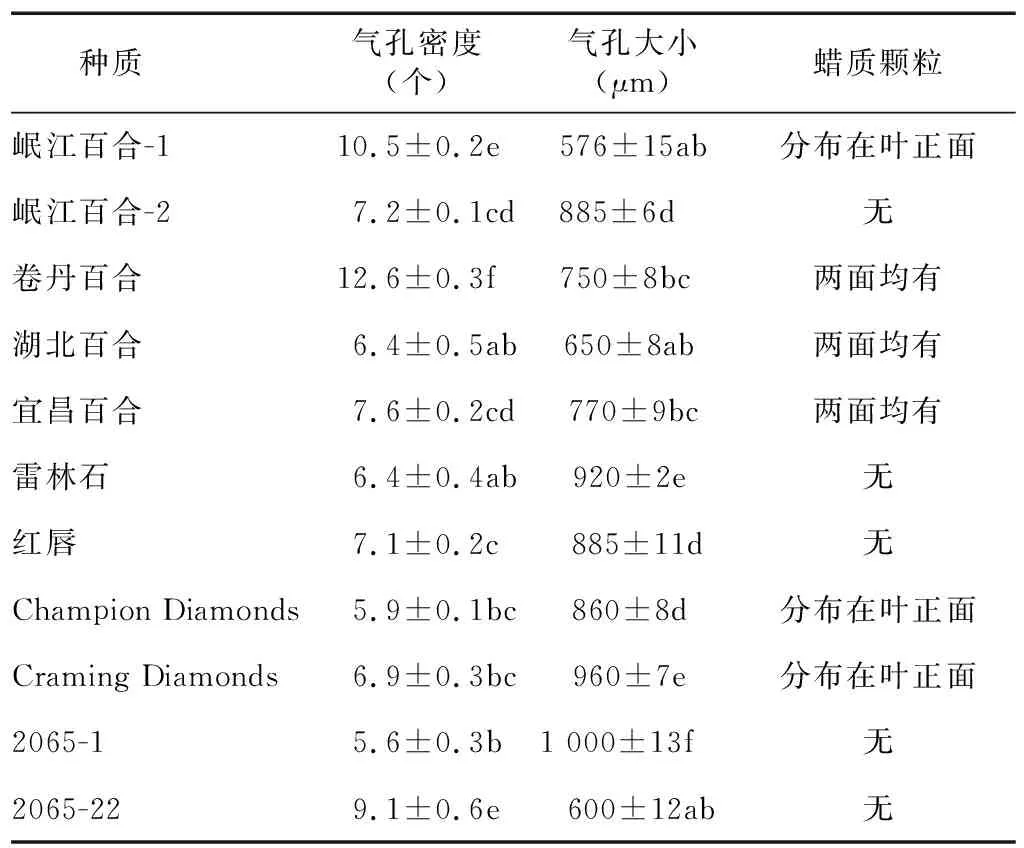
表4 不同百合种质叶片气孔密度、大小及表面附属物对比
部分百合叶片有蜡质层(图1),但是蜡质颗粒的大小、数量、分布均不同。叶片存在蜡质层的有:湖北百合、宜昌百合、卷丹百合、岷江百合-1、Craming Diamonds、Champion Diamonds。其中湖北百合叶片的蜡质颗粒最多,叶正面以及叶背面均有分布。宜昌百合叶背面的蜡质颗粒分布少,主要集中在气孔周围,而岷江百合-1、Craming Diamonds、Champion Diamonds的蜡质颗粒只分布在叶正面,叶背面并未发现蜡质颗粒(图2)。

a:湖北百合叶面;b:卷丹百合叶面。图1 不同百合种质叶片表面结构对比Fig.1 Comparison of leaf surface structure of different lily germplasms
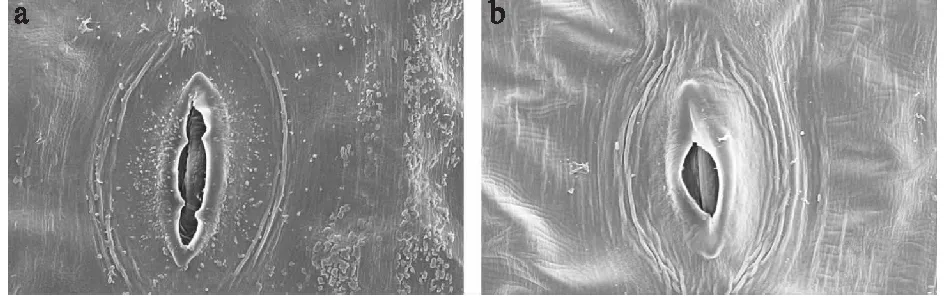
a:宜昌百合叶背面;b:岷江百合-1叶背面。图2 不同百合种质叶背面气孔周围蜡质颗粒分布对比Fig.2 Comparison of wax particles distribution around stoma between different lily germplasms
2.2 百合种质资源的抗病性
离体接种后,划分不同百合种质资源的抗病性等级(图3),统计结果如表5显示。野生种卷丹百合属于高感(HS)种质;野生种岷江百合-1、岷江百合-2、杂交种2065-1属于中抗(R)种质;野生种宜昌百合、湖北百合、杂交种2065-22以及品种Champion Diamonds、雷林石、Craming Diamonds、红唇属于高抗(HR)种质(图4)。其中,湖北百合抗性最强,卷丹百合抗性最弱,接种后第9 d时,叶片病情指数达到100%。
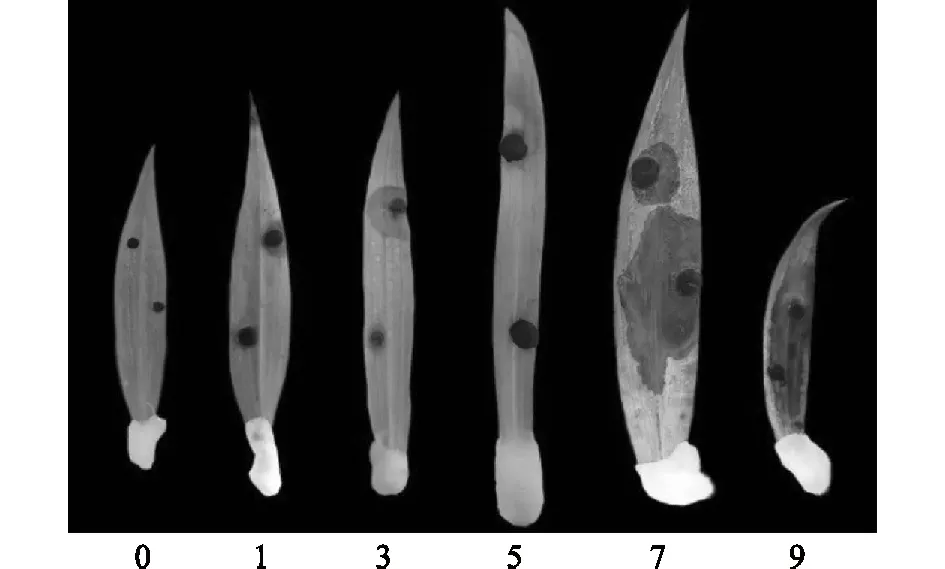
0~9为病级数,具体见表2。图3 百合灰霉病叶部病斑分级标准Fig.3 Grade standard for leaf patches of lily infected with Botrytis cinerea
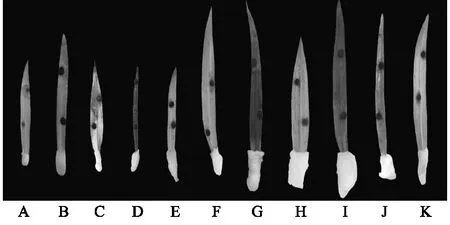
A:Craming Diamonds;B:红唇;C:湖北百合;D:岷江百合-2;E:Champion Diamonds;F:宜昌百合;G:岷江百合-1;H:2065-22;I:2065-1;J:卷丹百合;K:雷林石。图4 百合不同种质接种灰霉菌后的叶斑情况Fig.4 Leaf patches of lily after inoculation with Botrytis cinerea
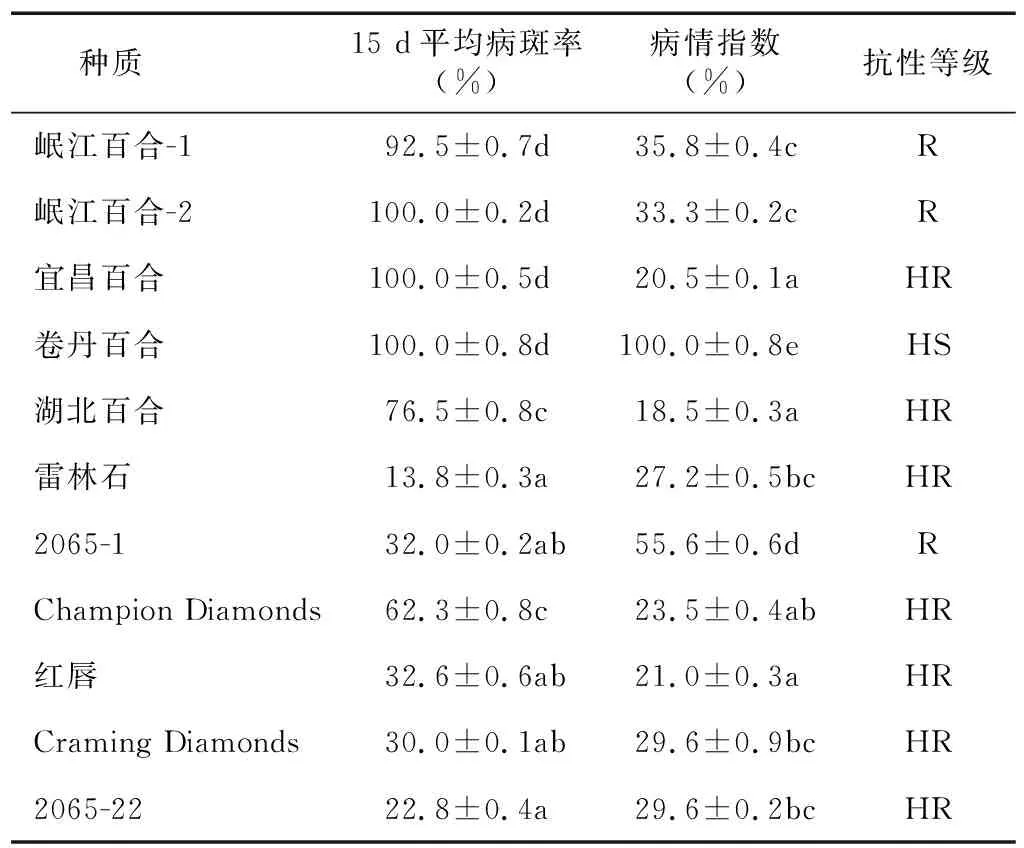
表5 不同百合种质的抗病性
2.3 灰霉菌孢子侵染百合叶片进程观察
在扫描电镜下观察可见,孢子溶液喷洒后2 h,分生孢子已经开始萌发,最大能长至500 μm,整体呈棒状。12 h时,部分分生孢子已经从侧面分生出第二条菌丝,但也有部分孢子停止生长。24 h后,高抗百合叶片上留存的分生孢子数量较少,而高感百合叶片上留存的分生孢子数量较多。72 h时,高抗、高感百合叶片上均产生新的分生孢子。随着接种时间的延长,湖北百合叶片上的孢子数量逐渐变少,且菌丝的生长速度明显慢于卷丹百合叶片上的菌丝(图5)。
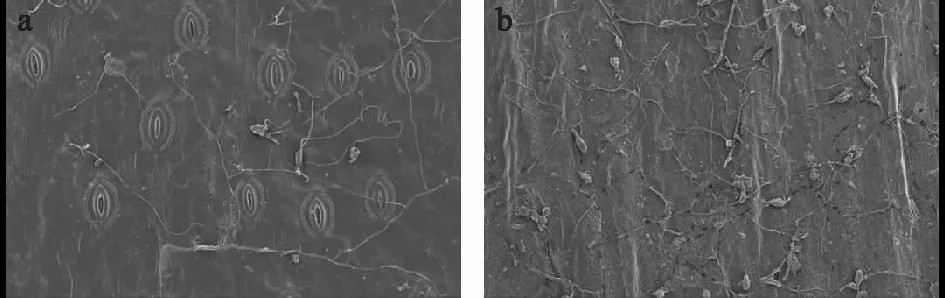
a:高抗种质湖北百合叶面;b:高感种质卷丹百合叶面。图5 高抗、高感百合叶片上分生孢子萌发及菌丝生长情况对比Fig.5 Comparison of conidia germination and mycelial growth in the leaves of lily with high resistance and high susceptibility to Botrytis cinerea
2.4 高抗、高感百合叶片中过氧化氢(H2O2)、超氧阴离子(O2·-)含量的变化
测定湖北百合、卷丹百合接种灰霉菌后叶片中过氧化氢含量,结果(图6)显示,与不接种灰霉菌对照组相比,接种灰霉菌试验组的反应更为迅速,接种2 h时,试验组的过氧化氢含量就已经下降,而对照组则是在4 h时才开始下降。对比卷丹百合和湖北百合叶片内过氧化氢含量的变化趋势,发现湖北百合的波动较卷丹百合更为剧烈,而卷丹百合中会积累更多的过氧化氢。
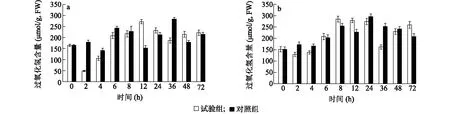
a:高抗种质湖北百合;b:高感种质卷丹百合。试验组:接种灰霉菌;对照组:不接种灰霉菌。图6 接种灰霉菌后高抗、高感百合叶片中过氧化氢含量对比Fig.6 Comparison of hydrogen peroxide content between high resistant and high sensitive lily germplasms after inoculation with Botrytis cinerea
测定湖北百合、卷丹百合接种灰霉菌后叶片中超氧阴离子含量,结果(图7)显示,接种灰霉菌后,卷丹百合叶片中超氧阴离子的含量总体趋向减少,且波动剧烈,而湖北百合叶片中超氧阴离子的含量则总体趋向增多。从整体上看,与不接种灰霉菌对照组相比,接种灰霉菌试验组百合体内超氧阴离子含量变化与百合灰霉病的抗病性可能存在一定的相关性。与对照组相比,试验组的高抗种质湖北百合叶片中超氧阴离子含量在接种灰霉菌24 h内,出现了2次峰值(接种后2 h、12 h),而高感种质卷丹百合叶片中超氧阴离子含量只出现1次峰值(接种后8 h)。接种24 h后,随着时间的推移,超氧阴离子含量变化逐渐平缓。本研究结果与前人报道的研究结果[20]类似,即抗病性强的植物体内活性氧含量会出现2次突增期。
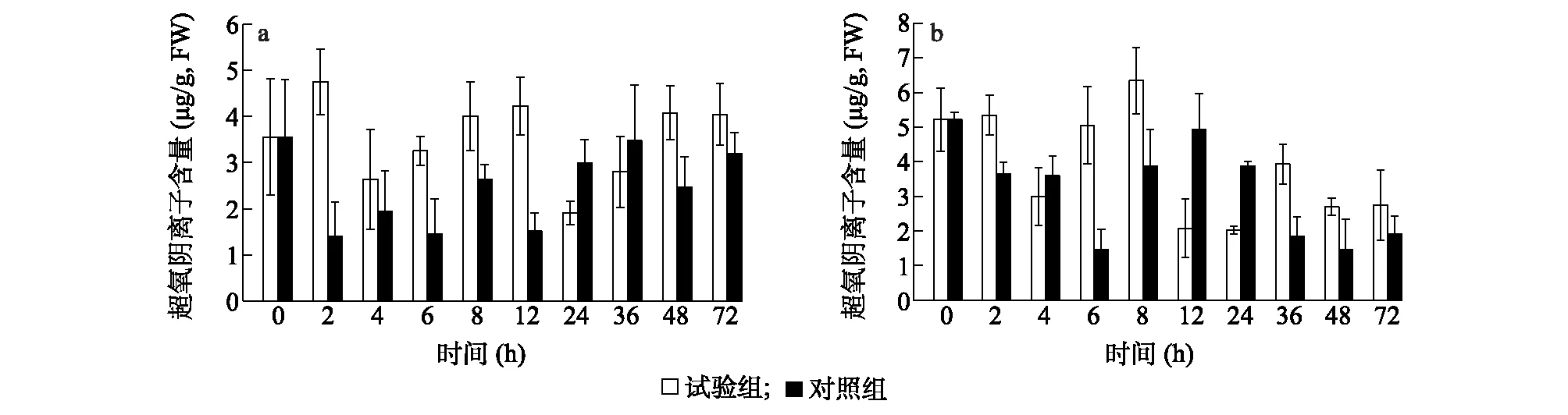
a:高抗种质湖北百合;b:高感种质卷丹百合。试验组:接种灰霉菌;对照组:不接种灰霉菌。图7 接种灰霉菌后高抗、高感百合叶片中超氧阴离子含量对比Fig.7 Comparison of O2·- content between high resistant and high sensitive lily germplasms after inoculation with Botrytis cinerea
2.5 高感、高抗百合叶片中抗氧化酶活性的变化
测定湖北百合、卷丹百合接种灰霉菌后叶片中超氧化物歧化酶(SOD)活性,结果(图8)表明,从叶片中超氧化物歧化酶活性的变化趋势上看,卷丹百合接种灰霉菌试验组与不接种灰霉菌对照组大致相同,湖北百合的对照组与试验组则有明显的差别,对照组整体变化趋势平缓,而试验组则出现了明显变化,在接种后2 h时超氧化物歧化酶活性明显降低,在24 h后超氧化物歧化酶活性持续变强,而卷丹百合中并未出现这种现象。测定湖北百合及卷丹百合接种灰霉菌后叶片中过氧化氢酶(CAT)活性,结果(图9)表明,湖北百合不接种灰霉菌对照组无明显变化,接种灰霉菌试验组略有波动,但与对照组未产生显著差异;卷丹百合叶片中CAT活性变化趋势与湖北百合类似。

a:高抗种质湖北百合;b:高感种质卷丹百合。试验组:接种灰霉菌;对照组:不接种灰霉菌。图8 接种灰霉菌后高抗、高感百合种质叶片中超氧化物歧化酶(SOD)活性对比Fig.8 Comparison of superoxide dismutase (SOD) activity in leaves of high resistant and high sensitive lily germplasms after inoculation with Botrytis cinerea
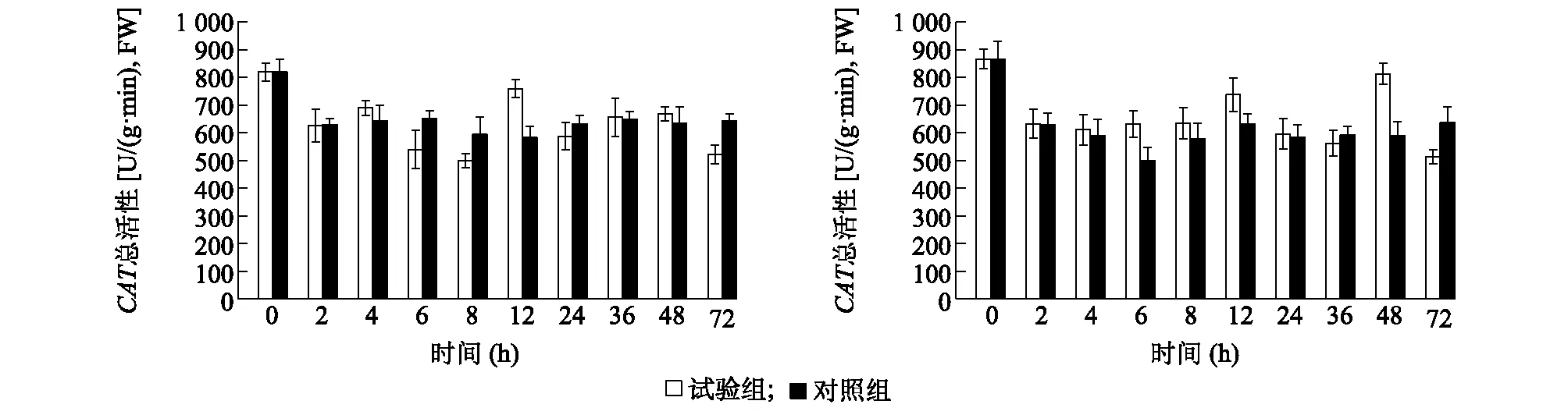
a:高抗种质湖北百合;b:高感种质卷丹百合。试验组:接种灰霉菌;对照组:不接种灰霉菌。图9 接种灰霉菌后高抗、高感百合种质叶片中过氧化氢酶(CAT)活性对比Fig.9 Comparison of catalase (CAT) activity in leaves of high resistant and high sensitive lily germplasms after inoculation with Botrytis cinerea
3 讨 论
抗灰霉病一直是百合抗病育种的主要目标之一,但灰霉病菌传播媒介多,寄主范围广,因此鉴定、应用新的抗病种质资源,培育高抗灰霉病品种是最有效的方法。中国是百合野生资源的重要分布中心,但目前依然缺乏对其抗灰霉病特性的系统评价。
11份不同百合种质资源的叶片形态观察及抗病性评价结果表明,百合的抗病性可能与叶片表面蜡质结构具有一定的相关性。康立功等[16]在研究番茄时也发现蜡质的抗性作用主要是从物理性上阻止病原菌的穿透。此外,气孔是病原菌侵入植物体内的重要途径之一,气孔密度、气孔大小与植物的抗病性有一定的相关性。本研究结果表明,百合灰霉病的抗病性与气孔大小、密度没有显著的相关性。
植物受到伤害,最先引发体内活性氧的增加,在植物体内的保护酶系统中,超氧化物歧化酶能够消除超氧阴离子,而过氧化氢酶则能分解过氧化氢,通过协同作用清除活性氧[17-21]。高抗种质湖北百合在接种病原菌后,其叶片中超氧阴离子含量出现2次峰值(接种后2 h、12 h),而高感种质卷丹百合只出现1次峰值(接种后8 h),此结果与稻瘟菌侵染水稻幼苗前后活性氧变化情况的试验结果[22]相似。本研究发现,高抗种质的SOD活性在接种24 h后持续增高,与抗病性具有相关性。前人在观察葡萄品种资源叶片与灰霉病的关系中发现,葡萄品种的抗病性与过氧化氢酶、抗坏血酸过氧化酶的活性呈正相关[23]。
