程序性死亡因子-1抑制剂联合抗血管生成药物治疗表皮生长因子突变晚期肺腺癌的疗效和安全性分析
2022-09-07耿童童胡浩强申淑景李醒亚郑州大学第一附属医院肿瘤科河南郑州45005郑州大学第一附属医院放疗科河南郑州45005
耿童童,耿 迪,胡浩强,申淑景,李醒亚 (.郑州大学第一附属医院肿瘤科,河南 郑州 45005;.郑州大学第一附属医院放疗科,河南 郑州 45005)
2020年,全球估计新发肺癌占总体恶性肿瘤发病的11%,肺癌仍是导致癌症死亡的首要原因[1]。肺癌中非小细胞肺癌占比远超小细胞肺癌,且大多数患者在发现时已经是晚期,失去了手术的机会。表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitors,EGFR-TKI)已经成为EGFR基因敏感突变非小细胞肺癌患者的一线治疗方案,遗憾的是包括吉非替尼、厄洛替尼在内的EGFR-TKI药物在一线治疗10~13个月后出现病情进展[2-3]。文献[4]报道了相关耐药机制,然而后线治疗方案有限,临床上需要新的治疗选择。在本回顾性临床研究中,纳入56例就诊于郑州大学第一附属医院的存在EGFR基因突变且后线治疗应用程序性死亡因子-1(programmed cell death protein 1,PD-1)抑制剂和抗血管生成药物的晚期肺腺癌患者,收集其临床治疗信息,以分析PD-1抑制剂联合抗血管生成药物用于EGFR基因突变耐药后的晚期肺腺癌患者后线治疗的有效性和安全性,为EGFR基因突变患者靶向治疗耐药后的临床策略提供经验。
1 资料与方法
1.1 一般资料纳入郑州大学第一附属医院2019年1月至2021年6月收治的三线及以上应用PD-1抑制剂联合抗血管生成药物治疗的EGFR基因突变晚期肺腺癌患者共77例,其中8例患者因美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)评分≥3分被排除,5例患者因治疗过程中病理类型发生转化被排除,8例患者因失访排除,本研究共纳入56例患者进行进一步统计分析。
纳入标准:病理诊断确诊为肺腺癌;入组研究前组织或液体基因检测结果提示EGFR基因突变;EGFR-TKI靶向治疗后耐药,存在EGFR 20外显子T790M突变患者入组前均接受过第3代EGFR-TKI治疗;EGFR-TKI耐药后三线及以上治疗应用PD-1抑制剂联合抗血管生成药物;依从性好,有完整的临床病理信息。所有患者均已签署治疗知情同意书。
排除标准:既往确诊其他恶性肿瘤;ECOG评分≥3分;治疗过程病理表型发生变化;存在精神系统疾病;有免疫治疗相关禁忌证。
1.2 疗效评估对患者联合治疗前根据ECOG体力状况评分。治疗2~3个周期后使用胸腹部计算机断层扫描及头颅磁共振成像评估颅内、颅外病灶,必要时选用正电子发射计算机断层显像-计算机断层扫描评估患者病情。每次入院治疗前进行血液学评估,评价不良反应与病情变化。使用实体肿瘤疗效评价标准RECIST 1.1评价近期疗效,分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)、疾病进展(progressive disease,PD),以CR+PR计算客观缓解率(overall response rate,ORR),以CR+PR+SD计算疾病控制率(disease control rate,DCR)。疾病无进展生存期(progression free survival,PFS)指有EGFR基因突变且靶向耐药后的肺癌患者从接受免疫联合抗血管生成药物治疗开始,到观察到PD或发生因任何原因死亡的时间。采用通用不良事件术语标准5.0来评价不良反应。
1.3 统计学处理采用SPSS 21.0进行数据分析;计数资料用百分数表示,比较用χ2检验;以Kaplan-Meier法绘制生存曲线,组间差异用log rank检验比较分析;检验水准α=0.05。
2 结果
2.1 临床病理特征入组56例晚期肺腺癌患者。男21例(37.5%),女35例(62.5%)。年龄34~84岁,中位年龄58岁,其中<60岁30例(53.6%)、≥60岁26例(46.4%)。有吸烟史8例(14.3%),无吸烟史48例(85.7%)。ECOG评分0~1分33例(58.9%),2分23例(41.1%)。有手术史10例(17.9%),无手术史46例(82.1%)。有放疗史22例(39.3%),无放疗史34例(60.7%)。有脑转移29例(51.8%),无脑转移27例(48.2%)。其他转移部位包括骨转移29例(51.8%)、肝转移6例(10.7%)、肺转移39例(69.4%)、胸膜转移36例(64.3%)和肾上腺转移6例(10.7%)。EGFR基因突变类型分别为EGFR 19外显子缺失突变24例(42.9%)、EGFR 21外显子L858R突变29例(51.8%)、EGFR 18外显子G719X突变2例(3.6%)及EGFR 21外显子L861Q突变1例(1.8%),其中合并EGFR 20外显子T790M突变17例(30.4%)、未或未知是否合并EGFR 20外显子T790M突变39例(69.6%)。程序性死亡配体1(programmed death-ligand 1,PD-L1)表达水平<50%者39例(69.6%),包括为0者23例(41.1%);≥50%者3例(5.4%);未知者14例(25.0%)。PD-1抑制剂药物中卡瑞利珠单抗、信迪利单抗、特瑞普利单抗分别为34例(60.7%)、16例(28.6%)、6例(10.1%)。抗血管生成药物中安罗替尼、阿帕替尼分别为35例(62.5%)、21例(37.5%)。
2.2 疗效56例患者中,CR 0例(0.0%),PR 13例(23.2%),SD 27例(48.2%),PD 16例(28.6%),ORR和DCR分别为23.2%、71.4%。不同EGFR基因突变患者近期疗效见表1。
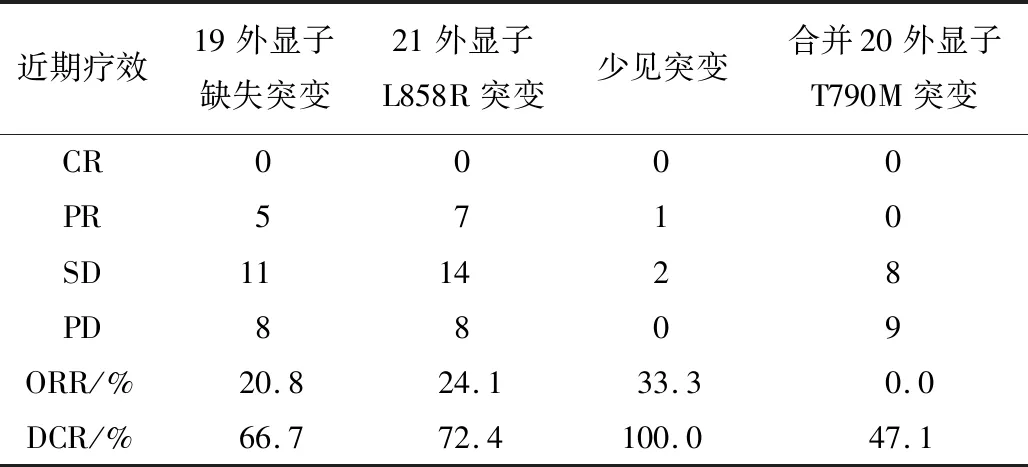
表1 不同EGFR基因突变患者近期疗效 n
所有患者中位疾病无进展生存期(PFS)为4.9个月。合并EGFR T790M突变患者的PFS明显劣于未合并EGFR T790M突变患者(χ2=9.250,P=0.002)。但EGFR 19外显子缺失突变、EGFR 21外显子L858R突变与少见突变患者PFS比较差异无统计学意义(χ2=0.034,P=0.983)。见图1~3、表2。
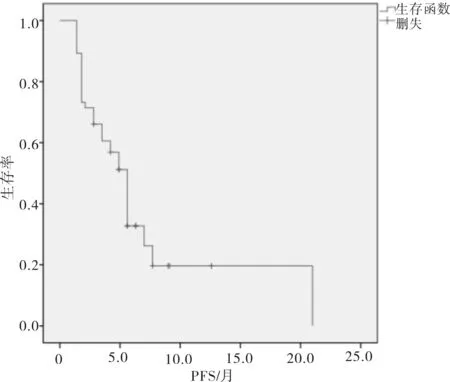
图1 56例患者PFS生存曲线

图2 是否合并EGFR 20外显子T790M突变患者PFS生存曲线比较
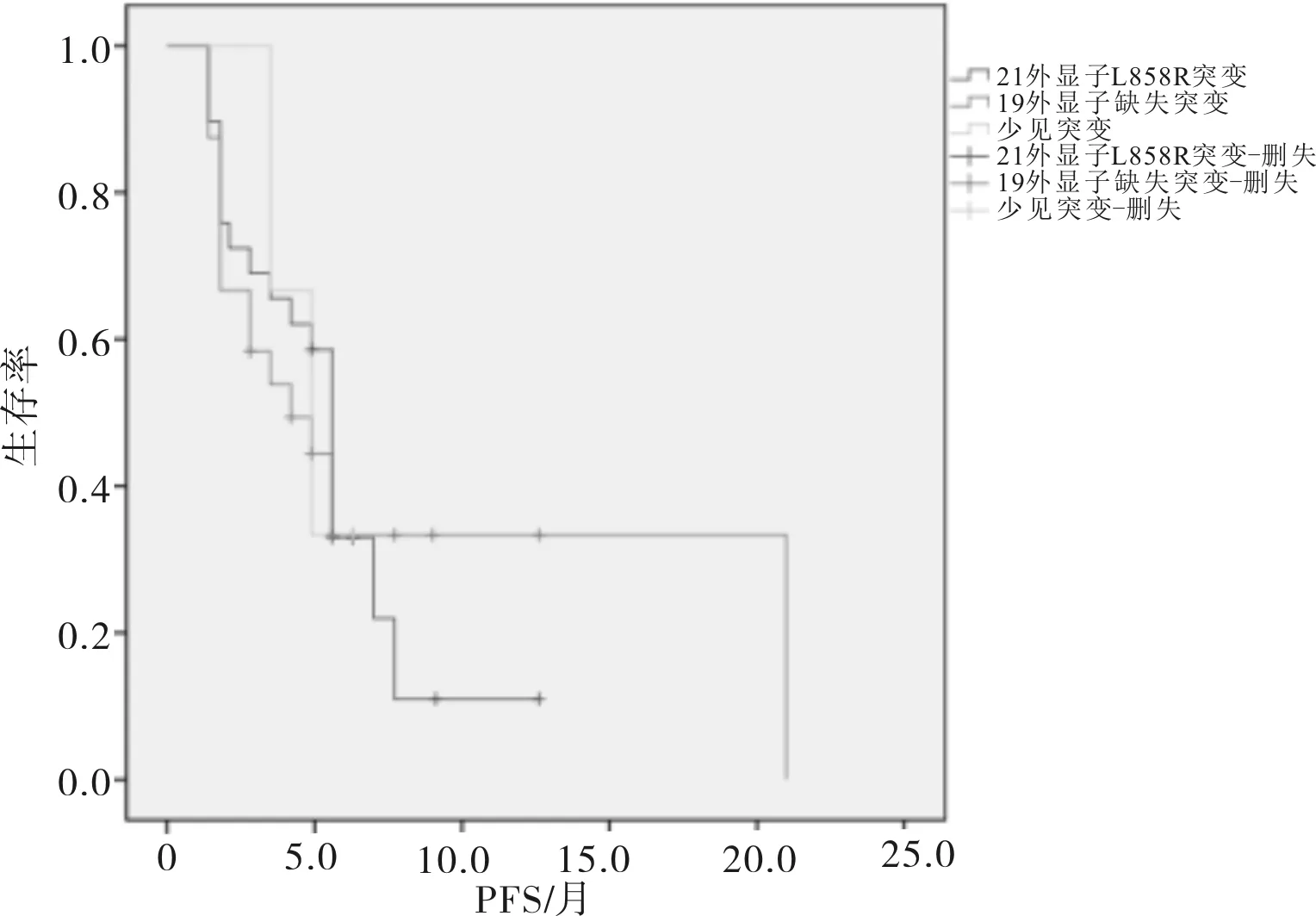
图3 不同EGFR基因突变患者PFS生存曲线比较
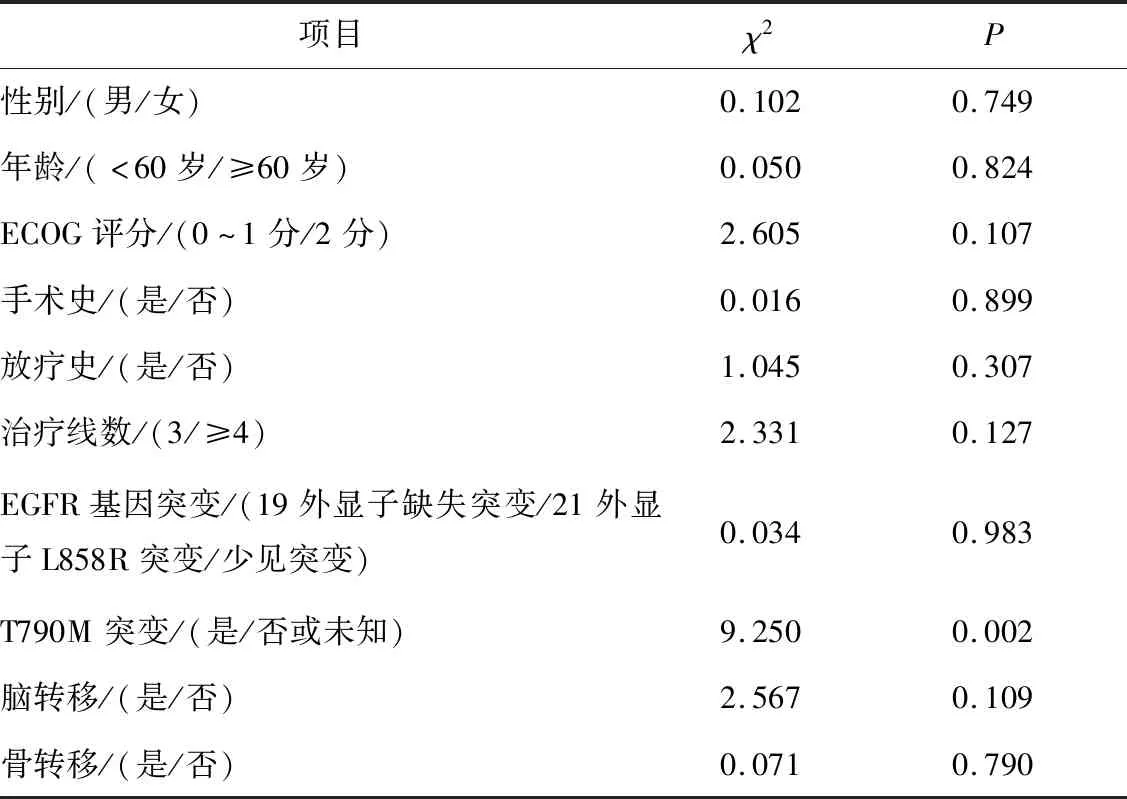
表2 患者临床病理特征与PFS的关系
2.3 不良反应56例患者治疗相关不良反应的总发生率为92.9%。主要不良反应包括乏力24例、白细胞减少症14例、贫血10例、血小板减少12例、甲状腺功能减退6例、食欲下降16例、高血压10例、皮疹8例、腹泻8例、体质量下降14例,其中Ⅲ、Ⅳ度白细胞减少1例、甲状腺功能减退1例、皮疹1例,其余均为Ⅰ、Ⅱ度。所有不良反应经对症治疗后或自行缓解。
3 讨论
随着肺癌治疗的进展,免疫抑制剂已经成为驱动基因阴性晚期非小细胞肺癌的一线治疗方案,疗效在实验及临床已经取得了令人瞩目的效果[5]。然而对于EGFR基因突变晚期非小细胞肺癌患者,免疫抑制剂单药效果较差。一项Meta分析纳入了包括纳武利尤单抗(Checkmate-057)、帕博丽珠单抗(KETNOTE-010)、阿特珠单抗(POPLAR)等多项临床试验,结果提示免疫治疗能够延长EGFR野生型患者总生存期(overall survival,OS),而EGFR基因突变患者无生存获益[6]。此外,在Ⅱ期ATLANTIC研究中,度伐利尤单抗作为EGFR基因突变晚期非小细胞肺癌患者的三线及以上治疗药物,结果显示PD-L1≥25%的EGFR基因突变患者的ORR为12.2%,PD-L1<25%的EGFR基因突变患者的ORR仅为4%,中位PFS仅1.9个月[7]。另外一项多中心回顾性研究[8]纳入了125例接受免疫抑制剂单药治疗的EGFR基因突变晚期非小细胞肺癌患者,其中位PFS与ORR分别为2.1个月和12%,67%的患者评价为PD。本研究入组患者的ORR和DCR分别为23.2%、71.4%,中位PFS为4.9个月。这提示相对于免疫抑制剂单药应用,联合抗血管生成药物显著提高了疗效。相关理论研究也证实一方面抗血管生成药物可以通过缓解肿瘤微环境的缺氧状况,降低免疫抑制性细胞的活性,重塑肿瘤微环境[9];另一方面,抗血管生成药物能通过缓解血管的压力,使新生的肿瘤血管产生变化,从而促进免疫效应细胞的渗透,使肿瘤的免疫抑制性微环境转变为免疫支持状态[10]。
阿帕替尼为我国新型口服的小分子酪氨酸激酶抑制剂,通过靶向血管内皮生长因子受体等多项靶点发挥抗肿瘤血管生成作用[11]。在一项关于单用阿帕替尼在化疗或靶向药物治疗进展后的晚期非小细胞肺癌疗效研究中,EGFR基因突变患者中位PFS为4.0个月,DCR为61.76%[12]。安罗替尼同样作为国产新型小分子酪氨酸激酶抑制剂,通过靶向包括血管内皮生长因子与c-Kit在内的多个靶点发挥抗肿瘤血管生成的作用[11]。一项Ⅲ期临床试验(ALTER0303)中,相较于与安慰剂对照组,三线及以上安罗替尼单药治疗EGFR基因突变晚期非小细胞肺癌患者中位PFS为5.6个月[13]。这比阿帕替尼单药治疗疗效有明显改善。然而在ALTER0303试验中,中位PFS较本研究高。原因可能在于ALTER0303研究纳入均为ECOG评分为0~1分的患者。一项回顾性Meta分析表明免疫治疗对于ECOG评分2分的非小细胞肺癌患者,其PFS、OS、ORR较总人群表现更差[14]。临床前研究也有相关文献证实免疫抑制剂可以通过激活免疫细胞分泌抗肿瘤细胞因子,进而抑制异常肿瘤血管的生成[15-16]。这说明免疫抑制剂与抗血管生成药物在抗肿瘤效应上是相辅相成的。
本研究最终纳入56例EGFR基因突变且EGFR-TKI药物耐药的晚期肺腺癌患者中合并EGFR T790M突变患者的PFS明显劣于未合并EGFR T790M突变患者,但EGFR 19外显子缺失突变、EGFR 21外显子L858R突变与少见突变患者PFS比较差异无统计学意义。这一结果与Haratani等[17]的研究相一致。与EGFR 20外显子T790M突变晚期非小细胞肺癌患者相比,野生型患者在EGFR-TKI药物治疗进展后使用纳武利尤单抗更容易临床获益,原因可能在于PD-L1表达水平相对较高。目前PD-L1的表达水平也被认为是免疫治疗疗效的重要预测因素[18-19]。一项回顾性分析表明肺小细胞癌患者在放疗后增强了PD-L1的表达水平与CD8+T淋巴细胞的浸润[20]。KEYNOTE-001研究的二次分析结果同样也提示与未接受过放疗的患者相比,先前接受放疗患者的PFS、OS均明显延长[21]。然而在本研究中未发现放疗史与PFS有关,原因可能在于放疗位置的差异。本研究仅5例患者为胸部靶病灶放疗,其余为头部或腰椎、腿部的定向放疗。
本研究的不良反应大多数为Ⅰ、Ⅲ度,Ⅲ、Ⅳ度不良反应仅白细胞减少1例、甲状腺功能减退1例、皮疹1例。所有不良反应在对症治疗后或自行缓解。与既往安罗替尼的研究相比,未发现新的不良反应。这提示联合治疗安全性总体可靠。
总之,PD-1抑制剂联合抗血管生成药物在EGFR基因突变晚期肺腺癌患者后线治疗中显示出较好疗效,值得进一步探索。但本次研究中也存在以下几方面的缺陷。首先样本量小,各亚组之间样本量未配对平衡,吸烟史未纳入亚组统计分析。但有相关研究表明香烟产物可通过芳香烃受体诱导肺上皮细胞表达PD-L1[22]。一项前瞻性研究[23]也提示吸烟的肺腺癌患者可能是免疫治疗的受益人群。由于文献中类似相关研究数量较少,因此需要进一步研究确认吸烟在非小细胞肺癌免疫治疗中的预测作用。另外,由于本研究属于回顾性研究,一线及二线治疗方案、治疗线数、药物剂量、PD-1抗体类型、抗血管生成药物种类等可能会对联合治疗的疗效产生影响,因此需要更多的随机对照研究加以论证。本研究14例患者入组前未进行PD-L1的表达水平测定,且进行检测患者中PD-L1≥50%也较少。EGFR基因突变患者PD-L1表达水平较低。这一发现也有关研究[24]一致。本研究联合治疗患者中合并EGFR 20外显子T790M突变患者的PFS明显劣于未合并突变患者。依据PD-L1表达水平、基因突变状态与治疗史的筛选,可以发现能从联合治疗中受益的EGFR-TKI药物耐药后的晚期肺腺癌患者。本研究中PD-1抗体联合抗血管生成药物在EGFR基因突变晚期肺腺癌患者后线治疗中安全有效。由于EGFR基因突变且耐药后治疗缺乏后续策略,对于此类患者的后续治疗值得进一步探索。
