PPP2R3A通过调控p53的表达促进矽肺肺纤维化
2022-09-07史晓妮杨少奇成于思
史晓妮,杨少奇,成于思,巢 杰*
(1东南大学公共卫生学院环境医学工程教育部重点实验室,南京 210009;2东南大学医学院生理学系,南京 210009)
尘肺病是最常见的职业病之一[1-2],而矽肺是尘肺病中发病率高、进展快、病死率高的一种疾病,其特点是长期吸入游离二氧化硅(SiO2)粉尘后肺纤维化进行性加重[3]。但其发病机制尚未完全阐释清楚,且目前药物治疗效果不佳。蛋白磷酸酶2A(PP2A)因参与重要肿瘤信号通路的调节、细胞发育进程及细胞周期的调控而受到众多学者的关注[4-5]。研究报道,在小鼠体内特异性敲除ppp2r1a基因(编码PP2A Aα亚基)会促进炎症的发生以及肝纤维化[6]。蛋白磷酸酶2A 调节亚基B″α(PPP2R3A)是PP2A 调节亚基B″中的一个亚基,不仅影响细胞周期,还参与不同生理和/或病理环境下的代谢和关键信号通路的调控,主要调控细胞周期和凋亡,是细胞增殖的主要调节因子[7]。PP2A的A 和C 亚基普遍表达,但B 亚基的表达水平和细胞定位在不同细胞类型和组织中存在显著差异[8],且PPP2R3A 在纤维化发生中的作用及其机制尚不明确,对于PPP2R3A 与纤维化关系的研究报道相对较少。本研究探讨了PPP2R3A 在矽肺肺纤维化过程中的作用及机制,为防治矽肺提供新的思路。
1 材 料
1.1 试 剂
转化生长因子β1 蛋白(TGF-β1,南京金斯瑞生物科技有限公司);SiO2(美国Sigma 公司);DMEM 培养基、胎牛血清(美国Gibco 公司);ACTB抗体(美国Santa 公司);GAPDH、PPP2R3A、p53、Collagen1、ACTA2 抗体(美国Proteintech 公司);FN1 抗体(英国Affinity 公司);RNA 提取液(日本Takara 公司);Lipo3000 转染试剂(美国Thermo 公司);小干扰RNA(siRNA,上海吉玛医药科技有限公司);进口封闭山羊血清(美国Life Technologies公司);RIPA 裂解液(强)(上海碧云天生物科技有限公司);ECL化学发光试剂盒(上海天能科技有限公司);其余试剂均为市售分析纯。
1.2 仪 器
激光共聚焦扫描显微镜FV 3000(日本Olympus 公司);PCR 扩增仪(美国Bio-Rad 公司);酶标仪(美国BioTek 公司);高温低速冷冻离心机(德国Eppendorf 公司);凝胶成像曝光仪(上海天能科技有限公司)。
1.3 动 物
清洁级雄性C57BL/6 小鼠,体重20 ~ 25 g,购自南京医科大学实验中心,合格证编号SYXK(苏)2016-0014。所有动物实验均符合动物伦理委员会标准。
1.4 细胞株
人成纤维细胞(HPF-a)株购自美国ScienCell公司,培养在含有10%胎牛血清、青霉素、链霉素、谷氨酰胺的DMEM完全培养基中。
2 方 法
2.1 构建小鼠矽肺肺纤维化模型
将小鼠置于恒温和湿度适宜的条件下,自由饮食,光/暗循环12 h/12 h。小鼠腹腔注射戊巴比妥钠麻醉,手术暴露气管,采用提前制备的SiO2悬浮液(250 mg/kg)气管滴注,建立小鼠矽肺肺纤维化模型。对照组给予等量的无菌生理盐水。造模56 d后取肺组织,用于做免疫荧光实验的肺组织首先灌注磷酸盐缓冲液,用4%多聚甲醛固定、30%蔗糖溶液脱水,冰冻切片、染色。所有动物手术均严格按照ARRIVE指南(动物研究:体内实验报告)进行,动物手术均经东南大学医学院动物护理与使用委员会批准,符合有关实验动物管理和使用的规定。
2.2 TGF-β1 刺激HPF-a 细胞构建纤维化相关的体外模型
HPF-a 细胞接种于培养瓶或培养皿中,在含有5% CO2、37 ℃的培养箱中培养,2 ~ 4 d 进行一次传代扩增。之后在含有细胞的培养板依次加入0,1,2.5,5,10 ng/mL的转化生长因子β1 蛋白(TGF-β1),处理24 h后收集样品,加裂解液提取蛋白,用Western blot 实验选取最适刺激浓度。之后用最适浓度处理细胞,按0,1,3,6,12,24 h 收集样品,加细胞裂解液或RNA 提取液(Trizol)检测细胞内蛋白水平或mRNA表达变化。
2.3 天狼星红染色
成功建立小鼠模型后,将肺组织取出,用4%多聚甲醛固定,将肺组织切片备用。用磷酸盐缓冲液冲洗肺组织切片3次,加入天狼星红染液在室温孵育60 min,之后迅速用醋酸溶液冲洗2 次,用乙醇溶液漂洗,浸泡和脱水,中性树胶封片,4 ℃保存,待显微镜观察捕捉图像。
2.4 RNA干扰
将细胞接种在24 孔板上,当细胞密度达到60%~80%时开始转染。在转染实验开始时,在一管无血清培养基中加入siRNA,另一管无血清培养基中加入转染试剂,静置5 min 后,将两种溶液混合静置15 min。将混合溶液加入孔板中,孵育至少12 h,然后更换完全培养基,将细胞置于37 ℃培养箱中继续培养用于后续实验。
2.5 统计分析数据
使用GraphPad Prism 8.0 统计分析各项实验数据和作图,每组数据以±s表示,两组独立样本之间采用t检验,多组样本间采用单因素方差分析,以P <0.05认为有统计学意义;使用Image J 对Western blot条带、划痕实验进行统计分析。
3 结 果
3.1 PPP2R3A在矽肺小鼠模型中表达增加
天狼星红染色结果显示,与生理盐水(NS)组相比,矽肺模型(SiO2)组胶原明显沉积,有典型的矽结节形成(图1-A),Western blot 结果显示,ACTA2 的蛋白水平在矽肺模型组显著高于NS组(图1-B,1-C),均可提示小鼠矽肺模型构建成功。Western blot 结果显示,PPP2R3A的蛋白水平在矽肺模型组显著高于NS 组(图1-D,1-E)。组织免疫荧光结果显示,在矽肺模型组中,与纤维化相关的标志物波形蛋白(vimentin)的水平增加,这提示肺中成纤维细胞增加,且PPP2R3A 与vimentin存在共定位,同时PPP2R3A的蛋白水平高于NS组,说明在肺纤维化发生发展进程中,PPP2R3A 在成纤维细胞中表达增加(图1-F)。
3.2 PPP2R3A 在TGF-β1 处理的细胞模型中表达显著上调
TGF-β1 可作为矽肺早期生物标志物之一,在矽肺发生发展中有重要作用。采用TGF-β1 刺激HPF-a 细胞构建体外模型,Western blot 结果显示TGF-β1 刺激HPF-a 细胞,纤维化相关标志物FN1和ACTA2 水平在5 ng/mL 时最高(图2-A ~ 2-C)。在之后的体外实验中,TGF-β1 的质量浓度均采用5 ng/mL。TGF-β1 刺激HPF-a 细胞,Western blot 结果显示纤维化相关标志物FN1和ACTA2水平呈时间依赖性上调(图2-D ~ 2-F),纤维化相关细胞模型构建成功。
在体实验结果提示,PPP2R3A 在矽肺模型组的蛋白水平高于NS 组。本研究进一步探讨在体外细胞模型中PPP2R3A的变化。TGF-β1 刺激HPF-a 细胞后,Western blot 结果显示PPP2R3A的蛋白水平呈短暂性上升,6 h 达到峰值(图3-A~3-B)。qRT-PCR 结果显示Ppp2r3a表达呈时间依赖性上升(图3-C)。进一步说明了PPP2R3A的上升可能参与了矽肺纤维化的病理进程。
3.3 PPP2R3A 介导了TGF-β1 诱导的HPF-a 细胞功能
TGF-β1 可以使HPF-a 细胞活力升高、迁移速度增加(图4-A、4-E)。本研究进一步探究敲减Ppp2r3a是否可以逆转这一现象。首先采si-RNA敲 减Ppp2r3a,Western blot 结 果 发 现siRNAPpp2r3a-1174敲减效率最高(图4-B~4-C);且敲减Ppp2r3a可以部分逆转TGF-β1 引起的细胞活力和迁移能力的增加(图4-D~4-F)。
3.4 PPP2R3A介导了TGF-β1诱导的FN1升高
FN1 和ACTA2 是纤维化发生的两个标志物,文献报道FN1主要影响细胞迁移和增殖[9],ACTA2是肌成纤维细胞最常用的分子标志物,是细胞活化的标志,同时影响细胞迁移和增殖[10-11]。敲减Ppp2r3a可以部分逆转TGF-β1 引起的FN1 的上升(图5-A ~ 5-B),对ACTA2 的水平影响不显著(图5-A、5-C)。
3.5 PPP2R3A介导了TGF-β1诱导的p53升高
通过String 数据库分析发现,PPP2R3A 与p53信号通路的相关蛋白有联系(图6-A)。用5 ng/mL TGF-β1 刺激HPF-a 细胞,发现p53 的蛋白水平呈快速而短暂的上升(图6-B ~ 6-C)。敲减Ppp2r3a可以部分逆转TGF-β1引起的p53的上升(图6-D),并结合实验室前期对于p53/PUMA的表达介导矽肺的细胞活化和迁移的研究[12],提示p53可能作为PPP2R3A的下游促进矽肺纤维化进程的重要分子,从而进一步促进肺成纤维细胞的增殖和迁移,加快矽肺纤维化进程。
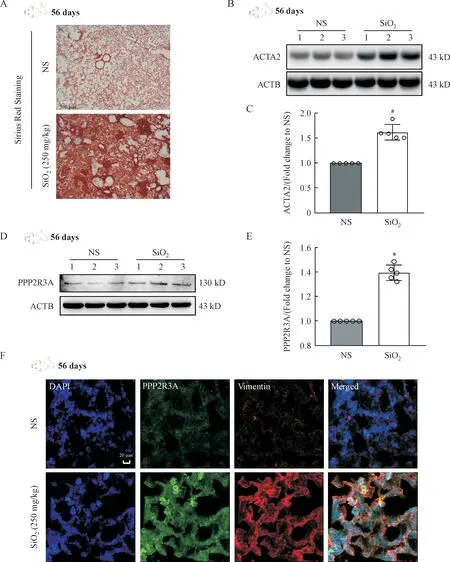
Figure 1 PPP2R3A expression was increased in silicosis mouse models
4 讨 论
PPP2R3A 主要通过靶向细胞周期调节因子和凋亡抑制因子调控细胞周期,是细胞增殖的主要调节因子[13],这一蛋白与疾病的关系目前报道较少。结合本课题组前期环状RNA 测序结果提示[14],PPP2R3A 对应的环状RNA 发生变化,因此探究PPP2R3A 与肺纤维化的关系势在必行。本研究采用课题组前期摸索的造模浓度和时间[15],气管滴注SiO2成功构建小鼠矽肺肺纤维化模型,矽肺肺纤维化小鼠中PPP2R3A的水平显著高于生理盐水组,提示PPP2R3A 在肺纤维化发生中可能发挥着重要的作用。相关文献报道TGF-β1 可致纤维化[16-17],而在HPF-a 细胞中TGF-β1 是否也能致纤维化尚不明确。本研究采用TGF-β1 在HPF-a 细胞中成功构建肺纤维化体外模型。TGF-β1 刺激HPF-a 细胞,PPP2R3A的蛋白水平呈短暂性的上升,FN1 和ACTA2 的蛋白水平呈时间依赖性上升。本研究的结果提示PPP2R3A的蛋白变化在mRNA之前,可能由于转录后调控和翻译及翻译后调控,分析可能是翻译后调控或者是转录调控的正向调节在此过程中发挥调控作用,后续将继续对此进行分析研究。本研究发现敲减Ppp2r3a之后,细胞迁移能力和细胞活力降低,FN1 的蛋白水平下调,但是对ACTA2 的蛋白水平影响不显著。FN1 主要影响细胞迁移和增殖[9],研究结果与所报道的文献一致。有趣的是,ACTA2 是细胞活化的标志,敲减Ppp2r3a仅影响细胞活力而不影响ACTA2 的蛋白水平,说明细胞活力可能不仅仅受ACTA2的影响,有待进一步探究。
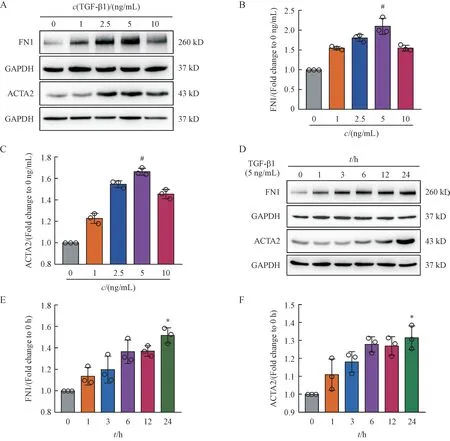
Figure 2 TGF-β1 stimulated HPF-a cells to construct in vitro model
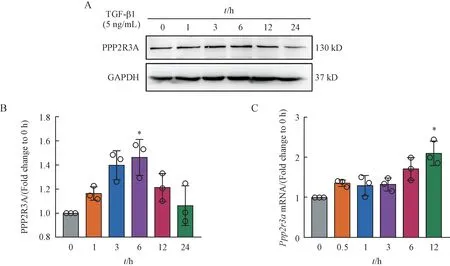
Figure 3 Expression of PPP2R3A in cell models
新近的研究理念提出肺成纤维细胞的活化以及细胞凋亡的失衡是肺纤维化发生的关键环节[18],p53信号通路通过调控成纤维细胞的增殖与活化在纤维化进展中发挥重要作用[19-21]。本研究发现,TGF-β1 刺激细胞后,p53 呈快速而短暂的上升,且敲减Ppp2r3a部分逆转TGF-β1引起的p53的蛋白水平上升,结合本课题组前期的研究,p53 可以促进细胞迁移、增殖,使细胞活力增强[12]。因此,本研究证实了PPP2R3A 在肺纤维化中发挥作用与p53有关。
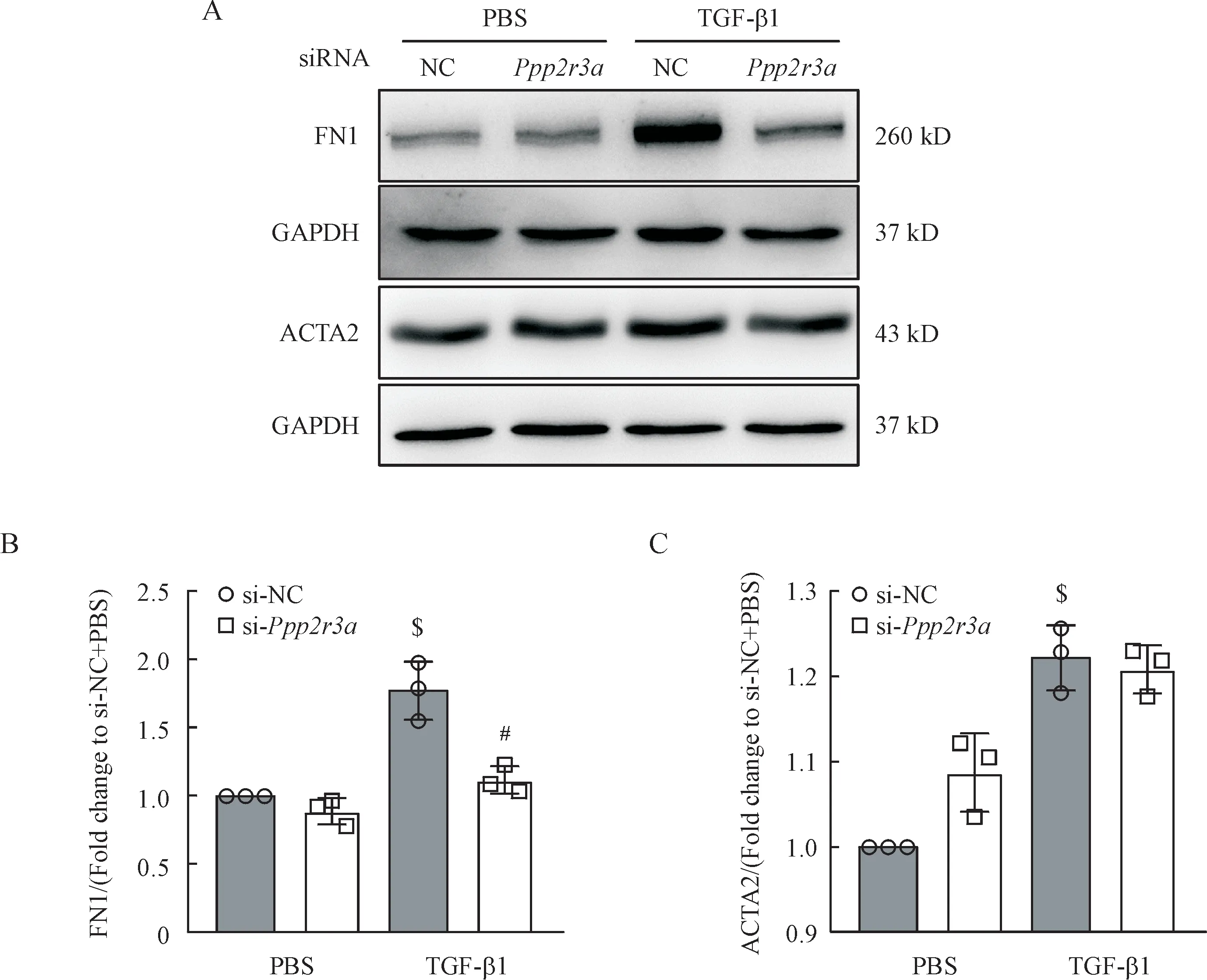
Figure 5 Effects of PPP2R3A on fibrosis markers FN1 and ACTA2

Figure 6 Effect of PPP2R3A on p53 protein level
综上所述,在肺纤维化中,PPP2R3A 和p53 的水平均上调,这提示PPP2R3A 和p53 在纤维化的发生中发挥作用。进一步实验发现敲减Ppp2r3a部分逆转TGF-β1 引起的细胞活力和迁移增加以及p53 的蛋白水平上升,提示PPP2R3A 可通过调控p53的表达促进纤维化的发生,这为肺纤维化的防治提供了新的思路。
致谢:本研究得到东南大学医学院核心实验室的支持。
