柴胡皂苷d的体内外肠道吸收机制研究
2022-09-07邢媛月任偲琪刘奇玮杨晋妮董海娟张尊建
邢媛月,任偲琪,刘奇玮,杨晋妮,董海娟,宋 瑞*,张尊建**
(1中国药科大学药物质量与安全预警教育部重点实验室,南京 210009;2中国药科大学公共实验室平台,南京 210009)
柴胡,为伞形科植物柴胡Bupleurum chinenseDC.或狭叶柴胡Bupleurum scorzonerifoliumWild.的干燥根,具有升举阳气、行气活血、疏肝解郁等功效[1]。柴胡皂苷d(saikosaponin d,SSd)是从柴胡中分离得到的五环三萜类化合物,具有抗炎、抗肿瘤、抗抑郁、免疫和神经调节等多种药理活性[2]。药代动力学研究发现无论是口服柴胡皂苷单体、柴胡提取物还是含柴胡的复方中药,SSd的生物利用度均较低[3-5]。药物口服后体内暴露量与肠道吸收机制密切相关,因此,系统深入地研究SSd 肠道吸收机制对了解其体内过程和药效作用机制具有重要意义。
药物在体内的肠道吸收由溶解性和渗透性共同决定。SSd的水溶性系数(Sw)为4.47 × 10-5,表明其水溶性较差,与羟丙基-β-环糊精(HPBCD)络合生成SSd-HPBCD 复合物后,其水溶性显著提升350倍[6]。李渊等[7]利用外翻肠囊法研究正常大鼠和抑郁模型大鼠空肠和回肠对柴归颗粒中活性成分的吸收,在检测到的柴胡皂苷类成分(SSa、b1、c、d、g)中,SSd的跨膜转运量最低。Du 等[8]利用Caco-2 单层模型研究小柴胡汤中33 种已知成分的跨膜转运,发现SSd 跨膜渗透性较差,根据BCS 分类标准,其属于Ⅳ类化合物。利用大鼠在体单向肠灌流模型探究柴胡-芍药药对的配伍机制时,发现SSd 及其同分异构体SSa 在大鼠肠道的吸收较差(有效渗透率<0.4),不同肠段的吸收顺序依次为回肠、结肠、空肠、十二指肠;进一步研究发现,SSd 和SSa 能促进芍药苷的肠道吸收,但芍药苷对其吸收无明显促进作用[9]。上述研究表明SSd的肠道渗透性较差,但未对其肠道吸收机制和影响因素作进一步探讨。本课题组前期利用Caco-2 单层模型研究SSd的双向转运,流出比(efflux ratio,ER)结果提示SSd的转运方式涉及主动转运,值得进一步深入研究[10]。
因此,本实验的目的是利用Caco-2 单层和大鼠在体单向肠灌流模型对SSd的体内外肠道吸收机制进行全面研究,为新药开发、药理学研究和潜在的药物-药物相互作用提供参考依据。
1 材 料
1.1 药品与试剂
SSd(纯度>99.0 %,成都德斯特生物科技有限公司);坎利酮(纯度>99.0%)、利福平、柚皮苷(中国食品药品检定研究院);HBSS,N-2-hydroxyethylpiperazine-N-ethane-sulphonicacid(HEPES),二甲基亚砜(DMSO)(美国Sigma-Aldrich 公司);2-Morpholinoethanesulfonic acid(MES)(索莱宝生物科技有限公司);维拉帕米、荧光素、普萘洛尔、呋塞米、普鲁卡因胺(上海源叶生物科技有限公司);MTT 试剂盒、MK571(碧云天生物技术有限公司);Ko143、四乙基氯化铵、乙二胺四乙酸(EDTA)(阿拉丁试剂有限公司);2,4-二硝基酚(DNP)、色谱纯甲醇、乙腈、异丙醇(德国Merck 公司);MEM 不完全培养基(凯基生物有限公司)。甲酸(色谱纯,美国ROE科技公司)。其余试剂均为市售分析纯。
1.2 动 物
雄性Sprague-Dawley 大鼠,体重(250 ± 20)g,购自上海实验室动物研究中心,合格证号:SCXK(沪)2018-0006。所有动物研究均遵循国际医学伦理规范并经中国药科大学动物伦理委员会批准。
1.3 仪 器
12 孔Transwell 小室(No.3401)、ERS-2 细胞电位仪(美国Millicell 公司);Infinite 200Pro 多功能酶标仪(瑞士Tecan 有限公司);三重四极杆液相色谱质谱联用仪UPLC-MS/MS 8060(日本Shimadzu 公司):SIL-30AC 自动进样器、LC-30AD 泵、CTO-20AC 柱温箱、CBM-20A 系统控制器、DGU-20A5R脱气机、MS-8060三重四极杆质量分析器。
2 方 法
2.1 Caco-2细胞培养和转运研究
2.1.1 Caco-2单层的构建 Caco-2细胞购自中国科学院(上海)细胞库,实验中所用细胞代数在25代以内。取细胞密度为每毫升1×105个的细胞悬液0.5 mL 接种在小室的顶端侧(AP 侧),在基底外侧(BL 侧)加入相同的空白完全培养基1.0 mL,培养基含有20%FBS、D-葡萄糖(1.0 g/L)、L-谷氨酰胺(0.29 g/L),青霉素(80 U/mL),链霉素(0.08 mg/mL),碳酸氢钠(2.20 g/L),丙酮酸钠(0.11 g/L)。细胞接种之后的一周内隔天换液,随后两周每天换液,培养21 d 后,Caco-2 细胞完全分化,表现出类似于成熟肠细胞的形态和功能特征。单层模型构建完成之后,采用普萘洛尔(高渗透性)、呋塞米(低渗透性)、荧光素(细胞旁转运)3种渗透性标志物检验Caco-2 单层的完整性和通透性[10]。转运实验前,更换新鲜培养基测定跨膜电阻值(TEER),选取TEER 在350 ~ 1 000 Ω·cm2范围的培养孔进行后续实验。
2.1.2 转运实验 Caco-2 细胞单层用37 ℃预热的Hank′s 平衡盐溶液(HBSS)洗涤3 次。在AP 侧加入空白HBSS 溶液(pH 6.5)0.5 mL,在BL 侧加入空白HBSS 溶液(pH 7.4)1.0 mL,12孔板置于细胞培养箱预孵育30 min。SSd的双向转运实验中,对于AP-BL/BL-AP 方向,在供给侧(AP/BL)加入含有5 μmol/L 柴 胡皂 苷d的HBSS 溶 液(pH 6.5/7.4),接收侧(BL/AP)加入空白HBSS 溶液(pH 7.4/6.5)。随后,12孔Transwell培养板置于37 ℃,100 r/min,分别在0、60、100、140、180 min于接收侧吸取转运介质100 μL,每次取样之后补充空白HBSS 溶液100 μL。转运实验结束,再次测定TEER 评估细胞单层的完整性,然后收集细胞并通过超声裂解获得细胞基质样品溶液。所有样品在分析之前保存于-80 ℃条件下。
按照相同的实验操作,分别研究不同因素对SSd转运的影响,包括不同浓度(0.5、1、5 μmol/L)、温度(4 ℃、37 ℃)、AP 侧pH(6.0、6.5、7.4)等。为进一步探究摄取转运蛋白和外排转运蛋白在SSd肠道吸收中的潜在作用,考察了转运蛋白抑制剂对SSd 吸收的影响,包括有机阴离子转运多肽(OATPs)抑制剂(100 μmol/L 利福平、200 μmol/L柚皮苷)[11]、有机阳离子转运蛋白(OCTs)抑制剂(500 μmol/L 普鲁卡因胺、500 μmol/L 四乙基氯化铵)[12-13],P-糖蛋白(P-gp)抑制剂(100 μmol/L 维拉帕米)[14]、乳腺癌耐药蛋白(BCRP)抑制剂(5 μmol/L Ko143)[15]、多药耐药相关蛋白2(MRP2)抑制剂(50 μmol/L MK571)[15]。采用细胞旁途径增强剂EDTA(5 mmol/L)研究SSd的跨膜转运是否涉及细胞旁转运途径[16]。
此外,为评估SSd降解及Transwell小室滤膜对SSd的吸附对实验结果的影响,设置无Transwell小室(不含细胞)以及有Transwell 小室(不含细胞)的对照组。
2.1.3 表观渗透系数和流出比 参考文献[15]中的公式,计算表观渗透系数(Papp)和流出比(ER)。
2.2 大鼠在体单向肠灌流研究
2.2.1 灌流液的配制 肠道灌流液采用改良的Krebs-Ringer(K-R)缓冲液配制而成,含有7.80 g/L NaCl、0.35 g/L KCl、0.32 g/L NaH2PO4、1.37 g/L NaHCO3、0.02 g/L MgCl2和1.40 g/L葡萄糖,溶液的pH调节至6.5。
2.2.2 实验操作 根据已有报道进行大鼠在体单向肠灌流研究[17]。实验前动物禁食12 h,自由饮水。大鼠通过腹腔注射25%乌拉坦麻醉,当疼痛反射消失后,沿腹部中线纵向切开3~4 cm,分离10~12 cm的肠段(十二指肠、空肠或回肠)并在两端插入插管。用含已知浓度SSd(含有或不含有抑制剂)的灌流溶液以0.2 mL/min(30 min,37 ℃)的流速平衡肠道。以15 min 为时间间隔收集流出口灌流样品,实验操作全程共90 min。实验结束时,在不拉伸的情况下切下灌流肠段测量长度和半径。
本实验考察了不同浓度SSd(40、80、120 μmol/L)、不同肠段(十二指肠、空肠和回肠)、不同转运蛋白抑制剂(150 μmol/L 维拉帕米、200 μmol/L 柚皮苷和500 μmol/L 四乙基氯化铵)、EDTA(5 mmol/L)和代谢酶抑制剂(DNP)(500 μmol/L)[18]对SSd肠道吸收的影响。此外,分别对两组大鼠进行胆管插管和颈静脉插管,用于在灌流过程中收集胆汁和血浆样本。
2.2.3 有效渗透系数和吸收速率常数 为避免肠道吸收水分对结果的影响,采用重量法校正偏差。参考文献[15]中的公式,计算有效渗透系数(Peff)和吸收速率常数(Ka)。
2.3 样品前处理方法和UPLC-MS/MS分析
2.3.1 转运介质样品溶液的前处理 精密吸取转运介质样品溶液100 μL,加入900 nmol/L的坎利酮溶液(IS)10 μL、萃取试剂(乙酸乙酯-二氯甲烷,4∶1)1 mL,涡旋5 min,4 ℃,12 000 r/min,离心10 min,取上清液800 μL,氮气吹干,以初始比例流动相40 μL复溶,供UPLC-MS/MS分析。
2.3.2 灌流溶液样品的前处理 精密吸取灌流样品溶液100 μL,加入6 μmol/L 坎利酮溶液(IS)10 μL、乙腈溶液300 μL,涡旋5 min,4 ℃,12 000 r/min,离心10 min,取上清液,0.22 μm 滤膜过滤,最终取上清液供UPLC-MS/MS分析。
2.3.3 血浆和胆汁样品的前处理 精密吸取血浆/胆汁样品200 μL,加入900 nmol/L 坎利酮溶液(IS)10 μL、乙酸乙酯溶液1 mL,涡旋5 min,4 ℃,12 000 r/min,离心10 min,取上清液900 μL,氮气吹干,以初始比例流动相30 μL 复溶,供UPLC-MS/MS分析。
2.3.4 分析方法 利用课题组已建立的快速UPLC-MS/MS 进行SSd 和SGG的定量测定[10]。色谱柱采用Eclipse Plus C18柱(2.1 mm × 100 mm,1.8 μm),流动相:0.01%甲酸水溶液(A 相)-甲醇(B 相),洗脱程序为0~4 min,75%B;4~6.5 min,80% B;6.5 ~ 7.5 min,75% B;流速:0.3 mL/min,柱温:45 ℃;待测物和内标的MRM 检测离子对为SSdm/z803.00 →331.00,SGGm/z455.00 →105.20,ISm/z341.15 →187.15。
2.4 统计分析
实验所有数据均采用均值±标准差(±s)表示,利用GraphPad Prism 9 软件应用非配对t检验或单因素方差分析(ANOVA)进行统计比较,以P<0.05为具有统计学意义。
3 结果和讨论
Caco-2细胞是人源结直肠腺癌细胞株,由其培养分化得到Caco-2 单层模型已被广泛用于药物体外吸收研究,但该模型存在一些缺陷,如缺少黏液层,转运蛋白和代谢酶的表达与小肠存在一定差异等[19]。而大鼠在体单向肠灌流可以维持血液和淋巴液的供应以及肠黏膜的完整性,因此被认为是体内研究的最佳模型,但是难以实现高通量筛选[20]。本研究采用两种模型相结合的方法,利用Caco-2单层模型做初步筛选研究,再利用大鼠在体单向肠灌流模型进行进一步验证。
3.1 基于Caco-2单层模型的研究结果
利用高、低渗透性标志物和细胞旁转运标志物对细胞单层通透性进行评估,普萘洛尔、呋塞米和荧光素的Papp分别为(13.28±0.90)×10-6cm/s、(0.45 ± 0.11)× 10-6cm/s 和(1.48 ± 0.06)× 10-6cm/s,均满足文献报道即普萘洛尔:3.30 × 10-6~41.90×10-6cm/s、呋塞米:0.04×10-6~1.00×10-6cm/s 和荧光素:<3.7×10-6cm/s的要求[10],表明本实验建立的Caco-2 单层模型可用于研究SSd的渗透性。
对转运实验结束供给侧、接收侧和细胞基质样品溶液中SGG的含量进行检测,结果发现其远低于方法的检测限,表明双向转运实验中SSd的代谢可以忽略不计。该结论通过对照组实验得到证实,SSd 在供给侧的减少可以排除是由药物降解引起的并且Transwell小室没有对SSd产生物理吸附。
根据Yang 等[15]报道的MTT 实验方法,确定SSd的适宜给药浓度(≤5 μmol/L)。由图1 可知,SSd的双向转运具有浓度和时间依赖性,转运速率与浓度呈线性关系(AP-BL 方向r2为0.97,BL-AP方向r2为0.99),符合药物一级吸收动力学原理。不同浓度SSd的双向转运参数如表1 所示。已有报道表明,当化合物的Papp<1×10-6cm/s、介于1×10-6~ 10 × 10-6cm/s 或者>10 × 10-6cm/s 时可以将其归分为吸收较差(0 ~ 20%)、中度程度吸收(20% ~ 70%)和吸收良好(70% ~ 100%)[21]。当ER <0.5、≈1 或>2 时,表明药物的转运过程可能分别涉及主动吸收、被动扩散或主动外排[22]。结合本实验结果可知,SSd的体内吸收较差,其吸收过程涉及主动转运。已知SSd的低口服生物利用度与肠道菌群和CYP450 酶对其的组合代谢相关[23],本实验结果表明,较差的跨膜吸收也可能是SSd体内暴露量低的原因之一。
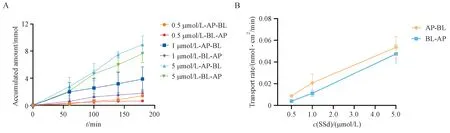
Figure 1 A:Transport kinetic of saikosaponin d(SSd)across Caco-2 monolayers in the AP-BL/BL-AP direction;B:Relationship between transport rate and SSd concentration(± s,n = 3)

Table 1 Transport parameters of SSd across Caco-2 monolayers (xˉ±s,n = 3)
研究AP 侧pH 对SSd 双向转运的影响,如图2-A 所示,随AP 侧pH 增大,SSd的Papp(AP-BL)逐渐降低(P>0.05)。当AP 侧pH 为7.4 时,细胞膜两侧不存在质子梯度,Papp(BL-AP)显著增加(P<0.000 1)。由于已经验证SSd 在不同pH的HBSS 溶液中保持稳定,推测质子依赖性转运蛋白OATP-B 可能参与SSd的转运。OATP-B 是位于小肠顶端膜的OATPs家族成员,研究表明OATP2B1 在酸性条件下活性较强[24]。因此推测当细胞膜两侧的pH 为7.4 时,OATP-B的转运活性减弱或受到抑制,导致药物跨膜吸收减少,该推论采用OATPs 抑制剂实验进一步得到证实(图2-C),柚皮苷明显抑制SSd的跨膜转运过程,然而,利福平未对其转运产生显著性影响。已有文献报道,柚皮苷可明显抑制OATP1A2/OATP2B1 的转运活性,利福平则对OATP1B1/OATP1B3表现出更明显的亲和力并以浓度依赖的方式抑制转运体的活性[25-26]。Caco-2 细胞表达的多种OATPs 转运体亚型中,OATP2B1 表达量最为丰富,而OATP1B1 和OATP1B3 的表达量较低[27],因此推测出现本实验结果的原因是利福平对OATPs 转运蛋白的特异性低或实验所用浓度未能有效抑制OATPs转运蛋白的活性。
除了高表达的OATPs 转运蛋白外,Caco-2 单层还高表达摄取转运蛋白OCTs 和外排转运蛋白P-gp、MRP2、BCRP 等[27],为了全面研究SSd的肠道吸收情况,对以上转运体也进行了研究。在四乙基氯化铵的作用下SSd的Papp(AP-BL)显著降低(P<0.05),普鲁卡因胺或四乙基氯化铵使Papp(BL-AP)显著降低(P<0.05),表明SSd的转运可能与OCTs相关(图2-C)。外排转运蛋白抑制剂对SSd跨膜转运的影响如图2-D 所示,维拉帕米显著增加了Papp(AP-BL)(P<0.000 1),而对Papp(BL-AP)未产生显著影响,SSd的流出比从0.49 降低至0.26,下降约46.9%,表明SSd的肠道吸收过程涉及P-gp 转运体[28]。对于AP-BL 方向转运,SSd 在AP 侧高表达的摄取转运体作用下进入细胞内,与维拉帕米竞争性结合P-gp的活性位点,导致通过P-gp 外排到AP 侧的SSd 含量降低,即AP-BL 转运显著增加;对于BL-AP 方向转运,BL 侧只表达极少量的摄取转运体,SSd的转运可能以易化扩散或被动扩散为主,维拉帕米竞争性结合P-gp的活性位点对SSd的转运未产生显著影响。MRP2 的特异性抑制剂MK571 对SSd的双向转运没有显著影响。在Ko143的作用下,Papp(BL-AP)显著增加(P<0.001),但是转运结束时TEER <300 Ω·cm2表明此时细胞单层的完整性被破坏。根据上述结果可知,SSd 可能是P-gp 和OCTs的底物。TEER的大小与细胞旁通路途径相关,为进一步探究SSd的转运是否与该途径相关,设置了SSd 与EDTA 共同给药组。EDTA可通过去除Ca2+破坏细胞骨架组织和上皮紧密连接的完整性从而增强肠道细胞旁通透性[16]。在EDTA 作用下,SSd的Papp(AP-BL)和Papp(BL-AP)均显著增加(P<0.01)(图2-B),证明细胞旁通路途径确实参与了SSd的吸收过程。
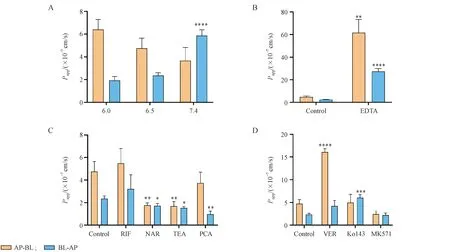
Figure 2 A: Effect of apical pH on the transport of SSd across Caco-2 monolayers (****P <0.000 1 vs pH 6.5 group); B: Effect of the paracellular pathway enhancer EDTA on the transport of SSd across Caco-2 monolayers; C: Effect of the OATPs inhibitors: rifampicin (RIF), naringin (NAR); the OCTs inhibitors: tetraethylammonium chloride (TEA), procainamide (PCA) on the transport of SSd across Caco-2 monolayers; D: Effect of the efflux transporters inhibitors:verapamil(VER),Ko143,MK571 on the transport of SSd across Caco-2 monolayers(± s,n = 3)*P <0.05, **P <0.01, ***P <0.001, ****P <0.000 1 vs control group
在4 ℃下进行SSd的转运研究,将结果与之前的37 ℃,无抑制剂时SSd的转运实验结果进行比较,以评估其他可能的主动转运机制,结果发现SSd的Papp(AP-BL)从(4.75 ± 0.89)× 10-7cm/s 显著降低至(1.62 ± 0.30)× 10-7cm/s(P<0.01),表明主动摄取在SSd转运过程中发挥重要作用。
3.2 基于大鼠在体单向肠灌流模型的研究结果
利用大鼠在体单向肠灌流模型研究SSd 在不同肠段的通透性,Peff和Ka测定结果表明各肠段对SSd的吸收能力强弱依次为回肠>空肠>十二指肠(表2)。流出口灌流液中SGG的浓度低于方法的检测限,表明SSd在整个实验过程中未代谢转化为SGG。此外,在收集的血浆和胆汁样品中检测到大量SSd,说明灌流液中SSd的减少不是由于其在肠组织中堆积或者被困在肠黏膜中,而是已被吸收进入体循环(图3)。
Table 2 Absorption parameters of SSd in different segments of rat intestine(± s,n = 4)

Table 2 Absorption parameters of SSd in different segments of rat intestine(± s,n = 4)
Segment Duodenum Jejunum Ileum Peff(×10-4 cm/s)0.10±0.04 0.19±0.08 0.51±0.04 Ka(×10-4 s-1)1.47±0.97 4.43±1.77 9.07±1.54
已有研究表明,药物在Caco-2单层与体内空肠的渗透结果具有高度相关性,且药物的吸收主要发生在小肠上半段,因此采用空肠进行后续研究[29]。如表3所示,不同浓度SSd的Peff和Ka不存在显著性差异(P>0.05),表明SSd的肠吸收在所测试的浓度范围内未出现饱和。据报道,当药物Peff<0.5×10-4cm/s 时,表明该化合物体内渗透性较低[30]。该实验结论与Caco-2单层模型实验结论一致。
以Caco-2 单层模型实验结果为依据,选取具有显著抑制活性的转运体抑制剂用于大鼠在体单向肠灌流研究,结果如图4 所示,维拉帕米、EDTA或DNP 分别使Peff显著性增大8.4、5.6 和10.6 倍(P<0.05),表明SSd 是P-gp的底物,其转运过程包括细胞旁通路途径和能量依赖性的主动转运。DNP 是一种代谢酶抑制剂,通过减少ATP的产生发挥抑制代谢的作用,而P-gp 是Caco-2 单层中表达量最高的ATP 结合盒(ABC)转运蛋白之一,所以推测DNP的加入可能抑制了P-gp的活性[18]。柚皮苷和四乙基氯化铵可以显著抑制SSd 跨Caco-2单层的转运,但并未对SSd的在体肠吸收造成显著影响。柚皮苷与OATP2B1 和OATP1A2 的亲和力较高,这两种OATPs 亚型在大鼠肠道中的同源蛋白分别为Oatp2b1 和Oatp1a5,且分别在大鼠结肠和回肠中高表达[24,31];四乙基氯化铵与OCT1 和OCT2 的亲和力较高,这两种OCTs 亚型在大鼠肠道中的同源蛋白分别为Oct1 和Oct2,但Oct1 在空肠中的表达低于回肠,Oct2 在空肠和回肠中的表达几乎相同且都很低[24,32]。因此,推测上述转运体在大鼠空肠中低表达是造成柚皮苷和四乙基氯化铵对SSd体内外肠吸收的影响存在差异的原因。
4 结 论
本实验采用Caco-2 单层和大鼠在体单向肠灌流模型系统地研究了SSd的肠道吸收机制,为深入了解其肠道吸收过程、药效机制研究、潜在的药物-药物相互作用和新药开发等提供了参考依据。体内外研究结果提示SSd的跨膜渗透性较低,在所研究浓度范围内,SSd的吸收未出现饱和现象,吸收速率和转运量具有时间和浓度依赖性。抑制剂实验表明SSd的转运过程涉及P-gp 介导的主动转运和细胞旁通路途径等。针对OATPs 转运体和OCTs 转运体的体内外研究结果差异,有待从基因水平或蛋白质水平对空肠中这两类转运体的表达量及蛋白活性进行评估,以验证在体单向肠灌流的结果推测。此外,对本研究筛选出的参与SSd肠道吸收的特异性转运体P-gp 可采用转染细胞技术或基因敲除动物进行进一步验证。

Figure 3 MRM chromatograms of biological samples
Table 3 Absorption parameters of different concentrations about SSd in jejunum(± s,n = 4)

Table 3 Absorption parameters of different concentrations about SSd in jejunum(± s,n = 4)
c/(μmol/L)40 80 120 Peff(×10-4 cm/s)0.24±0.28 0.19±0.08 0.27±0.10 Ka(×10-4 s-1)3.18±0.74 4.43±1.77 3.21±2.01

Figure 4 Effect of inhibitors, paracellular permeability enhancer and metabolic inhibitor on the absorption parameters of SSd in situ single pass intestinal perfusion via jejunum(± s,n = 4)*P <0.05, **P<0.01, ***P <0.001 vs control group
