血浆外泌体miR-214-3p作为葡萄膜黑色素瘤诊断及预后评估生物标志物的研究
2022-09-07周文达邵蕾董力史绪晗张瑞恒李赫妍吴昊天魏文斌
周文达 邵蕾 董力 史绪晗 张瑞恒 李赫妍 吴昊天 魏文斌
首都医科大学附属北京同仁医院 北京同仁眼科中心 眼内肿瘤诊治研究北京市重点实验室 北京市眼科学与视觉科学重点实验室 医学人工智能研究与验证工信部重点实验室,北京100730
葡萄膜黑色素瘤(uveal melanoma,UM)是成人眼内常见的恶性肿瘤,临床工作中主要依靠有经验的眼科医生采用检眼镜联合眼部超声、头颅MRI等影像学检查来确诊[1-2],缺乏客观量化指标,术后组织病理学检查仍然是诊断UM的金标准。虽然病理诊断的准确性高,但需要摘除眼球,对患者创伤大,而且随着巩膜外放射敷贴等局部治疗方法的出现,大多数患者已经不需要行眼球摘除术,限制了病理学诊断方法的应用。因此寻找一种无创、简便并且可以量化的新型UM诊断指标具有重要意义。UM有发生血源性远处转移的倾向,即使对眼内原发病灶进行治疗,也有超过50%的患者会发生全身转移[3-4],而已经发生转移的UM尚缺乏有效的治疗方法[5],尽早对高风险的UM进行治疗可能会减少转移风险[6],因此早期对UM的预后进行评估具有重要意义。微小RNA(microRNA,miRNA)是一种长度为20~24个核苷酸的非编码单链小分子RNA,其可促进或抑制靶向mRNA的表达,在大多数肿瘤的发生和发展过程中扮演重要角色[7]。许多分泌型miRNA在不同类型肿瘤患者的体液中被发现,如血浆、唾液、尿液、泪液等,肿瘤源性的miRNA可以稳定存在于患者血液中,是一种理想的生物标志物[8]。本课题组先前的研究发现了多个有望成为UM诊断及预后评估生物标志物的miRNA,如血浆miR-199a-3p对UM诊断的效能最强,血浆miR-21-5p、miR-214-3p等具有成为UM诊断和预后评估分子标志物的潜力[9]。MiRNA的分子生物学通路比较复杂,同一miRNA可以拥有多个靶标,关于miR-21-5p的分子生物学机制研究比较全面,其在胃癌、肺癌和结肠癌中均发挥了促进癌症发生和发展的作用[10-12]。目前的研究显示其在UM中也发挥促癌作用[13],其分子通路可能是抑制p53基因表达,进而增加LASP1蛋白表达,促进UM的增生与侵袭[14]。与miR-21-5p不同,除本课题组外,目前尚无miR-214-3p在UM发生和发展中作用的研究,本课题组之前的研究显示miR-214-3p在UM肿瘤组织中显著下降[15],血浆miR-214-3p在UM患者中也显著下降,这提示miR-214-3p可能在UM中发挥抑癌作用。但我们比较不同类型UM患者的血浆miR-214-3p水平后发现,虽然梭形细胞型UM和类上皮细胞型UM患者的血浆miR-214-3p水平均显著下降,但梭形细胞型UM患者下降更明显,这似乎又对miR-214-3p在UM中的机制提出了新的疑问。外泌体是一种直径为40~100 nm的细胞外囊泡,由真核细胞主动分泌,其存在于包括血浆在内的几乎所有体液中[16-18]。本研究选择miR-214-3p作为候选miRNA,测定其在UM患者血浆外泌体中的表达水平,拟探讨其作为UM生物标志物的潜力,并为其在UM中作用机制研究提供新思路。
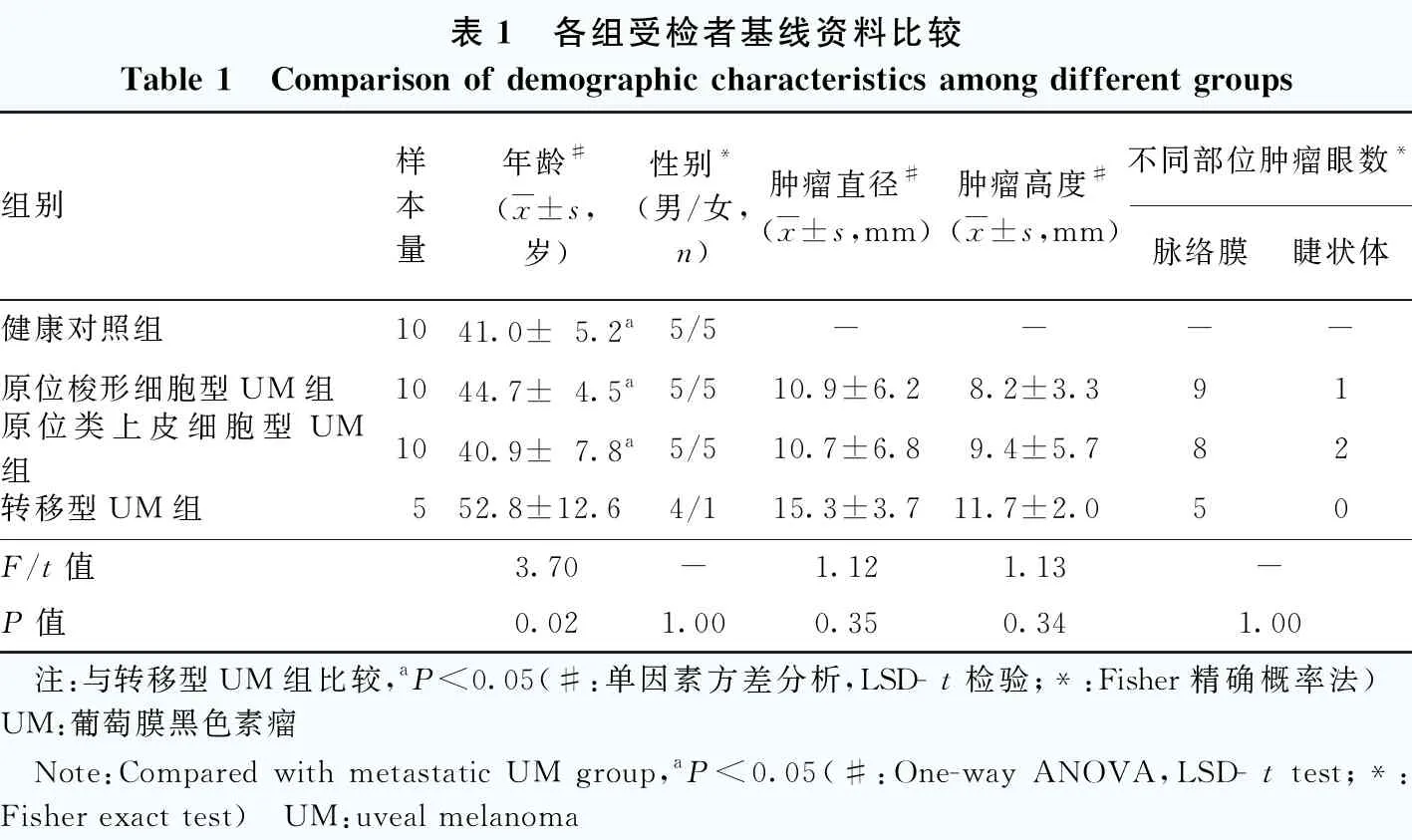
表1 各组受检者基线资料比较Table 1 Comparison of demographic characteristics among different groups组别样本量年龄#(x±s,岁)性别*(男/女,n)肿瘤直径#(x±s,mm)肿瘤高度#(x±s,mm)不同部位肿瘤眼数*脉络膜睫状体健康对照组1041.0±5.2a5/5----原位梭形细胞型UM组1044.7±4.5a5/510.9±6.28.2±3.391原位类上皮细胞型UM组1040.9±7.8a5/510.7±6.89.4±5.782转移型UM组552.8±12.64/115.3±3.711.7±2.050F/t值3.70-1.121.13-P值0.021.000.350.341.00 注:与转移型UM组比较,aP<0.05(#:单因素方差分析,LSD- t检验;*:Fisher精确概率法) UM:葡萄膜黑色素瘤 Note:Compared with metastatic UM group,aP<0.05(#:One-way ANOVA,LSD- t test;*:Fisher exact test) UM:uveal melanoma
1 资料与方法
1.1 一般资料
采用横断面研究方法,收集2015年12月至2019年10月于北京同仁医院行眼球摘除术并确诊为UM的患者25例,其中原位梭形细胞型UM组和原位类上皮细胞型UM组各10例,转移型UM组5例(包括1例梭形细胞型UM患者和4例类上皮细胞型UM患者);同期收集10名健康对照者作为健康对照组。所有健康对照者均确认无肿瘤病史及长期服用药物史。4个组患者年龄比较差异有统计学意义(F=3.70,P<0.05),其中转移型UM组年龄明显大于其他3个组,差异均有统计学意义(均P<0.05)。4个组间患者性别比例比较差异无统计学意义(P=1.00);原位梭形细胞型UM组、原位类上皮细胞型UM组和转移型UM组肿瘤直径、肿瘤高度比较差异均无统计学意义(F=1.12,P=0.35;F=1.13,P=0.34);多数病例肿瘤均位于脉络膜,3个组间不同部位肿瘤的眼数分布比较差异无统计学意义(P=1.00);3个组肿瘤均未侵犯到巩膜外(表1)。所有肿瘤患者及健康对照者均知晓研究目的和方法并自愿签署知情同意书,本研究方案经首都医科大学伦理委员会审查批准(批文号:TRECKY2018-056)。
1.2 方法
1.2.1血浆标本采集及处理 UM患者所有血液样本均在确诊后未行任何治疗时采集。抽取患者和健康对照者空腹静脉血,将血液样本置于真空管中,常温下静置30 min,台式低速离心机(80-2型,上海医疗器械股份有限公司)离心半径10 cm,4 ℃下1 200 r/min离心15 min,收集血浆样本置于-80 ℃保存供后续试验使用。纳入患者抽取血液样本后均于北京同仁医院行眼球摘除术,摘除眼球样本由北京同仁医院眼科病理室行组织病理学检查,明确肿瘤的组织病理学类型、位置、肿瘤高度、最大直径及局部侵袭范围。
1.2.2血浆外泌体的提取 37 ℃速融血浆样本并移至新的离心管,用超速离心机CP100MX(日本日立有限公司)在4 ℃下2 000×g离心30 min;将上清液移至新的离心管,10 000×g再次离心45 min,以去除较大囊泡,取上清,经0.45 μm滤膜过滤,收集过滤液。将过滤液移至新的离心管,选择超速转子,100 000×g离心70 min,去除上清,用10 ml预冷的1倍磷酸盐缓冲液(phosphate buffered saline,PBS)重悬后,再次离心70 min,去除上清,用150 μl预冷1倍PBS重悬。外泌体于-80 ℃保存。
1.2.3透射电子显微镜下观察外泌体形态 从健康对照组、原位梭形细胞型UM组、原位类上皮细胞型UM组以及转移型UM组中随机抽取1例受试者的外泌体样本行透射电子显微镜(HT-7700型,日本日立有限公司)观察。吸取样品10 μl滴加于铜网上沉淀1 min,滤纸吸去浮液。醋酸双氧铀10 μl滴加于铜网上沉淀1 min,滤纸吸去浮液。常温干燥数分钟。100 kV进行电子显微镜检测成像。
1.2.4外泌体粒径分析 从健康对照组、原位梭形细胞型UM组、原位类上皮细胞型UM组以及转移型UM组中随机抽取2例受试者,取外泌体样本10 μl,用PBS稀释至30 μl,采用粒径分析仪N30E(厦门福流生物科技有限公司)进行外泌体粒径分析。在外泌体样品上样前,先用标准品进行仪器性能测试,合格后上样,获得仪器检测外泌体的粒径和浓度信息。
1.2.5Western blot法鉴定外泌体标记蛋白 从健康对照组、原位梭形细胞型UM组、原位类上皮细胞型UM组以及转移型UM组中随机抽取2例受试者,提取外泌体蛋白,在37 ℃中速融外泌体,并迅速加入6倍RIPA裂解液,混匀后在冰上裂解30 min,期间混匀,BCA法测定蛋白浓度,蛋白变性,SDS PAGE凝胶电泳,80 V跑胶至样品跑出浓缩胶,转100 V跑胶至溴酚蓝至胶底部,电泳完毕后取出电泳胶,将蛋白转印至PVDF膜,将膜按蛋白面朝上浸泡于质量分数5 %脱脂牛奶TBST中封闭1 h。将膜浸泡于配制好的TSG101(ab125011)及Calnexin(ab22595)一抗溶液[抗体稀释比例均为1∶ 1 000,艾博抗(上海)贸易有限公司]中,4 ℃孵育过夜,洗膜后在相应二抗(稀释比例1∶ 5 000)溶液中室温孵育约1 h,洗膜后将ECL发光液滴加到膜上避光反应5 min,采用化学发光凝胶成像系统ChemiScope 3000mini(上海勤翔科学仪器有限公司)曝光,保存图片。
1.2.6血浆外泌体RNA的提取 取各组受试者血浆外泌体于EP管中,加入900 μl裂解液MZA,剧烈振荡30 s,室温放置5 min,使核酸蛋白复合物完全分离;加入氯仿0.2 ml,剧烈震荡15 s,室温放置5 min,离心半径10 cm,12 000 r/min离心10 min,将水相转移至新管,加入2倍体积无水乙醇,混匀后加入吸附柱,静置2 min,12 000 r/min离心1 min,弃废液;加700 μl MRD去蛋白液于吸附柱中,静置2 min,12 000 r/min离心1 min,弃废液;向吸附柱中加入500 μl漂洗液RW,静置2 min,12 000 r/min离心1 min,弃废液,重复上述步骤;12 000 r/min离心2 min,弃掉收集管,放置吸附柱10 min,将吸附柱中残余的漂洗液去除;将吸附柱放入新管中,向膜中央滴加15 μl RNase Free ddH2O,室温放置5 min,12 000 r/min,离心2 min,得到RNA。
1.2.7实时荧光定量PCR法检测血浆外泌体miR-214-3p表达水平 以11 μl模板RNA为基础,以U6作为内参基因,配置15 μl残存基因组DNA去除体系孵育后使用通用逆转录试剂盒(11141ES60)[中国翊圣生物科技(上海)股份有限公司]获取模板cDNA,随后配置实时荧光定量PCR反应体系,包括实时PCR荧光定量试剂盒(11201ES08)[中国翊圣生物科技(上海)股份有限公司]试剂10 μl,引物1 μl,模板cDNA 5 μl,加无菌超纯水至20 μl。引物序列见表2。使用实时荧光定量PCR仪MA-6000(苏州雅睿生物技术股份有限公司),95 ℃下预变性5 min;95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸20 s,共40个循环。所有反应分样进行3次。采用2-ΔΔct法计算miRNAs相对表达水平。

表2 逆转录及实时荧光定量PCR引物序列Table 2 Primer sequences for reverse transcription andreal-time fluorescence quantitative PCR引物引物序列逆转录 miR-214-3p5'-GTCGTATCCAGTGCGTGTCGTG-GAGTCGGCAATTGCACTGGATACGACACTGCCTG-3' U65'-AACGCTTCACGAATTTGCGT-3'实时荧光定量PCR miR-214-3p正向:5'-ACAGCAGGCACAGACAGG-3'反向:5'-CAGTGCGTGTCGTGGAGT-3' U6正向:5'-CTCGCTTCGGCAGCACA-3'反向:5'-AACGCTTCACGAATTTGCGT-3' 注:PCR:聚合酶链式反应;miR:微小RNA Note:PCR:polymerase chain reaction;miR:microRNA
1.3 统计学方法

2 结果
2.1 血浆外泌体的鉴定
透射电子显微镜观察结果显示,所提取外泌体外形呈一侧凹陷的半球形结构,直径约100 nm。所有样本的囊泡粒径分布符合外泌体粒径范围,所有样本平均粒径大小为(82.0±2.7)nm。Western blot结果显示,外泌体特异性标记蛋白TSG101条带均为阳性,阴性标记蛋白Calnexin均呈阴性(图1)。
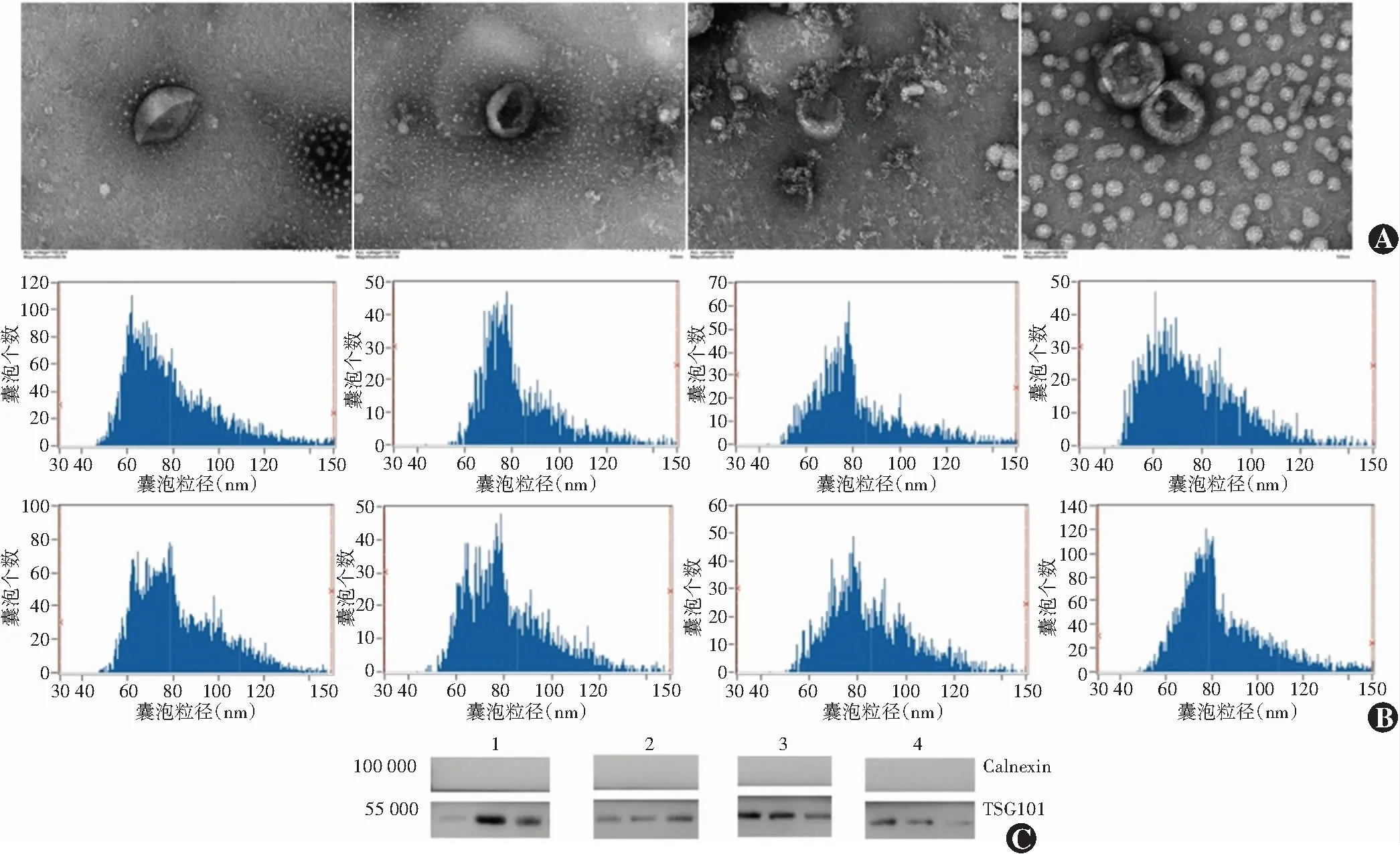
图1 血浆外泌体的鉴定 A:透射电子显微镜观察(×60 000,标尽=100 nm) 可见4个样本囊泡形态均完整,呈一侧凹陷的半球形外观,直径约100 nm B:粒径分析 8个样本囊泡的平均粒径均在79~84 nm C:Western blot检测 所有样本中外泌体标志蛋白TSG101显示条带,外泌体阴性标志蛋白Calnexin均未显示条带 1:健康对照组;2:原位梭形细胞型UM组;3:原位类上皮细胞型UM组;4:转移型UM组
2.2 各组血浆外泌体miR-214-3p相对表达量比较
健康对照组、原位梭形细胞型UM组、原位类上皮细胞型UM组和转移型UM组血浆外泌体miR-214-3p相对表达量总体比较,差异有统计学意义(H=9.93,P=0.02),其中健康对照组miR-214-3p相对表达量均高于其他3个组,差异均有统计学意义(均P<0.05)(表3)。
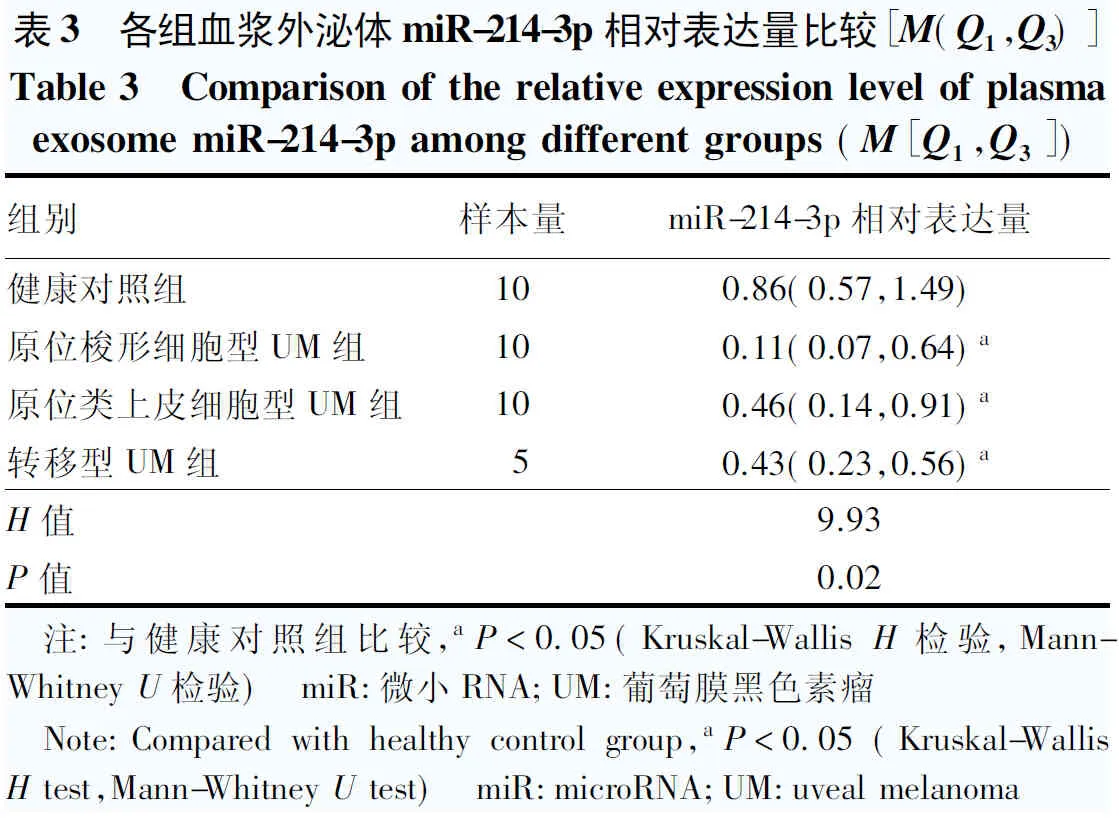
表3 各组血浆外泌体miR-214-3p相对表达量比较[M(Q1,Q3)]Table 3 Comparison of the relative expression level of plasmaexosome miR-214-3p among different groups (M[Q1,Q3])组别样本量miR-214-3p相对表达量健康对照组100.86(0.57,1.49)原位梭形细胞型UM组100.11(0.07,0.64)a原位类上皮细胞型UM组100.46(0.14,0.91)a转移型UM组50.43(0.23,0.56)aH值9.93P值0.02 注:与健康对照组比较,aP<0.05(Kruskal-Wallis H检验,Mann-Whitney U检验) miR:微小RNA;UM:葡萄膜黑色素瘤 Note:Compared with healthy control group,aP<0.05 (Kruskal-Wallis H test,Mann-Whitney U test) miR:microRNA;UM:uveal melanoma
2.2.1血浆外泌体miR-214-3p对UM的诊断效能 原位UM组(包括原位梭形细胞型UM组和原位类上皮细胞型UM组患者)血浆外泌体中miR-214-3p相对表达水平为0.24(0.10,0.67),较健康对照组的0.86(0.57,1.49)明显降低,差异有统计学意义(Z=2.62,P<0.01)。使用ROC曲线对血浆外泌体miR-214-3p的诊断效能进一步分析,结果显示血浆外泌体miR-214-3p的AUC为0.795(图2)。进一步比较结果显示,转移型UM组血浆外泌体miR-214-3p的相对表达量明显低于健康对照组,差异有统计学意义(Z=2.08,P<0.05)。

图2 ROC曲线评估血浆外泌体miR-214-3p对UM的诊断效能 AUC:曲线下面积
2.2.2血浆外泌体miR-214-3p对UM的预后评估效能 原位梭形细胞型UM组和原位类上皮细胞型UM组血浆外泌体miR-214-3p的相对表达量差异无统计学意义(Z=1.66,P=0.09)。进一步对比转移型UM组和原位类上皮细胞型UM组血浆外泌体miR-214-3p表达水平,结果显示2个组间差异亦无统计学意义(Z=0.84,P=0.80)。
3 讨论
MiRNA作为一种非编码RNA,通过负向调节特定mRNA来发挥生物学作用,参与多种细胞功能的调节,与包括癌症在内的多种疾病的发生和发展有关[19]。MiRNA除了存在于细胞质中,还分布于包括血液在内的所有体液中,这种存在于血液中的miRNA称为循环miRNA,其能够稳定存在于血浆中,是一种极具潜力的生物标志物[20]。循环miRNA存在的形式主要包括与蛋白结合形成核酸蛋白复合体,与脂蛋白结合形成脂蛋白核酸复合体以及存在于以外泌体为代表的细胞外囊泡中[21-23]。外泌体中的miRNA由囊膜包裹,可以稳定存在于血液中,避免被核酸酶分解,有望成为一种新型、无创、可以量化的肿瘤生物标志物。此外,外泌体由肿瘤细胞主动分装并分泌,参与细胞间信息传导,影响肿瘤细胞生长微环境,对肿瘤的发生和发展起到重要作用[18]。研究外泌体miRNA的差异表达对肿瘤的分子生物机制研究同样有重要价值。
在先前的研究中,miR-214-3p含量在梭形细胞型和原位类上皮细胞型UM肿瘤组织中较正常葡萄膜组织均显著下降,但在不同类型的UM肿瘤组织间无显著差异[15]。但miR-214-3p在UM患者的血浆中显著下降,其对UM的诊断效能为0.775,原位梭形细胞型UM患者血浆中miR-214-3p下降较原位类上皮细胞型UM患者更加明显,血浆miR-214-3p对UM病理类型的鉴别效能可达0.930[9]。本研究基于课题组先前的研究,选定miR-214-3p作为候选miRNA,进一步验证了其在血浆外泌体中的表达水平。
本研究结果显示,miR-214-3p在UM患者的血浆外泌体中显著下降,而且血浆外泌体miR-214-3p的诊断效能高于血浆miR-214-3p,这与我们先前的研究结果相符[9]。相比于血浆miRNA,外泌体miRNA能够更好地抵抗核酸酶的分解,稳定性更强,此外由于其为细胞主动分泌,可以防止来自人体其他细胞裂解过程中被动进入循环的miRNA混淆。因此,外泌体miRNA是一种更加理想的生物标志物。本研究也证实了外泌体miR-214-3p具有更好的诊断效能,为循环miR-214-3p在UM临床诊断上的应用提供了基础。
UM的组织病理学主要分为梭形细胞型、混合细胞型及类上皮细胞型3种,本研究根据病理类型分组,分为预后较好的梭形细胞型UM及预后较差的类上皮细胞型UM,探讨了外泌体miR-214-3p与预后的关系。
本课题组先前的研究显示,血浆miR-214-3p在类上皮细胞型UM患者中表达水平显著高于梭形细胞型UM患者[9]。有研究认为,在细胞中起到抑癌作用的miRNA会被选择性地分泌到肿瘤细胞外,以抑制肿瘤细胞增生[24]。基于miR-214-3p在多种肿瘤的发生和发展过程中起到抑癌作用[25-26],推测类上皮细胞型UM细胞主动分泌miR-214-3p的能力强于梭形细胞型UM细胞,从而抑制肿瘤细胞的增生发育。本研究结果显示,外泌体miR-214-3p的表达水平在2种不同病理类型UM患者的血液中差异无统计学意义,这一结果与本课题组先前在肿瘤组织中的验证结果一致,即不同病理类型间miR-214-3p的表达水平无明显差异。实际上循环miRNA的主要来源是血细胞,而且在肿瘤患者的血液中,免疫系统来源的miRNA也占很大比例,其不一定完全反映肿瘤组织miRNA的表达水平[24],但外泌体由细胞主动分泌,理论上其特异性要高于血浆miRNA[27]。同一miRNA作用的靶标mRNA通常有上百个,miR-214-3p不仅参与肿瘤的发生和发展,也参与炎症等其他病理生理过程[28-29],血浆miRNA中的差异可能是由于其他细胞来源的miR-214-3p干扰导致,循环miR-214-3p与UM预后可能无关。本研究结果显示,转移型UM患者的血浆外泌体miR-21-5p表达水平较正常对照组显著下降,但与原位类上皮细胞型UM间差异无统计学意义。再次证明循环外泌体miR-21-5p可能对UM患者的预后缺乏评估能力。需要明确的是,除了外泌体miRNA,细胞也能主动分泌以蛋白核酸复合物和脂蛋白核酸复合物形式存在的miRNA,参与生理病理过程的调节[21-22],本研究结果并不能完全否定血浆miR-214-3p对UM预后的评估能力。
本研究测定了不同病理类型UM患者的循环miR-214-3p表达水平,发现其具有成为UM早期诊断分子生物学标志物的潜力,但其对UM的预后评估能力仍需进一步验证。此外,循环miRNA作为重要的细胞间通讯手段,对于UM发生和发展机制的研究也具有重要意义。现已经发现miR-214-3p在多种肿瘤中具有抑癌作用,但也有研究发现其可促进肿瘤的进展[25-26,30-32]。基于本研究结果,miR-214-3p可能在UM中发挥抑癌作用,其在肿瘤细胞内及细胞外的降低可能是UM发生的机制之一,这也为UM的治疗提供了潜在的靶点。本研究主要收集患者的血浆样本,未对患者预后进行长期随访,有限的随访时间内无患者出现终点事件,无法进一步进行生存分析。此外,未对患者治疗后的循环miR-214-3p表达水平进一步分析,且纳入样本量相对较小,未来仍需要在多样本、多中心、包含不同种族的队列中进一步研究验证循环miR-214-3p对UM诊断及预后的评估能力。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明周文达:直接参与选题、酝酿和设计试验、实施研究、采集数据、分析/解释数据、起草文章;邵蕾、董力:直接参与选题、酝酿和设计试验、实施研究、采集数据、分析/解释数据;史绪晗、张瑞恒、李赫妍、吴昊天:实施研究、采集数据、分析/解释数据;魏文斌:直接参与选题、酝酿和设计试验、对文章知识性内容的审阅和智力性内容的修改及定稿
