miR-31-5p过表达对兔自身免疫性干眼外周血Th17细胞的免疫调控作用
2022-09-07高敏赵璐陈思思魏瑞华粘红
高敏 赵璐 陈思思 魏瑞华 粘红
天津医科大学眼科医院 天津医科大学眼视光学院 天津医科大学眼科研究所 国家眼耳鼻喉疾病临床医学研究中心天津市分中心 天津市视网膜功能与疾病重点实验室,天津 300384
干燥综合征(Sjögren syndrome,SS)相关干眼是常见的自身免疫性干眼,严重者可继发角膜溃疡,造成视力损伤[1]。由于SS发病机制尚未完全明确,临床上仍缺乏有效的治疗方案[2-3]。辅助性T细胞17(T helper cell 17,Th17)是自身免疫性干眼中关键的致炎细胞群[4],研究发现Th17细胞在SS患者外周血中比例上调,并且与SS疾病活动指数ESSDAI密切相关[5]。多项研究证实微小RNA(microRNA,miRNA)参与调控Th17细胞免疫反应,进而影响自身免疫性疾病的发生和发展[6]。miR-31-5p是一种进化高度保守的miRNA,在多种自身免疫性疾病中发挥免疫调控作用。研究表明miR-31可通过促进T细胞中白细胞介素2(interleukin-2,IL-2)的异常表达参与系统性红斑狼疮的发病[7],或通过抑制Gprc5a影响调节性T细胞的分化,促进实验性自身免疫性脑脊髓炎的炎症反应[8];但其在自身免疫性干眼中的调控作用及机制尚不明确。本课题组前期研究结果表明,miR-31-5p在兔自身免疫性干眼模型泪腺以及外周血单个核细胞(peripheral blood mononuclear cell,PBMC)中表达显著下调[9]。本研究进一步探讨miR-31-5p对兔自身免疫性干眼模型外周血Th17细胞的免疫调控作用。
1 材料与方法
1.1 材料
1.1.1实验动物 选用SPF级成年雌性新西兰大白兔4只,体质量为2.5~3.0 kg(北京维通利华实验动物技术有限公司提供),实验前排除眼部炎症及其他异常。实验动物的使用及喂养严格遵循国家科学技术委员会颁布的《实验动物管理条例》,研究方案通过天津医科大学眼科医院伦理委员会审批(批文号:TJYY20201221036)。
1.1.2主要试剂及仪器 慢病毒包装细胞人胚肾293T细胞株(美国ATCC细胞库);辅助包装质粒pSPAX2和pMD2.G,LipoFiterTM(上海汉恒生物有限公司);大肠杆菌菌株DH5α(美国Invitrogen公司);Ⅰ型胶原酶、DMEM培养基、RPMI-1640培养基、胎牛血清、胰蛋白酶、聚乙二醇8000(美国Gibco公司);Ficoll粉(美国Sigma公司);淋巴细胞分离液(美国GE公司);RNA提取试剂盒(美国ZScience Biotechnology公司);限制性内切酶、T4连接酶、逆转录试剂盒、SYBR Green 2倍Master Mix(美国Thermo公司);无内毒素质粒抽提试剂盒、BCA蛋白定量试剂盒(北京康为世纪有限公司);小鼠抗兔IL-17抗体(MAA063Rb21,美国Cloud-Clone公司);鼠抗兔β-actin抗体(TA-09,北京中杉金桥生物技术有限公司);马抗小鼠IgG二抗(7076s,美国Cell Signaling Technology公司)。BioSpectrum410凝胶成像仪(美国UVP公司);BX53型光学显微镜(日本Olympus公司);Light Cycler PCR仪(瑞士Roche公司)。
1.2 方法
1.2.1miR-31-5p过表达慢病毒载体的构建及鉴定 根据GeneBank提供的miR-31-5p前体序列设计引物,并在其中引入Xho I酶切位点,正向引物序列:5'-TGTGGAGAGGAGGCAAGATGCTGGC-3';反向引物序列:5'-CCGCTCGAGAAAAAAAAGATGGCAATATGTTG GC-3'(下划线标注部分为酶切位点)。以兔脾脏cDNA为模板行PCR扩增miR-31-5p前体序列,反应体系为:cDNA模板1.0 μl,正向引物和反向引物各0.6 μl,2倍pfu PCR mix 5.0 μl,超纯水2.8 μl。PCR反应条件:94 ℃预变性3 min,94 ℃变性30 s,64.3 ℃退火30 s,72 ℃延伸45 s,连续进行35个循环;72 ℃保温5 min。PCR产物经琼脂糖凝胶电泳鉴定后纯化。慢病毒空载体pLL3.7经Xho I和Hpa I双酶切,目的片段经Xho I单酶切后琼脂糖凝胶电泳纯化,用T4连接酶将酶切后载体和目的片段进行连接反应。取10 μl连接产物转化入DH5α感受态细菌,在含氨苄抗性的LB培养基中37 ℃培养过夜。次日挑取单克隆菌落,37 ℃、250 r/min摇菌16 h后进行菌液PCR鉴定,提取阳性克隆菌中质粒送至上海生工生物工程技术服务有限公司进行测序。
1.2.2三质粒共转染293T细胞行慢病毒包装 将质粒进行高纯度无内毒素抽提,转染前一天将培养至生长对数期、状态良好的293T细胞用胰蛋白酶消化并接种于100 mm培养皿中,次日待细胞融合密度达70%~80%时用于慢病毒包装。转染时,取2支灭菌离心管,将重组载体质粒分别与包装质粒遵循摩尔比1∶ 1∶ 1混合(pSPAX2、pMD2.G、pLL3.7/pLL3.7-miR-31-5p,共24 μg),另取DMEM基础培养基与LipoFiterTM(30 μl)混合并于室温孵育5 min。将质粒混合溶液与LipoFiterTM溶液混合均匀,室温孵育20 min后共转染293T细胞。6 h后移去混合液并更换为含体积分数10%胎牛血清(fetal bovine serum,FBS)的完全培养基。于转染后48 h及72 h收集细胞上清,离心半径16.8 cm,4 ℃条件下3 000 r/min离心15 min,去除细胞碎片,0.45 μm过滤器过滤上清液后加入5倍聚乙二醇8000 NaCl母液,4 ℃摇床过夜。次日6 500×g离心20 min,1640基础培养基重悬沉淀并取EP管分装,-80 ℃储存。
1.2.3miR-31-5p重组慢病毒滴度检测 将对数生长期状态良好的293T细胞用胰蛋白酶消化法计数,按每孔1×104个细胞接种于96孔板(总体积为100 μl)。次日细胞融合达30%~50%,取10个无菌EP管分别加入90 μl含10% FBS的完全培养基,将10 μl重组慢病毒原液加入第1个EP管中,混合均匀后吸取10 μl加入第2个EP管中,重复操作直至最后1个EP管。移去孔中培养基,将梯度稀释的病毒加入293T细胞中并孵育24 h,加入100 μl完全培养基继续培养48 h,于荧光显微镜下观察荧光表达情况。对荧光比例为20%~40%的孔进行细胞计数并通过流式细胞仪检测荧光表达比例,计算病毒原液滴度:滴度(TU/ml)=细胞数×荧光百分比×103/病毒原液体积(μl)。
1.2.4自身免疫性兔干眼模型的建立 参照前期研究方法[10-11],分离提纯兔泪腺上皮细胞及PBMC,构建细胞混合培养体系。将实验兔全身麻醉后摘取左下泪腺,分离并提纯泪腺上皮细胞,进行细胞计数并以1×106/孔细胞接种于24孔板,置于37 ℃、体积分数5% CO2培养箱中培养48 h,25 Gy γ射线照射去除其增生能力,保留抗原提呈功能。利用静脉采血针于兔耳中动脉采血,磷酸盐缓冲液(phosphate buffer saline,PBS)稀释4倍后缓慢加到淋巴细胞分离液上方,20 ℃条件下2 000 r/min离心20 min,离心后吸取中间白色云雾状单个核细胞,进行细胞计数并以相同的密度(1×106/孔)与经γ射线照射的泪腺上皮细胞混合培养。混合培养5 d后,收集激活的淋巴细胞,用PBS配制成2×106/ml细胞悬液1 ml,经耳缘静脉输注体内。依照文献[10]评估方法,于输注前及输注后每2周检测干眼临床相关指标,确定模型成功建立。
1.2.5实时荧光定量PCR法检测miR-31-5p及Th17细胞相关基因mRNA相对表达量 分离模型兔PBMC,分为miR-31-5p过表达组和对照组,分别感染miR-31-5p过表达及其对照慢病毒72 h,以U6为内参照,实时荧光定量PCR法检测miR-31-5p mRNA相对表达量,反应条件为:95 ℃预变性3 min;95 ℃变性15 s,62 ℃退火及延伸40 s,40个循环。病毒感染后24 h收集2个组PBMC,换液后与经γ射线照射的泪腺上皮细胞共培养,72 h后收集PBMC。实时荧光定量PCR反应引物序列见表1,引物序列均由上海生工生物工程有限公司合成,反应体系:SYBR Green ⅠMaster 4 μl,正反向引物各1 μl,cDNA模板2 μl;以GAPDH为内参照,检测IL-17、维甲酸相关孤儿核受体(retinoic acid-receptor-related orphan receptor C,RORC)、IL-1β、IL-6、IL-23 mRNA相对表达量,反应条件:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火及延伸1 min,40个循环。2个组相对定量结果分析采用2-ΔΔCt法。每次独立重复实验中设置3个复孔,取平均值。每个实验结果独立重复3次以上。

表1 实时荧光定量PCR引物序列Table 1 Primer sequences for quantitative real-time PCR基因引物序列(5'-3')扩增片段长度(bp)IL-17正向:GGAATGAGGACCACCA-CATGA61反向:CTGCGTAGGACCAG-GATCTCTTRORC正向:GGCCTACCACGCCGA57反向:TCCATGCCACCGTATTTGCIL-1β正向:CTCCTGCCAACCCTACAA-CAA60反向:TCCAGAGCCACAACGACT-GAIL-6正向:GCAGAAAAACCAGTGGCT-GAA53反向:GGCCGCGCAGGATGAIL-23正向:AGGAGTGTCTTGCGAAT-GTGAT148反向:AGCAGGAGCAGGGTTGATGGAPDH正向:GGGTGGTGGACCTCATGGT58反向:CGGTGGTTTGAGGGCTCT-TAmiR-31-5p正向:CGAGGCAAGATGCTGGCAT60反向:AGTGCAGGGTCCGAGG-TATTU6正向:CGCTTCGGCAGCACATAT-AC87反向:TTCACGAATTTGCGTGT-CATC 注:PCR:聚合酶链式反应;IL:白细胞介素;RORC:维甲酸相关孤儿核受体C;GAPDH:磷酸甘油醛脱氢酶;miR:微小RNA;U6:U6核小RNA Note:PCR:polymerase chain reaction;IL:interleukin;RORC:retinoic acid-receptor-related orphan receptor C;GAPDH:glyceraldehyde phos-phate dehydrogenase;miR:microRNA;U6:U6 small nuclear RNA
1.2.6Western blot法检测IL-17蛋白相对表达量 miR-31-5p过表达组及对照组PBMC与经γ射线照射的泪腺上皮细胞体外共培养72 h,收集PBMC,加入RIPA裂解液、PMSF、磷酸酶抑制剂(体积比100∶ 1∶ 1)提取细胞总蛋白。用BCA试剂盒检测相对蛋白浓度,将蛋白与上样缓冲液混合均匀并于100 ℃高温变性10 min。取80 μg等量蛋白样品加入十二烷基硫酸钠-聚丙烯酰胺凝胶孔,100 V恒压电泳60 min后,在65 V条件下将蛋白转印至硝酸纤维素膜。用质量分数5%脱脂奶粉室温封闭2 h,加入相应的鼠抗兔IL-17(1∶ 667)和小鼠抗兔β-actin(1∶ 2 000),4 ℃孵育过夜。1倍TBST缓冲液洗涤10 min,共3次,加入马抗小鼠IgG二抗(1∶ 2 000),室温下孵育2 h。经1倍TBST缓冲液再次洗涤,按体积比1∶ 1混合加入ECL发光液,采用化学发光凝胶成像仪采集图片信息,采用ImageJ软件进行灰度分析,以β-actin为内参,计算IL-17蛋白相对表达量。实验结果独立重复3次。
1.3 统计学方法

2 结果
2.1 miR-31-5p重组慢病毒载体的鉴定
琼脂糖凝胶电泳结果显示,PCR扩增miR-31-5p前体序列的片段大小为83 bp,目的片段大小与预期结果相符。将目的片段克隆至pLL3.7慢病毒过表达载体后,测序分析结果显示插入片段序列与目的序列一致,miR-31-5p重组慢病毒载体构建成功(图1)。

图1 miR-31-5p重组慢病毒载体的构建及鉴定 A:PCR扩增miR-31-5p前体片段琼脂糖凝胶电泳图 B:miR-31-5p重组慢病毒载体测序图 miR:微小RNA
2.2 miR-31-5p重组慢病毒滴度
荧光显微镜下可见转染后48 h miR-31-5p重组慢病毒及对照病毒中表达GFP蛋白的绿色荧光细胞约占细胞总数的90%(图2);293T细胞荧光强度随病毒的稀释逐渐减弱(图3)。miR-31-5p重组慢病毒及对照病毒滴度分别为3.82×107TU/ml和3.50×107TU/ml,满足后续实验需求。

图2 miR-31-5p重组慢病毒和对照病毒感染293T细胞48 h GFP表达情况(标尺=500 μm) A:对照病毒 B:miR-31-5p重组慢病毒
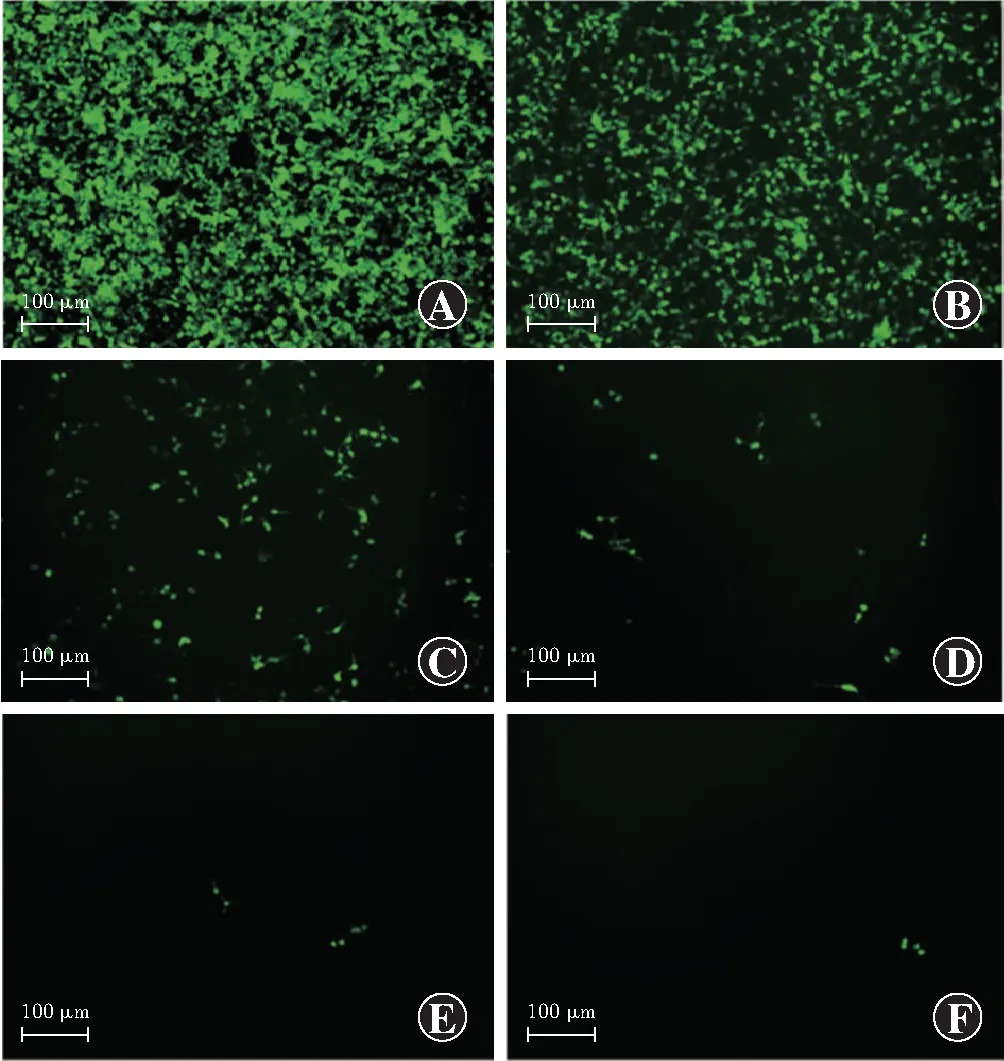
图3 不同浓度病毒感染293T细胞后72 h GFP荧光表达情况(标尺=100 μm) A~F所含病毒体积百分比分别为10%、1%、1×10-1%、1×10-2%、1×10-3%、1×10-4%
2.3 2个组PBMC中miR-31-5p相对表达量比较
实时荧光定量PCR结果显示,miR-31-5p过表达组miR-31-5p相对表达量明显高于对照组,差异有统计学意义(t=-9.696,P<0.001)(表2)。

表2 2个组PBMC中miR-31-5p相对表达量比较(x±s)Table 2 Comparison of miR-31-5p relative expressionlevel in PBMC between two groups (x±s)组别样本量miR-31-5p对照组41.02±0.03miR-31-5p过表达组42.58±0.32t值-9.696P值<0.001 注:(独立样本t检验) PBMC:外周血单个核细胞;miR:微小RNA Note:(Independent samples t test) PBMC:peripheral blood mononucle-ar cell;miR:microRNA
2.4 2个组RORC及IL-17 mRNA相对表达量比较
实时荧光定量PCR结果显示,miR-31-5p过表达组PBMC中RORC、IL-17 mRNA相对表达量均较对照组降低,差异均有统计学意义(均P<0.05)(表3)。
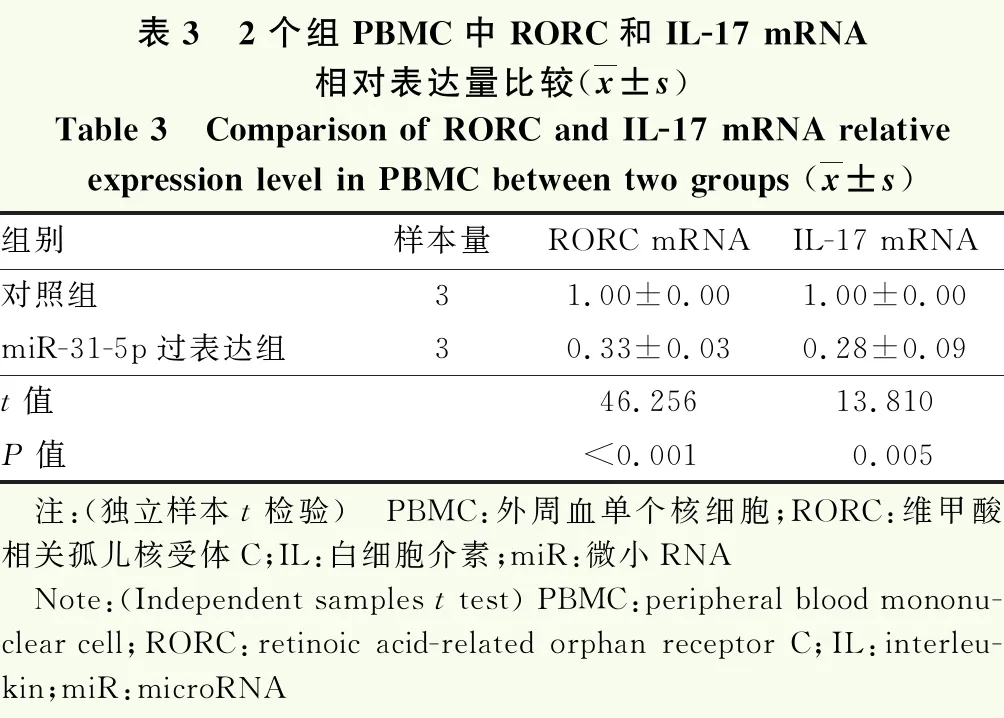
表3 2个组PBMC中RORC和IL-17 mRNA相对表达量比较(x±s)Table 3 Comparison of RORC and IL-17 mRNA relativeexpression level in PBMC between two groups (x±s)组别样本量RORC mRNAIL-17 mRNA对照组31.00±0.001.00±0.00miR-31-5p过表达组30.33±0.030.28±0.09t值46.25613.810P值<0.0010.005 注:(独立样本t检验) PBMC:外周血单个核细胞;RORC:维甲酸相关孤儿核受体C;IL:白细胞介素;miR:微小RNA Note:(Independent samples t test) PBMC:peripheral blood mononu-clear cell;RORC:retinoic acid-related orphan receptor C;IL:interleu-kin;miR:microRNA
2.5 2个组PBMC中IL-17蛋白相对表达量比较
Western blot结果显示,miR-31-5p过表达组IL-17蛋白条带较对照组明显减弱,其相对表达量为0.30±0.05,明显低于对照组的0.66±0.15,差异有统计学意义(t=4.977,P=0.008)(图4)。

图4 2个组PBMC中IL-17蛋白相对表达量比较 A:Western blot电泳图 B:IL-17蛋白相对表达量比较 与对照组相比,aP<0.01(独立样本t检验,n=3) 1:对照组;2:miR-31-5p过表达组 IL:白细胞介素;β-actin:β-肌动蛋白
2.6 2个组PBMC中Th17细胞极化相关细胞因子IL-6、IL-23和IL-1β mRNA相对表达量比较
miR-31-5p过表达组PBMC中IL-6、IL-23、IL-1β mRNA表达量均明显低于对照组,差异均有统计学意义(均P<0.05)(表4)。

表4 2个组PBMC中IL-6、IL-23和IL-1β mRNA相对表达量比较(x±s)Table 4 Comparison of IL-6,IL-23 and IL-1β mRNArelative expression levels in PBMC between two groups (x±s)组别样本量IL-6 mRNAIL-23 mRNAIL-1β mRNA对照组31.00±0.001.03±0.061.00±0.00miR-31-5p过表达组30.51±0.000.47±0.110.60±0.05t值220.0766.64113.271P值<0.0010.0220.006 注:(独立样本t检验) PBMC:外周血单个核细胞;IL:白细胞介素;miR:微小RNA Note:(Independent samples t test) PBMC:peripheral blood mononucle-ar cell;IL:interleukin;miR:microRNA
3 讨论
SS相关干眼主要由CD4+Th细胞介导,其发病机制复杂,了解其发病机制有助于探索新的治疗策略[12]。miRNA能够在转录后水平调控基因表达并广泛作用于多种生物学过程[13],是目前自身免疫性疾病领域研究的热点。研究表明,miRNA的异常表达与SS相关干眼的发病机制密切相关[14-16],明确miRNA的相关调控机制可以为疾病提供新的治疗靶点和干预策略。miR-31-5p是一种高度保守的微小RNA,其基因位于染色体9p21.3位点。已有研究证明,miR-31-5p可以靶向抑制滤泡Th细胞中BTLA、SAP和CD40L等基因的表达,从而抑制其与B细胞的相互作用,是治疗自身免疫性疾病的一个潜在靶点[17]。Johansson等[18]研究发现在SS患者T细胞中miR-31-5p表达水平显著下调。本课题组前期研究结果表明,miR-31-5p在自身免疫性干眼模型兔泪腺和PBMC中表达显著降低,提示miR-31-5p可能参与自身免疫性干眼的发生和发展[9]。本研究探讨miR-31-5p过表达对兔自身免疫性干眼外周血Th17细胞的免疫调控作用,以期为探索自身免疫性干眼发病机制以及优化治疗方案提供实验基础。
Th17细胞是一种表达特异性转录因子RORC和标志性细胞因子IL-17的CD4+辅助T细胞亚群。RORC可以调控初始CD4+T细胞向Th17细胞分化,是诱导IL-17分泌的关键转录因子[19];IL-17参与中性粒细胞的增生、成熟和迁移过程,加剧组织炎症反应[20]。研究表明,Th17细胞是介导自身免疫性干眼的主要致病细胞群[21],与健康对照者相比,SS患者泪液中IL-17A、IL-6和IL-23等Th17相关细胞因子的表达明显上调[22];IL-17A基因敲除可以有效改善实验性SS模型鼠的疾病症状和病理改变[23]。目前,越来越多的证据显示miRNA可参与Th17细胞免疫反应,调控自身免疫性干眼的发生和发展[24]。例如,Wang等[25]研究发现miR-146a-5p在SS患者PBMC中表达显著上调,并且通过负调控金属蛋白酶17促进Th17细胞的分化。然而,在自身免疫性干眼中,miR-31-5p对Th17细胞的调控作用尚未见报道。本研究中观察miR-31-5p在PBMC中过表达对兔自身免疫性干眼中外周血Th17细胞免疫反应的影响,实时荧光定量PCR结果表明,miR-31-5p过表达后RORC及IL-17 mRNA表达下调;Western blot检测结果显示IL-17蛋白相对水平显著降低,这说明miR-31-5p过表达可能通过抑制兔自身免疫性干眼外周血Th17细胞免疫反应,参与自身免疫性干眼的发病进程。
多项研究表明,免疫微环境参与调控Th17细胞免疫反应。其中,IL-6、IL-1β和IL-23是影响Th17细胞极化的关键细胞因子,IL-6能够通过抑制T细胞中Foxp3的表达,解除其对RORγt的抑制作用,促进Th17细胞活化[26];IL-1β参与Th17细胞的早期分化,促进Th17细胞的分泌功能[27-28];IL-23则主要通过活化STAT3维持Th17细胞稳定和分泌功能,加剧组织炎症反应[29]。近期研究表明,miRNA可以通过调控免疫微环境参与Th17细胞免疫反应。例如,Wei等[30]研究表明在实验性自身免疫性葡萄膜炎中,树突状细胞过表达miR-223-3p可以显著增强Th17极化相关细胞因子IL-23和IL-1β的分泌,进而促进致病性Th17细胞极化。Yan等[31]研究发现,应用miR-155抑制剂治疗实验性自身免疫性心肌炎可以引起脾脏CD11c+树突状细胞分泌的Th17极化相关细胞因子IL-6、IL-23、IL-1β、TNF-α显著降低,抑制Th17细胞免疫反应,缓解心脏损伤。本研究中结果显示,miR-31-5p过表达组PBMC中Th17细胞极化相关细胞因子IL-6、IL-1β和IL-23 mRNA相对表达量较对照组明显降低,提示miR-31-5p过表达可能创造了一个抑制Th17细胞极化的免疫微环境,进而抑制了Th17细胞免疫反应。由于目前缺少IL-1β、IL-6和IL-23等商用抗兔的单克隆抗体,故本研究中仅对其mRNA水平进行了检测。
综上所述,本研究表明miR-31-5p过表达可能通过下调免疫微环境中IL-6、IL-23、IL-1β等细胞因子的表达负向调控Th17细胞免疫反应,为进一步探索miR-31-5p对自身免疫性干眼的保护作用及机制提供了实验基础。本研究仅探讨了在体外PBMC中miR-31-5p过表达对Th17细胞的免疫调控及部分机制,关于miR-31-5p如何影响Th17细胞极化以及在体内过表达miR-31-5p是否能够抑制自身免疫性干眼的发病进程,仍需进一步研究。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明高敏:实验设计、实施研究、采集数据、分析数据、起草文章;赵璐、陈思思:实验设计、实施研究、文章修改;魏瑞华:参与选题、研究设计及文章定稿;粘红:参与选题、研究设计、文章修改及定稿
