新诊断2型糖尿病患者尿白蛋白排泄与胰岛素抵抗关系的研究
2022-09-06张岱郑茂祝捷孙建然徐将叶山东
张岱,郑茂,祝捷,孙建然,徐将,叶山东
中国科学技术大学附属第一医院(安徽省立医院)内分泌科,合肥 230001
糖尿病是目前全世界的重要公共卫生问题。2020年中华糖尿病学分会报告中国成人糖尿病的患病率高达11.2%,糖尿病肾脏疾病(DKD)的患病率达10%~40%[1],DKD目前已成为中国人群慢性肾脏疾病(CKD)的单个最主要原因。2014年,美国糖尿病协会(ADA)提出DKD是指由糖尿病引起的CKD,临床表现为持续性白蛋白尿和(或)肾小球滤过率的进行性下降。微量白蛋白尿可用于评估DKD的预后,也是心脑血管疾病及心力衰竭的危险因子。Ahlqvist等[2]将糖尿病分成5 种新的亚型,其中第三亚型(严重胰岛素抵抗型)有更高的DKD风险,部分2型糖尿病(T2DM)患者病程早期出现微量白蛋白尿甚至大量白蛋白尿。本研究旨在分析新诊断T2DM患者尿白蛋白排泄情况及其与胰岛素抵抗的关系,为早期针对胰岛素抵抗进行干预治疗、改善DKD的预后提供临床证据。
1 对象与方法
1.1 研究对象 选取中国科学技术大学附属第一医院(安徽省立医院)2014年1月至2020年7月新诊断的T2DM患者182例,其中男性124例,女性58 例;所有患者均符合1999年公布的T2DM诊断标准。所有患者排除1型糖尿病(T1DM)、其他特殊类型糖尿病、妊娠糖尿病,近期无发热、尿路感染、充血性心力衰竭、糖尿病酮症和高渗状态等,排除肾结石、肾结核、肾脏血管先天性疾病、慢性肾小球肾炎、原发性肾病综合征、非糖尿病相关的其他肾病综合征、风湿系统疾病、多发性骨髓瘤、肾脏肿瘤、乙型肝炎相关性肾病、其他实体恶性肿瘤,除外创伤、手术应激等情况,未使用过任何降糖药物、血管紧张素转化酶抑制剂/血管紧张素Ⅱ受体拮抗剂类降压药物或调脂药物。研究对象按尿白蛋白肌酐比值(UACR)分为:正常白蛋白尿组(U1组)(UACR<30 mg/g)、微量白蛋白尿组(U2组)(30 mg/g≤UACR ≤300 mg/g)、大量白蛋白尿组(U3组)(UACR> 300 mg/g)。
1.2 研究方法
1.2.1 资料采集 记录研究对象的年龄、性别、收缩压(SBP)、舒张压(DBP)、身高和体重计算体重指数(BMI)。所有研究对象均隔夜空腹8 h以上,次日清晨静脉抽血测定空腹血糖(FPG)、胰岛素(FIns)、糖化血红蛋白(HbA1c)、三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、肝功能、肾功能。HbA1c测定采用高效液相分析法,血糖检测用葡萄糖氧化酶法,胰岛素检测采用化学发光法。收集患者次日清晨中段尿检测尿白蛋白及尿肌酐并计算UACR。
1.2.2 胰岛素抵抗的评价指标 采用稳态模型评估的胰岛素抵抗指数,即HOMA-IR=[FPG(mmol/L)×FIns(mIU/L)]/22.5;采用稳态模型评估的胰岛β细胞功能指数,即HOMA-β=20×FIns (mIU/L)/[FPG(mmol/L)-3.5]。
1.2.3 肾小球滤过率 采用2006年中国预估肾小球滤过率(eGFR)协作组制定的改良MDRD公式:eGFR=186×血肌酐(mg/dL)-1.154×年龄-0.203×(女性×0.742)。
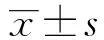
2 结果
2.1 DKD发生情况 182例患者中,正常白蛋白尿患者135例,占74.18%;微量白蛋白尿患者40例,占21.98%;大量白蛋白尿患者7例,占3.84%。
本组病例中,eGFR<60 mL· min-1·1.73 m-2的患者仅2例,无正常白蛋白尿的CKD患者。根据2014年版糖尿病肾病防治专家共识推荐的DKD临床诊断标准,本研究中新诊断T2DM患者DKD的发生率为25.82%。
2.2 3组间一般临床资料比较 3组患者的年龄、eGFR、HDL-C及肝功能差异无统计学意义,性别分布差异有统计学意义(P<0.05),U3组女性患者更多见;3组间BMI、SBP、DBP、UA、TG、TC、LDL-C、HbA1c、FPG、FIns、HOMA-β、HOMA-IR均差异有统计学意义(P<0.05);与U1组比较,U2组和U3组BMI明显升高(P<0.05),与U1组和U2组相比,U3组DBP及血尿酸水平明显升高(P<0.05)。见表1。
表1 3组间一般临床资料比较
2.3 UACR与各指标的相关性 UACR与HbA1c、SBP、DBP、TG、TC、LDL-C、FPG、FIns及HOMA-IR呈正相关性(P<0.05),与HOMA-β及eGFR呈负相关(P<0.05),见表2。与年龄、BMI、UA、HDL-C、丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)无相关性。

表2 UACR与各指标之间的相关性分析
2.4 二元logistic回归分析 研究对象按UACR分为:无白蛋白尿组(UACR<30 mg/g),白蛋白尿组(UACR≥30 mg/g),以有无白蛋白尿为因变量,以性别、SBP、DBP、HbA1c、TG、TC、LDL-C、HOMA-IR、HOMA-β、eGFR为自变量,行二元logistic回归分析,结果显示,HbA1c、SBP、TG是发生白蛋白尿的影响因素(P<0.05),未发现HOMA-IR及HOMA-β 是发生白蛋白尿的影响因素,见表3。
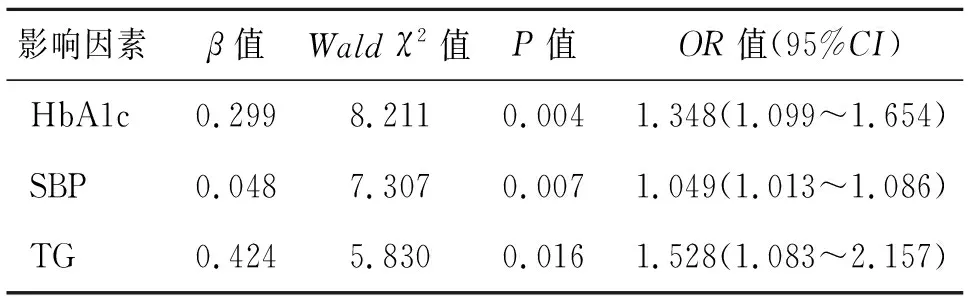
表3 新诊断T2DM患者发生白蛋白尿的影响因素
3 讨论
本研究发现在部分新诊断的T2DM患者中已出现白蛋白尿,提示T2DM病程早期即可能并发DKD。UKPDS研究发现新诊断的T2DM患者微量白蛋白尿的患病率为7.3%[3]。有研究[4]发现新诊断T2DM患者中DKD的患病率高达45.75%,本研究中DKD的患病率为25.82%,微量白蛋白尿的患病率为21.98%,与文献报告不完全一致,可能与研究人群特征或种族不同有关。
Maahs等[5]发现,相比于年轻的T1DM患者,年轻T2DM患者更容易出现UACR升高,且与女性、HbA1c、TG、高血压等显著相关。有研究[6]报告在非糖尿病人群中,老龄化、女性、高血压、高血糖、血脂异常、胰岛素抵抗、肥胖和代谢综合征都是发生白蛋白尿的独立危险因素。本研究U1 组及U2组中男性患者多见,U3组中女性患者更多见。新诊断T2DM患者UACR水平与SBP及TG、LDL-C正相关,TG及SBP进入logistic回归方程,提示TG及SBP是新诊断T2DM患者发生白蛋白尿的影响因素。本研究发现HbA1c进入logistic回归方程,提示新诊断T2DM高血糖是白蛋白尿的独立危险因素。有研究发现,早期血糖控制不佳即可引起肾小球足细胞中蛋白酪氨酸磷酸酶持续激活和表达,导致胰岛素受体磷酸化减少,即使后期血糖控制理想,仍会引起持久的胰岛素抵抗和足细胞功能障碍,这可能与代谢记忆有关[7]。
高血糖、高血压及血脂异常与胰岛素抵抗密切相关且互相影响,胰岛素抵抗是T2DM重要的致病因子。近年来不少研究报道,早发或新诊断的T2DM 肾功能受损或白蛋白尿与胰岛素抵抗有关,提示胰岛素抵抗可能是T2DM患者白蛋白尿发生及发展的潜在致病因子并可预测微量白蛋白尿的发生[8-10]。本研究采用HOMA-IR及HOMA-β评估胰岛素抵抗程度,结果显示新诊断T2DM患者的UACR水平与HOMA-IR呈正相关,与HOMA-β呈负相关。关于胰岛素抵抗引起白蛋白尿及肾损伤的机制目前仍未明确。有动物试验发现在显性糖尿病诊断之前,高胰岛素血症已经改变肾脏结构。胰岛素抵抗状态下,胰岛素与胰岛素样生长因子-1受体结合增加,诱导肾小球系膜细胞增生同时抑制其凋亡,降低基质金属蛋白酶活性,增加TGF-β表达,导致肾脏纤维化[11]。此外,高胰岛素血症可增加醛固酮对血管紧张素Ⅱ的反应,刺激血管紧张素Ⅰ受体的表达加重肾脏损伤,高胰岛素血症可增加足细胞的胰岛素受体降解,减弱胰岛素信号通路[12]。胰岛素抵抗状态下,内皮素水平升高,一氧化氮生物利用度下降,血管舒张功能受损,肾脏血流量及肾小球滤过率下降;活性氧自由基生成增加,糖氧化产物及脂质过氧化物产物在肾脏沉积增多,肾脏受损加重;纤溶酶原激活物抑制剂1水平升高,导致体内呈现高凝状态,加重肾脏纤维化[13]。
综上所述,新诊断T2DM患者的尿白蛋白排泄增加与胰岛素抵抗有关。本研究中HOMA-IR未进入logistic回归方程,不能验证胰岛素抵抗是新诊断T2DM发生白蛋白尿的影响因素,可能是因为胰岛素抵抗与高血脂、高血糖及高血压之间有交叉作用。
