牦牛乳源人葡萄球菌的分离鉴定及遗传进化分析
2022-09-06李小英刘连杰杨晶晶顾庆云刘晓强
李小英,刘连杰,杨晶晶,顾庆云,刘晓强
(1.西藏职业技术学院,西藏拉萨 850030;2.西藏昌都市卡若区农业技术推广站,西藏昌都 854000;3.西北农林科技大学动物医学院,陕西杨凌 712100)
凝固酶阴性葡萄球菌(coagulase negative staphylococci,CNS)是存在于健康人皮肤、口腔及肠道的正常菌,一直被认为无致病性。但随着介入性诊断技术、免疫抑制剂、广谱抗生素等的广泛应用,该菌种引起的感染病例日益增多,被认为是医院感染的重要病原菌。同时,也存在于养殖场的饲料及饮水中,葡萄球菌在养殖场的致病案例最为常见。现已陆续发现人葡萄球菌可导致人的多器官感染、化脓性感染以及败血症[1-3],尤其是在植入人工假体的患者和免疫功能低下的新生儿中发病率较高[4-5]。人葡萄球菌致病因素与其他葡萄球菌相似,主要是因其在医疗器械或宿主组织上形成稳定的生物被膜[6]。在人群中发现了其多重耐药性表型,从而限制了治疗方案的选择[7-8]。从环境、野生斑头鹅粪便和野猫中分离出人葡萄球菌[9-11]。人葡萄球菌亚种可通过SDS-PAGE或MALDI-TOF MS鉴定,且此方法快速、敏感[12]。本研究将牦牛乳中分离的人葡萄球菌进行了分离培养、革兰氏染色、细菌鉴定、药敏鉴定、动物试验和遗传进化分析,为牦牛乳房炎的防控与临床治疗提供理论参考。
1 材料与方法
1.1 材料
1.1.1 实验动物 6周龄健康Balb/c小鼠10只,体重20 g±2g,购自北京维通利华实验动物技术有限公司。
1.1.2 主要试剂 血琼脂培养基、革兰氏染色套装、LB营养琼脂和LB营养肉汤培养基,杭州微生物试剂有限公司产品;Trans2K Plus Ⅱ DNA Marker,全式金生物技术有限公司产品;胶回收试剂盒,天根生化科技(北京)有限公司产品;Premix LA PCR酶,宝日医生物技术(北京)有限公司产品;细菌生化鉴定卡和药敏纸片,法国生物梅里埃公司产品。
1.1.3 主要仪器 SW-CJ-1FD型单人单面净化工作台,浙江苏净净化有限公司产品;DHP-9051电热恒温培养箱,北京科伟永兴仪器有限公司产品产品;PCR仪,美国BIO-RAD产品;C-32型厌氧罐、2.5L厌氧产气袋,日本三菱MGC公司产品;VITEK-2全自动细菌鉴定药敏仪,法国生物梅里埃公司产品。
1.2 方法
1.2.1 样品采集 2020年4月~6月从西藏拉萨某牦牛养殖场采集奶样。采样前先用温水清洗采样乳头,再用碘酒消毒乳头,并在清洗或消毒乳头后均用消毒毛巾擦干。弃去采样乳区的头3把乳,然后采集乳样5 mL~8 mL至灭菌离心管密封保存,并作好标记,置于备有冰袋的泡沫盒中,送回实验室进行细菌分离与鉴定。奶牛在采样前未接受任何药物治疗。
1.2.2 病原菌分离 无菌采集患病牦牛乳2组。其中一组接种于血琼脂培养基,放置厌氧培养罐,加入厌氧产气袋后密封厌氧罐,37℃倒置培养48 h,用于分离厌氧菌和兼性厌氧菌;另一组接种于普通LB培养基,放置于恒温培养箱,37℃倒置培养18 h~24 h,用于分离需氧菌。在有菌落生长的培养基上,用无菌接种环挑取8个单菌落,重新接种到营养琼脂平板中进行纯化培养,并进行形态学分析。将纯化培养后的菌落置于营养肉汤中进行增菌培养。
1.2.3 病原菌生化鉴定及药敏试验 无菌挑取单个菌落进行革兰氏染色,染色后置于显微镜下观察。根据革兰氏染色结果,菌液浓度调整至0.50麦氏浓度,选用Mérieux细菌生化鉴定管和药敏纸片,使用VITEK2 Compact全自动细菌鉴定及药敏分析系统分析。
1.2.4 病原菌致病性试验 将病原菌接种于营养肉汤中进行增菌培养,37℃培养18 h。10只受试Balb/c小鼠随机分为试验组和对照组,每组各5只。试验组腹腔接种0.1 mL浓度为1×108CFU/mL菌液。对照组腹腔接种相同体积的普通营养肉汤。接种后定时观察、记录发病情况。动物死亡或处死后,剖检观察各个组织器官的病理变化,并进行细菌分离。
1.2.5 病原菌16S rRNA序列测定 提取上述培养物的全基因组,采用细菌通用引物16S rRNA,预扩增目的基因大小约1 500 bp,PCR 扩增体系(总体积为50 μL):Premix LA 25 μL,上下游引物各2 μL,去离子水20 μL,基因组1 μL。PCR扩增程序:98℃ 30 s;98℃ 30 s,55℃ 30 s,72℃ 90 s,共30个循环;72℃再延伸10 min。电泳后,将产物送至北京金唯智生物技术有限公司测序。
1.2.6 病原菌遗传进化分析 将16S rRNA测序结果在NCBI里进行Blast比对后,选取不同物种参考株33株(表1)用MEGA-X软件,通过Neighbor-Joining方法,以Boostrap值(1000)进行进化树可靠性分析。
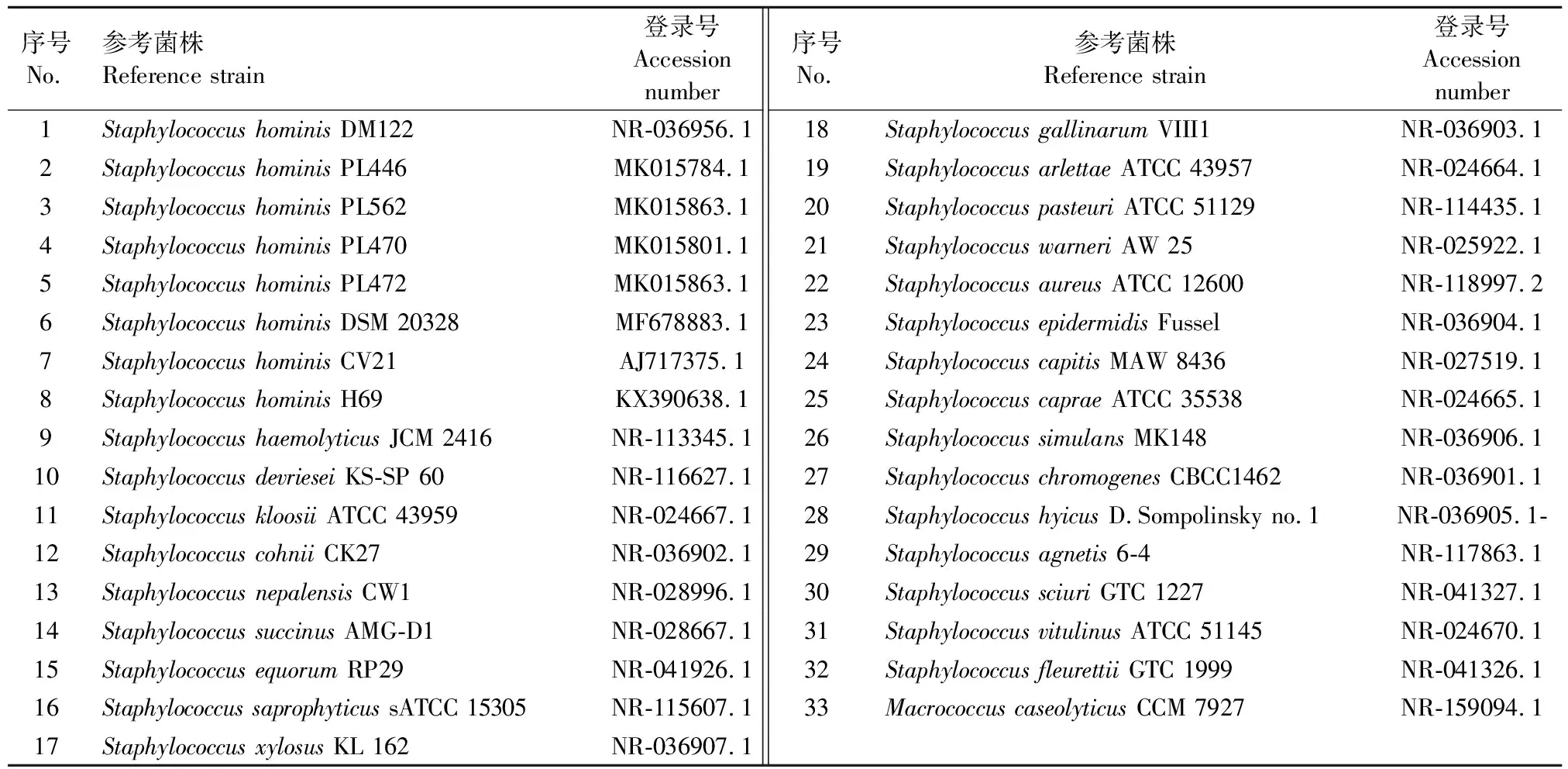
表1参考序列
2 结果
2.1 细菌分离培养及镜检结果
在血琼脂培养基上无菌落生长,在普通LB培养基上有菌落生长,说明致病菌为需氧菌。在普通LB培养基上37℃培养18 h后,挑取8个菌落进行纯化,纯化后的菌落无溶血现象,呈现白色、圆形、光滑的菌落,为革兰氏阳性球菌(图1)。
2.2 生化鉴定和药敏试验结果
生化鉴定结果为人葡萄球菌 (Staphylococcushominis),鉴定分值为99%(表2)。分离菌对庆大霉素、环丙沙星、利奈唑啉、万古霉素等12种抗菌药物敏感,对克林霉素为中介,对红霉素不敏感(表3)。
2.3 病原菌致病性试验结果
试验组小鼠7 d内全部死亡,对照组小鼠无死亡,表明该分离菌株具有一定毒力。试验组小鼠接种菌液12 h后出现运动迟缓、群聚扎堆等临床症状。剖检小鼠发现,腹腔积液浑浊,肾脏出现局部肿胀和出血,肺脏出现局部肿胀,肝脏出现局部出血,其他组织和器官未见明显病变。取实质性器官进行细菌学检查,发现来源于病变肾脏的分离菌株在LB固体培养基上呈黄色、中间稍隆起、光滑湿润、半透明状的圆形小菌落,为革兰氏阳性球菌。
2.4 16S rRNA序列测定及遗传进化分析
16S rRNA的PCR扩增结果与预期相符,大小约为1 500 bp(图2),测序结果显示为人葡萄球菌,并将所分离菌株命名为Tibet2018-S.h。从GenBank中选取不同种葡萄球菌参考株33株,将其16S rRNA基因序列进行多序列匹配排列,并进行同源性比较,绘制遗传进化树(图3),结果显示分离菌株为人葡萄球菌,遗传进化分析和测序结果与生化鉴定结果相符。

图1革兰氏染色结果(10×100)

表2分离菌生化试验结果

表3分离菌药敏试验结果

M.DNA标准DL 8 000;1.阴性对照;2.16S rRNA基因
3 讨论
人葡萄球菌是人类重要的病原菌之一,发病频率仅次于表皮葡萄球菌,是临床病例中常见的分离菌株,在很多条件下都会引起感染,如血液[13-15]。我国对人葡萄球菌的研究较少,大部分人葡萄球菌对红霉素和甲氧苄啶/磺胺甲恶唑不敏感,少数对克林霉素不敏感,所有分离菌株对万古霉素,利奈唑胺,达托霉素和替加环素均敏感[16-17]。本研究发现,从牦牛乳中分离到的人葡萄球菌仅对红霉素不敏感,对克林霉素中度敏感,对利奈唑胺、环丙沙星,左氧氟沙星等多种药物敏感,说明人葡萄球菌与抗生素的使用有关。本研究药敏试验结果可以为该牦牛养殖场控制乳房炎致病菌耐药性的传播,指导选择合适的抗菌药物提供参考。此外,本牦牛养殖场急需采取严格的牦牛乳房炎防控措施,做好隐性乳房炎和乳房炎的监测,以提高牦牛养殖水平和生鲜牦牛乳的质量。同时严格控制兽药在饲养过程中的使用,并遵守安全休药期,对降低食源性耐药菌株的出现有着重要意义。

图3 16S rRNA基因序列遗传进化分析
