猪源嗜麦芽寡养单胞菌分离鉴定及致肺脏病理损伤分析
2022-09-06任建乐姚继英赵宇军田文霞
任建乐,姬 康,杨 瑾,姚继英,王 颖,赵宇军,田文霞
(山西农业大学动物医学学院,山西太谷 030801)
猪呼吸道疾病综合征(Porcine respiratory disease complex,PRDC)是由病毒、细菌、环境、遗传和饲养管理等多种因素相互作用而引发的呼吸道疾病总称[1]。其中病毒或支原体等原发性病原可引起一种或者多种细菌继发感染,使猪群发病率和死亡率增高,增加了PRDC的复杂性和防控难度,给养猪业造成巨大的经济损失。
嗜麦芽寡养单胞菌(Stenotrophomonasmaltophilia)属黄单胞菌科、寡养单胞菌属,为非发酵型革兰氏阴性杆菌。该菌广泛存在于水、土壤、食物、植物以及人和动物的皮肤、呼吸道和胃肠道,是一种对低免疫功能者的高发病率和病死率的条件致病菌,感染人可引起肺炎、败血症、心内膜炎和尿路感染等疾病[2]。嗜麦芽寡养单胞菌可对多种抗生素耐药,已被世界卫生组织(WHO)认定为医院中最低估的重要多重耐药菌之一[2]。嗜麦芽寡养单胞菌在早期兽医诊断中并不常见,但近年来国内外陆续有该菌引起动物患病或死亡的报道。感染鱼类可引起败血症和死亡[3]。在陆生动物方面,嗜麦芽寡养单胞菌感染山羊引起淋巴或其他组织器官的炎症反应[4]。感染犬前列腺可导致生殖障碍[5]。2004年首次在猪体内分离到嗜麦芽寡养单胞菌[6]。本研究在感染猪圆环病毒2型(Porcine circovirus type 2,PCV2)的仔猪心包积液中分离到1株猪源嗜麦芽寡养单胞菌,并对其耐药性和小鼠肺脏损伤进行了分析,以期为猪场嗜麦芽寡养单胞菌的治疗及PRDC防控提供参考。
1 材料与方法
1.1 材料
1.1.1 病料和实验动物 山西临汾某猪场患有呼吸道综合征的死亡猪;6周龄~8周龄SPF级Balb/c雌性小鼠,购自北京维通利华实验动物技术有限公司。
1.1.2 主要试剂 药敏纸片,杭州微生物试剂有限公司产品;细菌微量生化反应管,杭州滨和微生物试剂有限公司产品;pEasy-Blunt载体、大肠埃希氏菌DH5α感受态,北京全式金生物公司产品;革兰氏染色液,北京索莱宝科技公司产品;2×Vazyme LAmp Master Mix,南京诺唯赞生物公司产品;反转录试剂盒和DL 2 000 Marker,大连宝生物公司产品;病毒DNA/RNA提取试剂盒、琼脂糖凝胶DNA回收试剂盒,北京天根生化科技有限公司产品。
1.1.3 主要仪器 超净工作台,苏州净化有限公司产品;PCR扩增仪和小型高速离心机,德国Eppendorf公司产品;琼脂糖凝胶电泳仪,北京六一生物科技有限公司产品;细菌恒温培养箱,上海一恒科学仪器有限公司产品;凝胶成像分析仪,美国Bio-Rad公司产品。
1.2 方法
1.2.1 病死猪剖检及病毒基因PCR检测 固定死猪尸体,打开胸腔和腹腔,观察脏器的病理变化,采集心脏、肺脏和脾脏等组织,其中一部分冻存于-80℃冰箱备用,另一部分进行组织研磨,用于病毒核酸提取和RT-PCR或者PCR检测,引物由北京擎科生物西安分公司合成(表1)。

表1引物序列
1.2.2 细菌的分离纯化及染色镜检 无菌接种环采取病猪心包积液,划线于TSA培养基上,37℃培养24 h后,挑单菌落继续划线纯化,37℃培养24 h,观察菌落形态。此外,挑取单菌落进行革兰氏染色,观察细菌的染色特点和个体形态,染色操作参照试剂盒说明书进行。
1.2.3 细菌16S rRNA基因测序鉴定及遗传演化分析 参考细菌16S rRNA通用引物扩增细菌的16S rRNA(表1),采取菌落PCR的方法进行PCR扩增,PCR反应体系和程序参照2×Vazyme LAmp Master Mix说明书进行。PCR产物经琼脂糖凝胶电泳,切胶回收目的DNA条带,连接到pEasy-Blunt载体上,进行测序和Blast比对分析;选取与分离菌株16S rRNA基因同源性高且不同来源的序列,进一步用MEGA5.0软件构建进化树,分析分离菌株的遗传演化关系。
1.2.4 生化试验 挑取已纯化的菌落接种至细菌微量生化反应管,37℃培养24 h后,参照《常见细菌系统鉴定手册》,观察生化反应管反应情况,分析结果。
1.2.5 药敏试验 用纸片扩散法对细菌分离株进行抗生素敏感性测定。扩大培养的菌液以1.0×107CFU/mL剂量均匀涂布于直径10 cm的TSA培养基中,将抗生素药敏纸片分别贴于平板上,每个平板贴4种~6种药敏片,37℃培养24 h后,测量不同抗生素的抑菌圈直径(mm),根据药敏纸片抑菌圈标准判定致病菌株对抗生素的敏感程度。
1.2.6 小鼠感染试验 8只6周龄~8周龄SPF级Balb/c雌性小鼠随机分为2组,试验组5只,对照组3只,根据文献[7-8],试验组每只小鼠腹腔注射0.2 mL 1.0×109CFU/mL剂量的菌液,对照组腹腔注射0.2 mL的无菌TSB培养基,试验周期为7 d,观察小鼠的临床症状、死亡情况、剖检及组织病理变化。用接种环采取死亡小鼠的肺脏病变部位,采用1.2.2方法进行细菌分离鉴定。
2 结果
2.1 病毒学诊断
病死猪胸腔和腹腔可见心包内有明显积液,肺脏发生实变,出血,脾脏有明显的坏死点(图1A)。经RT-PCR和PCR对病料进行PRRSV、CSFV、PCV2、PRV检测(图1B),结果显示,PCV2呈阳性,其余病毒均为阴性。
2.2 细菌学诊断及细菌分离鉴定
成功分离到1株细菌(SX21),该菌株在TSA培养基中呈灰白色,菌落表面光滑圆形(图2A);革兰氏染色结果表明,该菌为两端钝圆,短小的革兰氏阴性杆菌(图2B)。通过16S rRNA的PCR扩增、测序和Blast分析,该分离菌株与嗜麦芽寡养单胞菌的16S rRNA序列同源率达99%,判定分离菌株为嗜麦芽寡养单胞菌,然后将16S rRNA序列提交至GenBank中(GenBank accession number:OK178540)(图2C)。为分析嗜麦芽寡养单胞菌分离株的遗传演化关系,选取GenBank中不同来源的嗜麦芽寡养单胞菌与分离株的16S rRNA序列进行进化树分析。结果表明,分离株与已报道的猪源嗜麦芽寡养单胞菌参考株处于两个不同的亚分支,与SJTH1(废水源)、W18(土壤源)和SXG-1(杂交鲟源)处于同一亚分支(图2D)。
2.3 生化试验
分离株可利用麦芽糖、纤维二糖、鼠李糖、甘露糖、木糖、阿拉伯糖和果糖作为碳源,与蜜二糖肉汤、鸟氨酸、赖氨酸、七叶苷、侧金盏花醇、精氨酸双水解酶、65 g/L的高盐肉汤反应呈阳性。参照《伯杰氏细菌鉴定手册》分析,该分离株符合嗜麦芽寡养单胞菌的生化特性(表2)。
2.4 药敏试验
选取33种抗生素进行药敏试验,分离株仅对多黏菌素B、阿奇霉素、多西环素、链霉素、米诺环素、氧氟沙星、恩诺沙星和加替沙星敏感;对拉氧头孢、万古霉素、丁胺卡那、四环素、氯霉素表现为中等敏感;对包括头孢曲松和氨苄西林在内的20种抗生素表现耐药。该分离株与头孢类、β-内酰胺类、氨基糖苷类等抗生素呈耐药特征,对多肽类、四环素类和喹诺酮类抗生素敏感(表3)。

A.脏器病理变化;B.病原PCR诊断结果;M.DNA标准DL 2 000;1.猪圆环病毒2型;2.猪伪狂犬病病毒;3.猪瘟病毒;4.猪繁殖与呼吸综合征病毒;5.阴性对照

A.菌落形态;B.革兰氏染色(100×);C.16S rRNA PCR扩增(M.DNA标准DL 2000;1.细菌分离株;2.阴性对照);D.16S rRNA基因系统发育树

表2生化试验结果
2.5 小鼠感染试验
试验组小鼠精神沉郁、被毛粗乱、呼吸急促,在4、5、12 h分别死亡1只小鼠,死亡率为60%。剖检后可见肺脏实变和明显出血点。HE组织染色显示,肺脏出血、充血、肺泡消失、炎性细胞渗出等病理变化。表明嗜麦芽寡养单胞菌能引起小鼠典型的出血性肺炎,从死亡小鼠的肺脏中均能分离出嗜麦芽寡养单胞菌(图3)。
3 讨论
本研究分离到1株猪源嗜麦芽寡养单胞菌,对其遗传特性、耐药性和致病性分析发现,该分离株可能来源于环境污染物,其呈现多重耐药特征,感染小鼠可引起肺炎和死亡,为嗜麦芽寡养单胞菌的治疗和PRDC的防控提供参考。
嗜麦芽寡养单胞菌广泛存在于自然界,猪舍空气中气载需氧菌中以肠杆菌属、假单胞菌属和莫拉菌属为主,其中假单胞菌属中嗜麦芽寡养单胞菌为优势菌种,且在所调查的5个猪场中均能检测到,含量高达45.5%~81.9%[9]。对猪精液中的细菌监测发现,嗜麦芽寡养单胞菌具有较高的分离率[10]。因此,猪舍中嗜麦芽寡养单胞菌广泛存在,有可能感染猪群。人源嗜麦芽寡养单胞菌是一种对低免疫功能者高发病率和死亡率的条件致病菌,感染人可引起肺炎、败血症、心内膜炎和尿路感染等疾病[2]。
本研究在感染猪圆环病毒2型的猪中分离到嗜麦芽寡养单胞菌,该菌可引起小鼠肺脏的实变、充血、出血和肺炎等病理变化。嗜麦芽寡养单胞菌分泌的蛋白酶有增强流感病毒感染的作用,致病性研究发现该菌与猪流感病毒共感染,可导致豚鼠鼻液中流感病毒载量升高,排毒期更长[11]。此外,嗜麦芽寡养单胞菌可通过激活PD-1/PD-L1信号通路诱导T细胞衰竭进而抑制宿主T细胞免疫[12]。因此,嗜麦芽寡养单胞菌与原发性病原共感染可能具有协同作用,该菌能否促进或者增强猪圆环病毒2型的复制和致病性有待进一步探讨。本研究遗传演化分析发现,嗜麦芽寡养单胞菌SX21株与废水源菌株SJTH和土壤源菌株W18在一个亚分支,而其他猪源参考毒株在另一个亚分支,预示患病猪感染猪圆环病毒2型后,继发感染的嗜麦芽寡养单胞菌可能来源于环境中的水源或者土壤。因此,嗜麦芽寡养单胞菌作为条件致病菌,猪群的隐形感染可能存在一定的普遍性,减少原发性病原感染、应激或其他不良环境因素导致的猪群机体免疫力下降,将有助于减少PRDC的发生。
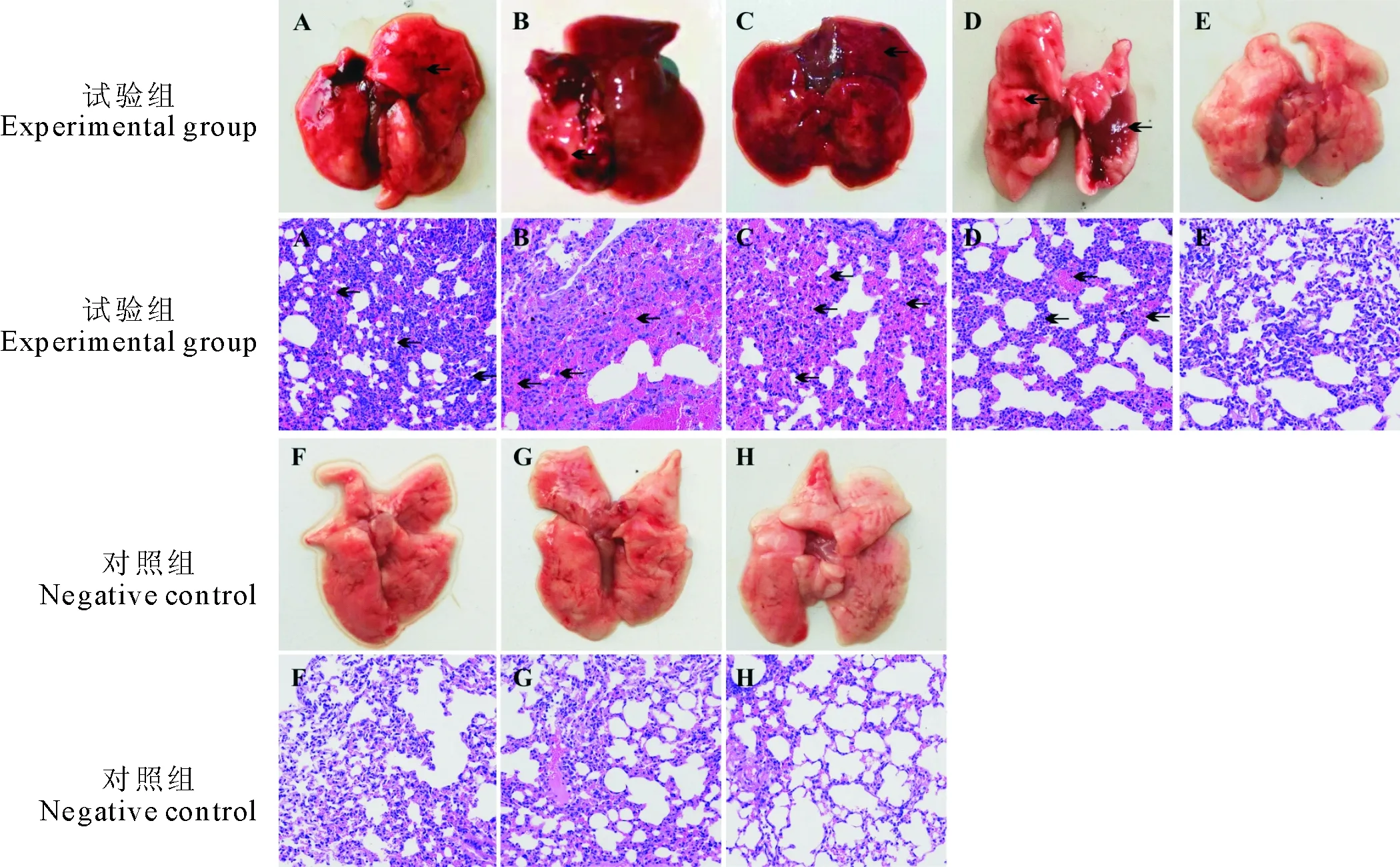
A~C.死亡小鼠肺脏;D~H.存活小鼠肺脏 A-C.Lungs of death mice;D-H.Lungs of survival mice

表3嗜麦芽寡养单胞菌药敏试验结果
嗜麦芽寡养单胞菌分离株对头孢类、β-内酰胺类、氨基糖苷类等耐药,对多粘菌素B、阿奇霉素、多西环素、链霉素、米诺环素、氧氟沙星、恩诺沙星和加替沙星敏感。不同猪场中的嗜麦芽寡养单胞菌对抗生素的耐药程度不同,可能与临床中使抗生素种类不同有关。猪源嗜麦芽寡养单胞菌有感染饲养人员的潜在危险,有研究发现养殖场人源嗜麦芽寡养单胞菌对兽医临床常用的抗菌药物耐药水平较高,且表现出多重耐药[13]。遗传演化分析显示猪场废水中的嗜麦芽寡养单胞菌株与人源菌株具有高度相似的遗传特征[14]。在养猪生产中要选择合适的抗菌药物,以减少耐药菌株的出现,既有利于疾病的防控,也可降低人员感染风险。
