阿尔茨海默病动物模型的研究进展
2022-09-05盛哲津李利妹
盛哲津, 李利妹
(1. 同济大学生命科学与技术学院,上海 200092; 2. 同济大学附属东方医院医学转化平台,上海 200120)
随着社会不断进步、生活水平大幅提高,全球老龄化日益严重,随之与年龄有关的疾病正威胁着全世界老年人的健康。阿尔茨海默病(Alzheimer's disease,AD)是最重要、最常见的年龄相关神经退行性疾病之一,也是痴呆症最常见的病因[1]。AD患者占年龄相关痴呆诊断病例的60%~80%[1-2]。根据发病年龄的不同,AD 可分为65 岁以前发病的早老性痴呆和65 岁以后发病的老年性痴呆[2]。1906年,阿洛伊斯·阿尔茨海默检查了一位失忆了3 年后死亡妇女的大脑,发现了一些不寻常的团块(称淀粉样斑块)和纤维缠结(称神经原纤维,或Tau 缠结)[3]。如今,大脑中的这些斑块和缠结被认为是AD的主要病理性特征[2,4]。此外,AD的诊断至少还需要两种临床症状,包括记忆丧失,语言、注意力、判断和解决问题等能力受损[5]。根据AD 疾病的主要特征,目前已开发了几种治疗AD的方法。譬如,乙酰胆碱酯酶抑制剂和N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)受体拮抗剂,尝试通过恢复大脑中神经递质水平治疗AD,但临床结果显示只能缓解AD患者的症状,并不能真正治愈AD[6-7]。理论上真正有效治愈AD 的策略应该是阻止引起神经退行性病变的发病进程,但目前的治疗都只是降低症状发生率。因此,需要进一步探究AD致病机制及新的更有效的治疗策略。
AD 是一种由多病因引起且病理学极其复杂的疾病[8]。实验动物模型不管是对AD 发病机制的研究还是对药物的开发都非常重要。为了帮助阐明AD的致病机制,目前已建立了多种动物模型,包括转基因小鼠、果蝇、鱼和蠕虫等[9]。利用上述动物模型模拟人类AD组织病理学的各个方面特征,譬如β-淀粉样蛋白(βamyloid,Aβ)异常沉积的斑块和Tau 蛋白异常聚集形成的神经原纤维缠结(neurofibrillary tangles,NFTs),这些模型大大加深了人们对AD发病机制的理解[10-11]。另外,合适的动物模型也是候选药物进入临床前研究时一个非常重要的工具或条件。本文就AD的主要病理组织学特征、遗传因素、有关动物模型以及其评价指标进行综述。
1 AD的主要病理组织学特征
AD的临床表现以记忆缺陷为主,随后其他认知功能如判断、语言流利性或方向性逐渐减退。尽管上述AD临床症状出现的次序可能会有所不同,但记忆损伤通常是第一个也是最主要的特征[12]。大量研究发现AD患者的海马结构、大脑皮层联合区和皮质下结构等区域发生了一些神经病理学改变。
1.1 Aβ斑块
Aβ 斑块是AD 的组织病理学特征之一[4]。淀粉样蛋白是一类含有β-折叠的异质性蛋白质聚集体,对刚果红染料具有很强的亲和力。AD 患者体内Aβ 沉积在脑膜、脑血管周围和灰质,是由淀粉样前体蛋白(amyloid precursor protein,APP)经β-分泌酶和γ-分泌酶的蛋白水解作用产生,其主要的蛋白质成分是40~42 个氨基酸组成的多肽[13]。Aβ40 是最常见的亚型;Aβ42较不常见,但更容易聚集,且神经毒性更强[13]。根据“淀粉样蛋白假说”,大脑中Aβ 的产生引发一系列病理变化,从而导致相应的AD 临床症状[14]。在能够引发Aβ产生的转基因小鼠中,记忆障碍的严重程度与Aβ斑块数量呈正相关[15]。主动或被动进行Aβ特异免疫可去除Aβ 斑块,恢复记忆功能[16]。这些现象表明AD的产生与Aβ斑块密切相关。
1.2 Tau蛋白的异常磷酸化与NFTs
AD的第二个病理组织学特征是神经原纤维退行性病变,称为NFTs,主要分布在神经元的胞体和顶端树突中[4]。NFTs 数量与痴呆严重程度之间存在正相关性[17]。细胞内NFTs的核心蛋白为Tau蛋白,它们异常聚集形成不溶性的斑块。Tau是一种微管相关蛋白,在稳定微管方面起主要作用,还参与信号转导、肌动蛋白细胞骨架形成、细胞内囊泡转运以及磷酸酶和激酶的锚定[18]。在AD 等病理情况下,Tau 蛋白被异常过度磷酸化,导致其正常生物功能丧失;而且过度磷酸化的Tau蛋白易于与微管分离,增加了Tau蛋白的可溶性,这可能是Tau 长丝组装的第一步[18]。在AD 患者的大脑中,Tau还发生构象改变,可溶性Tau以一种自然未折叠的构象存在[18]。此外,有研究还发现NFTs大量存在于其他神经退行性疾病中,如进行性核上性麻痹(progressive supranuclear palsy)、皮质基底节变性(corticobasal degeneration)、嗜银颗粒病(argyrophilic grain disease)等[19]。虽然NFTs并不是AD特有的,但是它们与神经退行性疾病密切相关。
此外,Aβ 斑块和NFTs 之间有协同作用。Aβ 斑块和NFTs 经常一起存在于异常的神经突中[20]。因此,共同表达突变APP 和Tau 的双转基因动物模型,对研究两种病变的相互作用非常有价值。
1.3 神经炎症
越来越多的研究发现神经炎性反应会造成神经元损伤,加重AD 症状,于是人们推测炎症是AD 的一个可能致病因素,但直到近年来才将其作为治疗靶点而得到重视[21-22]。错误折叠/聚集的蛋白质与小胶质细胞或星形胶质细胞上的模式识别受体结合,激活以炎性介质为特征的先天性免疫反应,促进AD 疾病的发展。有证据表明,胶质细胞的激活可能通过释放白细胞介素-1 和肿瘤坏死因子等细胞因子来驱动AD 的慢性炎症[21]。另外,全身性炎症和肥胖可能会干扰大脑的免疫过程,从而进一步加剧AD 疾病的进展[21]。一些研究表明,常年使用抗炎药治疗类风湿关节炎的患者对痴呆症的发生似乎有抵抗力[22]。
1.4 与代谢异常的关系
有研究认为AD 可以称为“3 型糖尿病”,因为某些形式的AD与胰岛素抵抗有关,而胰岛素抵抗是2型糖尿病的主要原因[23]。2 型糖尿病患者患老年痴呆症或血管性痴呆症的风险似乎也更大。上述发现促使研究人员开始寻找血糖紊乱与神经退行性病变的潜在关系,而且尝试将控制血糖的药物用于AD的防治中[24]。
2 AD的遗传因素
在AD的复杂病因中,除了环境因素外,遗传因素起主要作用。根据遗传因素,将AD分为两种类型:家族性AD(familial AD ,FAD)和散发型AD(sporadic AD,SAD)[25]。
2.1 FAD
FAD 一般在65 岁之前发病,比较罕见,占所有AD病例的1%。该类型的AD通常由3个基因的一个显性突变导致。这3 个基因分别为APP、早老素1(presenilin-1,PSEN1) 和 早 老 素2 (presenilin-2,PSEN2)[26]。
APP基因突变约占FAD的5%。1991年,在英国一个FAD 家族中发现APP基因的第一个错义突变,即171 位的缬氨酸被异亮氨酸取代(V717I),后被称为“伦敦突变”[27]。随后,研究人员发现了更多的等位基因变异,目前共鉴定出20 多种APP基因的致病性突变。另外在瑞典的2个FAD家族中发现670位和671位密码子发生双碱基对替换,导致赖氨酸和蛋氨酸被天冬氨酸和亮氨酸取代(K670D/M671L),被称为“瑞典突变”,简称APPsw[28]。
1992年,通过对14号染色体的连锁分析发现了第2 个FAD 基因座,通过定位克隆鉴定发现PSEN1 基因[29]。进一步通过与PSEN1的同源性鉴定,又找到了位于1 号染色体的PSEN2[29]。大多数FAD 病例是由PSEN1 和PSEN2 基因突变引起。迄今为止,已经发现了120 多个PSEN1 基因突变,而PSEN2 基因突变只有8个。
在FAD 中没有发现Tau基因突变。但是1998 年在17 号染色体连锁伴帕金森病的额颞痴呆(chromosome 17 in families with frontotemporal degeneration and parkinsonism,FTDP-17)中发现了Tau基因突变[30]。FTDP-17是一种与AD相关的家族性痴呆症。这些发现表明Tau 的功能异常可导致神经退行性病变,进而引起痴呆。除了额颞痴呆外,Tau突变还可引起多种疾病,如进行性皮质下胶质增生、皮质基底节变性和苍白球脑桥黑质变性[31]。
2.2 SAD
SAD大多在65岁以后发病,称为迟发性AD,在老年人中较常见,但无明显家族遗传。FAD 与SAD 的组织病理学特征难以区分。流行病学研究表明,大约30%的SAD 患者中至少有一个一级亲属患病的家族病史,其中10%有明显的常染色体显性遗传[25]。一些基因位点的多态性可能是导致SAD 的危险因素,但在已经确定的20多个基因中,确认是SAD风险基因的只有载脂蛋白E(apolipoprotein E,APOE)基因[32]。
3 AD动物模型
动物模型的建立和研究有助于AD生物学机制的认识,还可以帮助评估新药物与AD疾病相关表型之间的因果关系[33]。因此,动物模型是开发各种治疗药物的必要工具。值得注意的是,尽管部分动物和人类有着高度相似的生理特性,但仍然存在物种差异。因此,验证动物模型是否适用于研究目的是必需的。
啮齿动物(包括大鼠、小鼠等)和各种非人灵长类动物是用于研发AD等药物的典型动物。对啮齿动物的行为研究有悠久历史,已有很多丰富的研究数据库便于参考,而且成本低。其他物种包括线虫、果蝇、鸡、青蛙、斑马鱼、犬、猫、山羊、狼獾、狐猴、兔、豚鼠、叙利亚仓鼠、绵羊、黑猩猩、北极地松鼠和黑熊也被认为是人类AD/痴呆症的实验模型。但是上述动物或多或少存在一些问题,譬如有些动物不表现与人类AD疾病相似的行为,有些动物存在成本、伦理或专利问题,应用有限。
动物模型必须具有稳定性且可重复。用于研究AD的动物模型可分为自然模型(natural models)、遗传修饰 模 型(genetically modified models) 和 诱 导 模 型(induced models)三类。这三类模型各有优缺点(表1)。

表1 三类阿尔茨海默病动物模型的优缺点Table 1 Advantages and disadvantages of three types of Alzheimer's disease(AD)animal models
3.1 自然模型
失忆是衰老最初的普遍现象。因此,老年动物可能被用作痴呆和记忆丧失障碍的自然模型。不同的动物(包括犬、猫、北极熊、绵羊、山羊和一些非人灵长类动物)可以自发地表现出与AD相关的神经病理特性[34]。其中,一些物种(譬如犬和非人灵长类)的老年表现与人类的AD特性更为相似。由于自然模型不需要任何人工操作,是模拟AD自然病理生理学过程的宝贵工具[34]。
老年啮齿动物(包括大鼠和小鼠等)通常不会自发地表现出AD样病理学特征,但是一些动物可作为人类痴呆的替代模型,用于评估认知功能障碍。譬如,快速衰老的SAMP8 品系小鼠是研究AD 的理想模型[35]。该品系小鼠不但表现出年龄相关的学习记忆障碍,而且表现出AD发病机制的大部分特征,包括抗衰老因子、氧化应激、炎性因子异常表达、Aβ 沉积、Tau过度磷酸化、内质网应激、自噬活性异常和肠道菌群破坏等[35]。快速老化痴呆模型小鼠SAMP8 是快速老化小鼠(senescence accelerate mouse,SAM)的一个亚系。SAM 小鼠是日本京都大学培育的一种近交系衰老模型鼠,已广泛用于衰老相关性疾病的研究[35]。
3.2 遗传修饰模型
AD 遗传修饰模型是根据与FAD 或SAD 相关的易感基因设计而成,主要集中在APP、PSEN1、微管相关 蛋 白 Tau (microtubule-associated protein Tau,MAPT)、髓样细胞表达触发受体-2 (triggering receptor-2 expressed on myeloid cells, TREM2) 和APOE[36-38]。迄今为止,已开发出近170个AD转基因/敲入/敲除模型(具体可以参见ALZForum 数据库:https://www.alzforum.org/research-models)。除TREM2、APOE 外,这些模型几乎完全集中在淀粉样蛋白上,Tau相关转基因较少。表2列出了15种常用的小鼠遗传修饰AD模型。
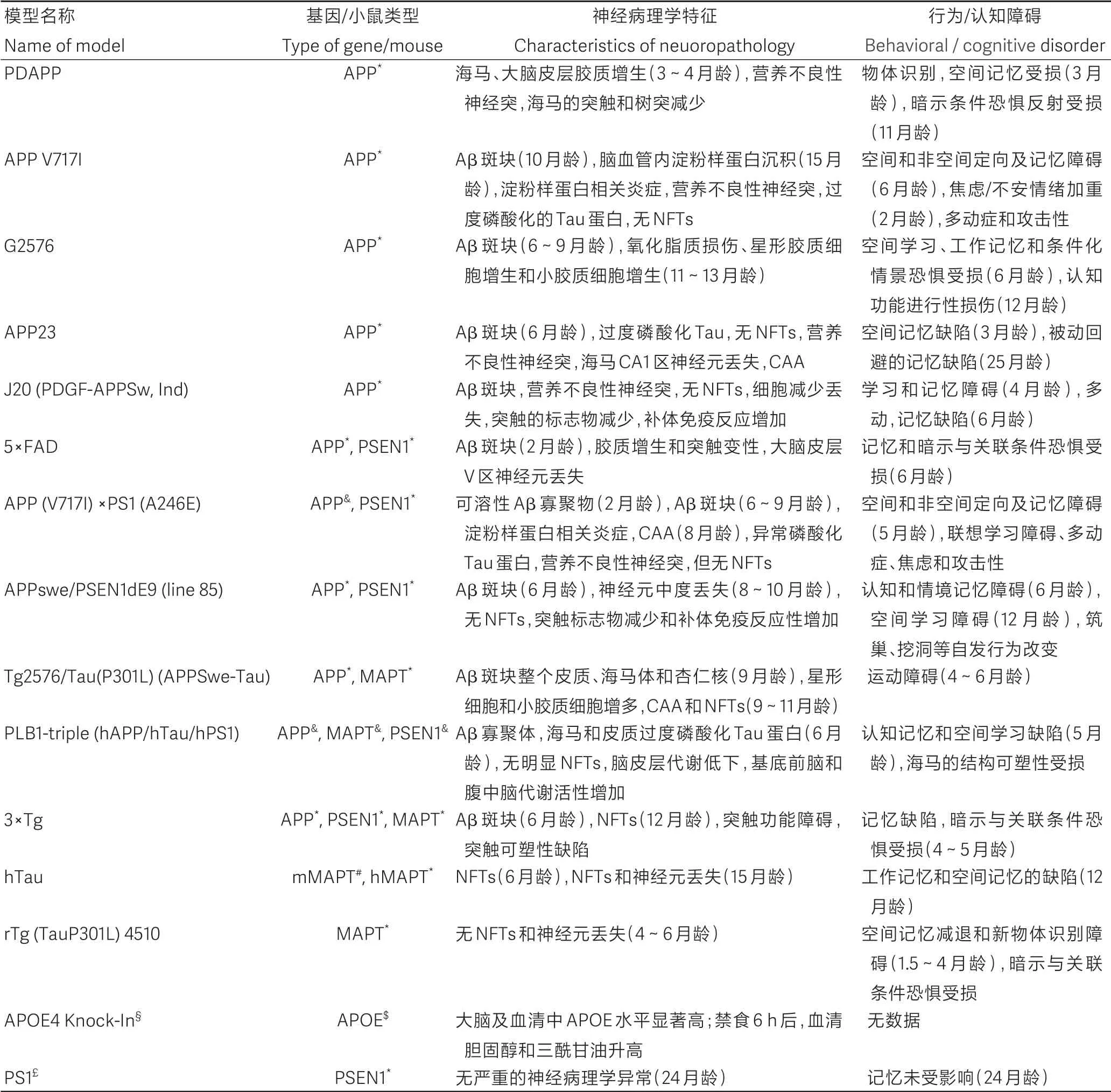
表2 15种常用的小鼠阿尔茨海默病遗传修饰模型Table 2 15 common genetically modified mouse models of Alzheimer's disease(AD)
如何从170种左右的AD动物模式中选出最合适的模型,将是一个比较大的挑战,需要综合考虑。其中必须注意以下几点:(1)没有一种动物模型能够完全再现人类AD 发病机制中观察到的所有认知缺陷;(2)每种小鼠模型都能模拟AD相关的某些方面;(3)不同的小鼠模型之间,其认知缺陷发生的时间和严重程度各不相同;(4)大多数模型的空间工作记忆的缺陷早于其他认知领域的缺陷;(5)大多数使用AD小鼠模型的研究都集中利用行为学研究与AD 相关的认知缺陷。然而,考虑到AD是一种复杂的疾病,各种非认知症状也会对不同的AD小鼠模型产生或多或少的影响,因此在评估行为表型时,各种非认知症状应与疾病的认知缺陷一起考虑。
3.3 诱导模型
根据颅内注射化学物质是否直接引起特定脑区诱发病变的差异,AD诱导模型可以分为化学诱导模型和损伤诱导模型[39]。可以经脑部注入特定的物质影响神经递质途径,阻滞神经元,导致动物痴呆,从而建立化学诱导模型,例如Aβ 或东莨菪碱诱导的遗忘模型。通过外科手段在侧脑室或脑实质内注射微量神经毒物质(如NMDA、鹅膏蕈氨酸和胆碱毒素AF64)引起脑部病变,可建立损伤诱导模型,该模型有助于了解胆碱能神经支配在认知功能障碍中的作用机制[38]。表3列出了AD诱导模型使用各种兴奋性毒素对胆碱能途径的化学损伤,或者是基于缺氧和(或)中风诱导的模型。

表3 常用的阿尔茨海默病诱导模型Table 3 Common intervention models of Alzheimer's disease(AD)
4 AD动物模型的评价指标
AD 动物模型主要从以下几个方面进行评价:(1)分子病理学或组织病理学特征测试,用于证实Aβ 斑块、Tau蛋白的细胞内聚集体、氧化损伤以及大脑皮层和某些大脑皮层下区域的突触和神经元损失;(2)行为测试,用于评价动物认知缺陷状况。一般利用常规的分子指标分析就可以实现分子病理学或组织病理学测试,如蛋白质印迹、免疫组织化学染色和实时定量PCR。以下重点介绍动物行为评价和无创检测手段。
4.1 动物行为评价
在评估某种化合物是否具有改善认知功能作用时,行为测试结果通常是衡量指标,因为这些指标的变化与AD相关的认知功能障碍直接相关。如何在动物(如啮齿动物和非人灵长类动物)中有效地测量AD引起的认知障碍,对AD 发病机制及药物发现都非常重要[40-41]。表4列举了5种对AD动物模型进行行为测试的实验方法,主要测试动物的空间记忆行为(Morris水迷宫、放射臂迷宫和巴恩斯迷宫)、联想学习(场景恐惧实验)、新物体再认记忆(新物体识别实验)。

表4 阿尔茨海默病动物模型的行为测试实验Table 4 Behavioral validation tests for animal models of Alzheimer's disease(AD)
但需要注意的是,与AD表型相关的生化指标变化相比,行为测试的结果一致性较差,需要更加严格的实验要求,包括小鼠品系、性别、年龄、是否是同一窝出生的小鼠、实验环境等。即使行为评价模型是标准化的,各种模型之间的行为数据也可能难以比较。
4.2 成像系统
神经成像技术提供了一种非常好的无创性检测方法,在临床前和临床研究中发挥着重要作用[42-43]。最常见的脑成像方法是磁共振成像(magnetic resonance imaging,MRI) 和正电子发射断层成像(positron emission tomography,PET)。MRI 利用磁场和无线电波(不使用放射性示踪剂)能够提供良好的对比度图像。结构磁共振成像(structural MRI,sMRI)可以检测到AD 脑组织的大小变化[44];功能磁共振成像(functional MRI,fMRI)可识别与神经活动相关的血流动力学反应,表征神经系统疾病[45]。MRI不能直接识别AD的分子病理学或组织病理学特征,但是PET可以直接检测AD 的分子病理学特征[46-47]。因此,与MRI相比,PET 具有更大的优势。PET 是一种无创成像技术,可与放射性标记物相结合,评估Aβ在脑部沉积量的情况、代谢负荷以及葡萄糖下降率等。尽管神经影像学方法有许多优点,但也存在局限性[47],例如PET检测手段成本高、存在放射性污染和对放射性过敏的风险。
5 展望
AD 严重影响全世界老年人的健康,是一种多病因、病理学极其复杂的疾病。目前还没有找到AD的真正致病原因,因此也没有能够真正有效治疗的药物。根据AD 最主要的神经病理学特征即在大脑部位形成Aβ斑块,研究人员提出了淀粉样蛋白假说,已构建了170 多种“Aβ 斑块”动物模型,并利用这些模型测试了许多阻止脑淀粉样蛋白沉积或清除已有淀粉样蛋白斑块的化合物,但是这些化合物一旦进入临床试验阶段均因无临床疗效而不得不放弃[48]。因此,在大脑中过度表达各种形式的人类淀粉样蛋白的大多数转基因动物更像是一种导致AD的病理学模型。
值得一提的是,最近《科学》杂志发表了一篇详尽的调查报告,称2006 年Sylvain Lesné 等发表在《自然》杂志上的一篇文章涉嫌造假[49]。该论文主要证明相对分子质量为56 000的可溶性Aβ寡聚物形式(命名为Aβ*56)在老年AD 模型小鼠Tg2576 脑部沉积是该小鼠发生记忆缺陷的原因。上述工作是第一次在动物体内纯化获得一种特定的Aβ寡聚物形式,并证明了其对神经的毒性,因此,该工作造假会对淀粉样蛋白假说形成一定“冲击”,让一些研究者更加严谨、客观地看待Aβ斑块在AD发生中的作用。但Aβ*56只是Aβ寡聚物的一种,并非AD患者脑部表达最多的Aβ。目前,AD研究领域公认的是Aβ40和Aβ42,也是研究最多的两种Aβ寡聚形式。因此,上述造假事件可能并不会影响淀粉样蛋白假说,或许针对Aβ开发药物的不断失败才真正让人们开始怀疑它的正确性。
有研究表明,在非人灵长类动物AD模型中去除大脑的Aβ 斑块并没有改善灵长类动物的认知状态[50]。因此,建议在临床试验前,先在非人灵长类动物模型中测试相关的AD候选药物,以避免临床试验失败带来的巨额成本。但需要注意,目前对非人灵长类动物AD病理特征的研究不多,有些国家存在动物伦理的争议,而且非人灵长类动物成本昂贵,上述因素均需要研究者在采用这类模型时综合考虑。此外,通过行为测试评价认知障碍的结果可能不够精准,需要进一步改善,一般至少需要两个行为测试来评估某化合物是否具有改善行为认知的能力。
总之,虽然目前已经有多达200多种的AD动物模型,但基于淀粉样蛋白假说开发的药物在临床试验中证明失败,提示研究者们需要开发出更多非“Aβ 斑块”动物模型,譬如更接近人类发病机制的自然模型。希望这些新开发的模型能帮助人们更好地理解AD疾病的复杂致病机制,并帮助找到真正有效的治疗AD的药物。另外,还需要开发出更多的模型或实验方法来评估行为认知,如嗅觉障碍模型[51],因为嗅觉障碍是AD的一个关键特征,它可能比Morris水迷宫、放射臂迷宫和巴恩斯迷宫更能反映AD动物的认知情况。
[作者贡献Author Contribution]
盛哲津检索文献,并制作所有表格;李利妹撰写和修改文稿。
[利益声明Declaration of Interest]
所有作者均声明本文不存在利益冲突。
