利用CRISPR/Cas9 技术构建脂多糖结合蛋白基因敲除小鼠
2022-09-05李思迪郭中坤林颖杰张振宇米传靓王可洲
李思迪, 付 彬, 郭中坤, 林颖杰,2, 张振宇, 米传靓, 王可洲
(1. 山东第一医科大学(山东省医学科学院)实验动物学院(省实验动物中心),济南 250002; 2. 山东第一医科大学附属皮肤病医院(山东省皮肤病医院),山东省皮肤病性病防治研究所,济南 250022)
脂多糖结合蛋白(lipopolysaccaride binding protein,LBP)作为一种糖蛋白,是LBP家族成员之一[1]。LBP的相对分子质量为60 000,其蛋白质部分是相对分子质量为50 000 的单链多肽[2-3]。LBP 分布广泛,在啮齿类动物的心、肝、肺等多个器官中均有表达,其中在肝脏中的表达水平较高。人和动物血清中的LBP 主要与脂多糖(lipopolysaccharide,LPS) 结合发挥作用[4]。LPS 又被称为内毒素,是革兰阴性菌外膜上的主要成分之一,可以促进炎性发生,引起机体各种疾病,严重时甚至会导致机体死亡[5]。研究表明,LBP与多种疾病的发生发展相关。如Heizhati 等[6]在研究LBP 对睡眠结构影响的实验中发现,血清LBP 高浓度与中年男性高血压患者睡眠第一阶段时间延长相关;Pal 等[7]在研究与帕金森病有关的胃肠道炎性标志物时,发现LBP 是一种与LPS 神经毒性相关的胃肠道生物标志物。He等[8]在研究LPS诱导下LBP编码基因缺失(Lbp-/-)SD大鼠的转录水平及其在脓毒症期间对肝脏的影响时发现,当核因子κB(nuclear factor kappa-B,NF-κB)的活性受到抑制时,Lbp基因缺失会影响过氧化物酶体增殖物激活受体(peroxisome proliferators activated receptor,PPAR)信号通路,从而影响细菌清除。Li等[9]研究了牛野生型LBP和突变型LBP(67Ala变Thr)对LPS 诱导牛乳腺上皮细胞(bovine mammary epithelial cells,BMEC)炎性反应的影响,发现5 μg/mL突变型LBP处理BMEC 导致的细胞凋亡率高于野生型LBP,且没有细胞毒性。这些相关研究揭示了LBP与LPS 结合可导致炎性反应的发生,但对其具体作用机制的研究还不够深入。为探索LPS在Lbp基因敲除小鼠体内如何诱导炎性反应发生、发展,本文将外显子2的全部序列与外显子3的部分序列特异剪切,建立Lbp基因敲除小鼠模型,为进一步研究LBP 蛋白在免疫方面的作用机制和生理作用提供实验基础。
1 材料与方法
1.1 实验动物
SPF 级C57BL/6J 小鼠和ICR 小鼠均购自北京唯尚立德生物科技有限公司[SCXK(京)2016-0009],饲养于山东省实验动物中心[SYXK(鲁)2019-0007],饲料购自济南朋悦实验动物繁育有限公司,并经60Co灭菌。实验动物使用遵循3R原则,且获得山东省实验动物中心伦理委员会批准(20181224-01)。
1.2 主要试剂与仪器
实验所用试剂:Cas9 mRNA、Cas9/gRNA 靶点效率检测试剂盒(VK007)购自北京唯尚立德生物科技有限公司;Hi Scribe T7 ARCA mRNA试剂盒(E2065S)购自美国New England Biolabs 公司;人绒毛膜促性腺激素(human chorionic gonadotropin,hCG)(181223)、血促性素(pregnant mare serum gonadotrophin,PMSG)(1905152) 购自宁波第二激素厂;pClone007 Blunt Simple VECTOR Kit (OCE20601) 、 金 牌 mix(TSE101)、动物组织/细胞基因组DNA 提取试剂盒(0180331AX)均购自北京擎科生物科技有限公司;Total RNA Kit Ⅱ(R6934-02)购自美国Omega 公司;通用抗体稀释液(U3635)购自美国Sigma公司;高效抗 体 稀 释 液 (WA-002) 购 自 美 国 Invent Biotechnologies 公司;高效RIPA 组织/细胞快速裂解液(R0010)购自北京索莱宝科技有限公司;一抗β-actin(4970S)、辣根过氧化物酶(horseradish peroxidase,HRP) 标 记 的 抗 兔IgG 二 抗(7074S) 均 购 自Cell Signaling Technology 公司;一抗LBP(PA5-79586)购自美国Invitrogen公司。
实验所用仪器:拉针仪(PN-31) 购自日本Narishige 公司;高速冷冻离心机(5424R)购自德国Eppendorf 公司;凝胶成像仪(Universal HoodⅡ)购自美国Bio-Rad公司;体视显微镜(SMZ745T)购自日本Nikon 公司;PCR 仪(Mastercycler X50s) 购自德国Eppendorf 公司;显微注射用显微镜(IX73P1F)购自日本Olympus 公司;电泳仪(PowerPac™Basic)购自美国Bio-Rad公司。
1.3 Lbp基因sgRNA靶点设计及制备
根据数据NCBI-Gene ID:16803及Ensembl-Gene:LbpENSMUSG00000016024 可得Lbp基因的序列结构、保守区域及转录产物等信息,依据这些信息设计小向导RNA(small guide RNA,sgRNA)的靶点。对Lbp基因的序列进行分析后,本实验选择剪切2 号外显子全部序列及3 号外显子部分序列,图1 为靶点剪切示意图。靶点设计完成后进行体外转录,并检测转录产物活性,筛选出酶切活性较高的sgRNA 靶点备用。同时参照Hi Scribe T7 ARCA mRNA 试剂盒说明书制备Cas9 mRNA。
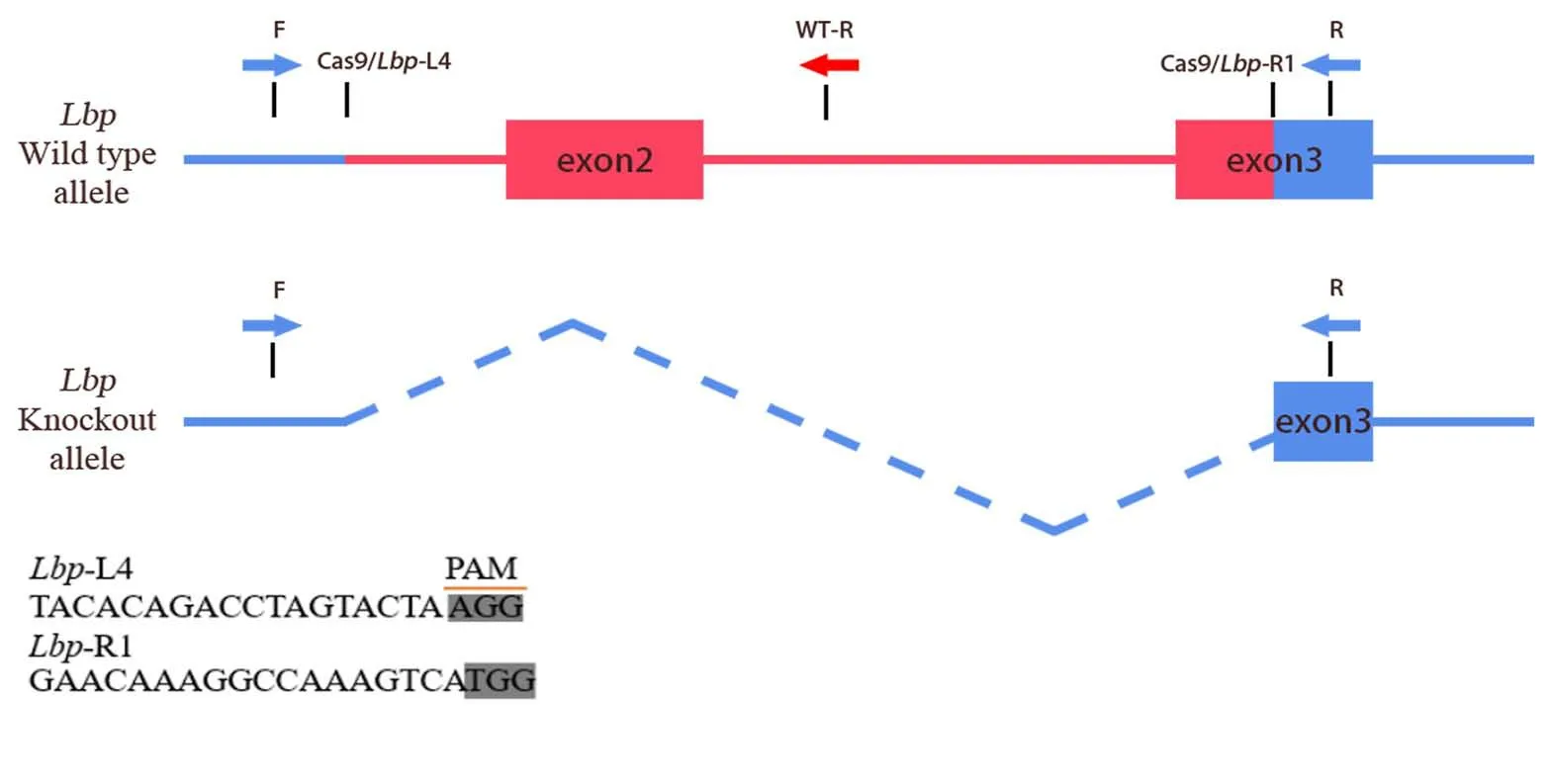
图1 Lbp基因敲除示意图Figure 1 Lbp gene knockout diagram
1.4 胚胎移植及其前期准备
准备4 周龄C57BL/6J 雌鼠和8~12 周龄C57BL/6J雄鼠。雌鼠腹腔注射PMSG 0.1 mL(5 U)/只,48 h 后腹腔注射hCG 0.1 mL(5U)/只,18 h 后取卵子备用。取雄鼠附睾,再从附睾中取出精子。
取出的精子在获能液中获能后,选取活力较好的精子滴加到经过短暂培养的卵细胞中,经3~4 h 体外受精获得受精卵。用RNA-free 水配制sgRNA&Cas9 mRNA 混合物(sgRNA 25 ng/μL,Cas9 mRNA 50 ng/μL),借助显微注射系统将其注射到受精卵内。将注射sgRNA&Cas9 mRNA 混合物的受精卵移植到经12.5 mg/mL 三溴乙醇腹腔注射麻醉后的假孕ICR 雌鼠输卵管中,将代孕ICR 雌鼠置于独立通气笼盒(individual ventilated cages,IVC)中饲养,待小鼠出生后鉴定基因型。
1.5 Lbp基因敲除小鼠的获得及鉴定
将代孕ICR雌鼠生产的仔鼠作为Founder并命名为F0代,F0代出生2 周后,剪小鼠的脚趾进行编号,使用基因组提取试剂盒提取小鼠基因组。使用正向引物(F: CATTTGTTTGGGAACCCC) 和 反 向 引 物(R:AAGGGCTGGAATGCTAATG)进行PCR 扩增。PCR 反应体系:TSE101 mix 15 μL、上游引物0.6 μL、下游引物0.6 μL、DNA 1.2 μL、ddH2O 2.6 μL。反应条件:94 ℃预变性4 min;98 ℃变性20 s,59 ℃退火40 s,72 ℃延伸55 s,共35个循环;68 ℃延伸10 min;10 ℃保持。PCR 产物进行琼脂糖凝胶电泳,目的条带切胶回收进行平末端克隆、转化、涂板,并挑单克隆测序验证。结合基因组鉴定和测序结果:只出现770 bp 左右的目的条带,且测序显示单链缺失1 457 bp 的判断为Lbp-/-;只出现2 153 bp 左右的野生型(wild type,WT)条带,且测序显示与WT一致的判断为Lbp+/+;出现770 bp 左右的目的条带及2 153 bp 左右的WT 条带,且770 bp 左右目的条带测序显示单链缺失1 457 bp的 判 断 为Lbp+/-。 F0 代 后 新 增 引 物 WT-R(TGCCTGACCCAAGAGGTTT),对引物F/R基因鉴定结果进一步验证:F/WT-R出现810 bp左右的WT条带的为Lbp+/+或Lbp+/-,未出现任何条带的为Lbp-/-。F0 代小鼠进行基因组鉴定测序后,选出Lbp+/-小鼠与WT 小鼠交配,生产的后代为F1代;F1代小鼠基因组鉴定测序后,选出Lbp+/-小鼠自交,生产的后代为F2 代;F2 代小鼠基因组鉴定及测序后,选出Lbp+/-小鼠自交,生产的后代为F3 代;F3 代小鼠继续进行基因组鉴定及测序。
1.6 RT-PCR 测序鉴定Lbp 基因敲除小鼠的mRNA转录
使用Total RNA Kit Ⅱ试剂盒提取组织总RNA,将总RNA 反转录为cDNA, 使用正向引物(F:TGCTCTCTACATTGCTGGGG) 和 反 向 引 物 (R:GGAGGTCCACTGAAATGGTG) 进行PCR 扩增。PCR反应体系:TSE101 mix 10 μL、上游引物0.4 μL、下游引物0.4 μL、cDNA 1 μL、ddH2O 3.2 μL。反应条件:95 ℃预变性3 min;95 ℃变性30 s,52 ℃退火50 s,72 ℃延伸30 s,共35 个循环;72 ℃延伸5 min;10 ℃保持。PCR 产物进行琼脂糖凝胶电泳,目的条带切胶回收后进行平末端克隆、转化、涂板、挑单克隆测序验证。结合PCR 结果和测序结果:只出现121 bp 左右目的条带,且测序显示单链缺失244 bp 的判断为Lbp-/-;只出现365 bp左右WT条带,且测序显示与WT一致的判断为Lbp+/+;出现121 bp 左右目的条带及365 bp 左右WT 条带,且121 bp 左右目的条带测序显示单链缺失244 bp的判断为Lbp+/-。
1.7 蛋白质印迹法检测Lbp 基因敲除小鼠的LBP蛋白表达
因NCBI 及MGI 数据提示LBP 在肝脏中表达量较高,故本实验选取肝脏组织蛋白进行蛋白质印迹实验。取WT 小鼠、Lbp敲除杂合子鼠(Lbp+/-)及Lbp敲除纯合子鼠(Lbp-/-)的肝脏组织,加入预冷的蛋白裂解液与蛋白酶抑制剂,组织破碎后冰上反应30 min,4 ℃14 000×g离心5 min,取上清液并用改良型Bradford 蛋白浓度测定试剂盒测定蛋白浓度。然后加5×蛋白Loading 于100 ℃煮沸10 min,用5%的浓缩胶与8%的分离胶分离蛋白,0.2 A、1.5 V 转膜50 min,5%的脱脂奶粉37 ℃封闭2 h,用预冷的TBST 洗3 次(每次10 min),加入一抗(β-actin 及兔抗小鼠LBP 抗体均1∶1 000 稀释)且4 ℃孵育过夜,第二天用预冷的TBST洗3次(每次10 min),加入二抗(HRP标记的抗兔β-actin IgG 以1∶2 000 稀释,HRP 标记的抗兔LBP IgG 以1∶10 000 稀释)且37 ℃孵育2 h,用预冷的TBST 洗3次(每次10 min),Immobilon Western 化学发光HRP底物(ECL发光试剂)显色后凝胶成像仪成像。
2 结果
2.1 根据Lbp 基因组结构设计CRISPR/gRNA靶点
通过NCBI 及Ensembl 网站查询可知,Lbp基因有5个转录产物,其中3 个可翻译为蛋白质。对该基因蛋白功能保守区域及基因序列相关信息分析发现,2、3号两个公共外显子位于功能保守区BPI/LBP/CETP N 端区,剪切位点位于42~123 aa 处,其蛋白编码区的碱基数为244,非3的倍数,剪切后造成移码突变,从而导致蛋白失活。最终我们选择Lbp-201 作为敲除转录模板。在2号外显子一端与3号外显子中间部位设计靶点,靶点序列信息如表1 所示。针对上述设计的多个sgRNA 靶点,使用sgRNA 体外酶切活性检测试剂盒检测其体外酶切活性,根据靶点活性检测结果,本实验选择Lbp-L4和Lbp-R1作为首选靶点。

表1 针对Lbp基因的sgRNA靶点名称及序列Table 1 Namesandsequencesoflipopolysaccaridebinding protein(Lbp)gene-small guide RNA(gRNA)target
2.2 Lbp基因敲除鼠的鉴定
显微注射后,共获得65 枚生长活性较好的受精卵,将这些受精卵移植到2只假孕的ICR雌鼠中,分娩后共获得17只F0代小鼠,基因组鉴定及测序显示脚趾编号为3、8、10、12、15的小鼠为阳性杂合子鼠(图2A、B),阳性率为22.73%。因F0代3号小鼠770 bp左右目的条带较为清晰,测序显示单链缺失1 457 bp,故将F0 代3 号小鼠与WT 的C57BL/6 小鼠交配,共获得6只F1代,基因组鉴定及测序表明3只小鼠为Lbp+/-。

图2 F0代及F2代Lbp基因敲除小鼠的基因型鉴定结果Figure 2 Genotyping results of F0 and F2 lipopolysaccaride binding protein(Lbp)gene knockout mice
F1 代Lbp+/-鼠间自交共获得12 只F2 代鼠,基因组鉴定及测序表明4 只小鼠为Lbp-/-,5 只为Lbp+/-,3 只为WT。F3 代共获得122 只小鼠,其中Lbp-/-30 只(14♀+16♂)、Lbp+/-61 只(32♀+29♂)、WT 31 只(14♀+17♂),分别占F3 代总数的24.59%、50.00%和25.41%,约为1∶2∶1,符合孟德尔遗传定律且性别比例约为1∶1。
2.3 F2代Lbp基因敲除鼠的mRNA和蛋白鉴定
由Lbp-/-小鼠肝脏组织中mRNA 的RT-PCR 测序结果可知,Lbp-/-mRNA 缺失244 bp,符合设计目的(图3A、B)。序列剪切后mRNA 发生移码突变,拼接成新的mRNA,新序列在剪切位点后第29位(图4B划框位置)对应LBP 的第71 位氨基酸处引入翻译终止信号,导致翻译提前终止,从而无法进行正常翻译。
蛋白质印迹实验结果如图3C 所示,提示Lbp-/-小鼠肝脏不表达LBP。
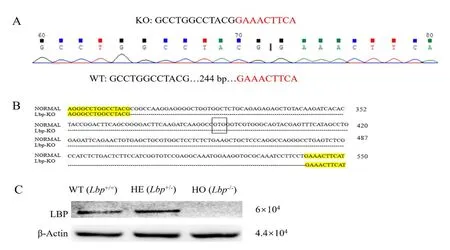
图3 RT-PCR测序和蛋白质印迹法分别检测Lbp基因敲除鼠的mRNA转录及蛋白表达情况Figure 3 The expression of mRNA and protein in liver tissues of Lbp gene knockout mice detected by RT-PCR sequencing and Western blotting
2.4 Lbp基因敲除鼠的表型分析
观察F0、F1、F2、F3 代Lbp-/-、Lbp+/-小鼠的表型发现,与WT相比,其体质量、毛色、窝产仔鼠数量、对外界刺激的反应大小、自发活动等均无明显差异。后续腹腔注射不同剂量(10、20、50、100、150 μL)、质量浓度为1 mg/mL 的LPS,观察不同时间段Lbp-/-、Lbp+/-及WT小鼠的表型,发现WT小鼠随注射剂量的增加,冷颤、发抖、腹泻、眼分泌黏液、行动迟缓等症状加重,甚至出现死亡的现象(150 μL 剂量84 h 死亡);相同条件下Lbp-/-小鼠的症状明显轻于WT 和Lbp+/-小鼠,且没有出现死亡现象。
3 讨论
LPS 作为一种促炎因子及免疫分子,可以刺激机体发生相应的免疫反应,在天然免疫反应中发挥着重要的作用。但过高的LPS 会对机体产生不同程度的伤害,导致机体炎性因子过度释放,严重时可引起多器官功能衰竭、败血症休克等,危及生命[10-11]。LBP的作用主要与炎性反应有关,其在发挥作用时对炎性反应有两方面的影响[12-13]:一是当LPS与LBP 的炎性位点结合时,引起相关转录因子及炎性介质产生,从而起到促炎作用;二是当LPS 结合LBP 的抗炎部位时,它向靶细胞传递信号,中和或消除LPS,阻止LPS发挥作用,从而起到抗炎作用[14]。Lbp-/-小鼠在多种实验研究中均有重要作用,如:Won等[15]以BALB/cLbp-/-小鼠为背景,讨论了低炎性反应下与骨关节炎相关的致病介质;Molinaro 等[16]以MyD88 敲除小鼠为背景,探讨了LBP 的表达对小鼠葡萄糖稳态的影响;宋子晨[17]将SD 大鼠的Lbp基因敲除,研究了LPS 对肝脏线粒体的损害及作用机制。然而,在LBP 这些相关研究中,以C57BL/6JLbp-/-小鼠为背景的相关报告较少。LBP 与LPS 结合的具体作用机制虽有研究,但造成炎性反应的因素较为复杂,LBP 在抗菌、抗炎等方面的作用机制需要进一步揭示[18-20]。
Lbp基因有5 个转录产物,其中Lbp-201、Lbp-202、Lbp-203 可翻译为蛋白质,Lbp-202 的序列为1~123 aa,Lbp-203 的序列起始位点为194 aa。本次实验在设计靶点时考虑到这3 个序列的差异,因此选择对Lbp-201的序列进行剪切,剪切位点位于功能保守区的N 端(42~123 aa),剪切后导致Lbp-201、Lbp-202、Lbp-203 均无法正常翻译,从而达到LBP 失活的目的。本次实验利用CRISPR/Cas9技术构建Lbp敲除小鼠,通过PCR 鉴定及测序验证,F0 代共获得5 只Lbp+/-小鼠,F1 代3 只Lbp+/-,F2 代4 只Lbp-/-、5 只Lbp+/-,F3 代30只Lbp-/-、61 只Lbp+/-。F2 代Lbp-/-DNA 测序结果显示,1 457 bp 缺失符合预期,其RNA 测序结果显示244 bp缺失符合预期。
蛋白质印迹实验结果表明,Lbp-/-小鼠肝脏中LBP不表达,F3代各小鼠基因型和性别数值显示,本次构建获得的Lbp敲除小鼠能够稳定遗传,且符合孟德尔遗传规律。杂合子小鼠继续繁育,即可获得大量可用于后续实验的纯合子敲除鼠。正常情况下Lbp-/-的表型与WT 没有显著差异,但注射LPS 后WT 小鼠的炎性反应显著大于Lbp-/-,由此猜测Lbp-/-虽无法正常表达LBP,但仍会将LPS信号传递给靶细胞,引起机体出现冷颤、发抖等炎性反应,但是此传递过程缓慢,引起的炎性反应程度轻。
综上,本实验利用CRISPR/Cas9 技术成功构建了以C57BL/6J为背景的Lbp-/-小鼠,为进一步探索LBP对C57BL/6J 小鼠肠道菌群的影响,研究LBP 缺失前后LPS对肝、肾等组织免疫调节的影响提供了基础。
[医学伦理声明Medical Ethics Statement]
本研究中动物实验遵循3R 原则,已获得山东省实验动物中心伦理批准(20181224-01)。所有实验过程均遵照实验动物相关法律法规条例要求进行。
The animal experiments involved in this study were carried out in accordance with the principle of 3Rs, and had obtained the ethical approval of Shandong Laboratory Animal Center (No. 20181224-01). All experiment protocols were carried out following the relevant laws and regulations on Laboratory animals.
[作者贡献Author Contribution]
李思迪负责论文撰写及实验实施;付彬、郭中坤负责论文撰写及实验实施指导;林颖杰负责论文实验操作指导;张振宇、米传靓负责论文相关实验操作;王可洲负责实验实施指导、论文撰写及修改指导。
[利益声明Declaration of Interest]
本文所有作者均声明本文不存在利益冲突。
