大鼠急性牙髓炎痛敏模型的疼痛效应评价
2022-09-05赵斯佳何新宇郭春岚
赵斯佳, 何新宇, 景 泉, 马 林, 郭春岚, 万 阔
(中国医学科学院北京协和医院口腔科,北京 100730)
急性牙髓炎(acute pulpitis)是指牙髓组织在病原刺激下发生牙髓炎性病变,其特征是起病急、自发痛、放射痛以及冷刺激可诱发持续剧烈牙痛[1],且口服止痛药的治疗效果不佳。急性牙髓炎的发病率约占急性牙痛患者的45%,是口腔急症就诊的首位疾病[2]。急性牙髓炎的疼痛反应虽然给患者带来巨大痛苦,但其也可以给牙髓炎症状态的诊断提供依据,例如牙齿冷刺激一过性或持续性疼痛,常作为判断牙髓炎症严重程度的标准[1]。目前针对急性牙髓炎疼痛的研究主要集中于对牙髓炎患者进行多种痛觉过敏指标的测量,以及对牙髓炎大鼠进行炎症及疼痛分子指标的检测,而对急性牙髓炎大鼠疼痛症状的效应评价鲜有报告。
建立恰当的急性牙髓炎疼痛效应模型,是推动牙髓炎疼痛机制研究和开发新治疗方式过程中必不可少的重要环节。曾有研究者采用烧热器械接触牙髓炎患牙诱导大鼠嘶叫[3],或对大鼠牙髓炎患牙周围面颊部皮肤或舌体进行触碰引发头部退缩反射[4]等方法进行疼痛模型的评估,然而以上研究均未系统、完整地对大鼠牙髓炎模型进行疼痛效应评价。本研究参考牙髓炎动物的经典造模方法,使用髓腔内置入脂多糖(lipopolysaccharide,LPS) 及亲水暂封材Caviton 暂封造模[5],通过对大鼠牙髓炎症以及若干疼痛行为学指标进行观察,分别从疼痛行为、牙髓组织形态学变化、血清炎性因子表达这3 个方面,验证大鼠急性牙髓炎痛敏模型的有效性,以期为后续牙髓炎疼痛的传导机制及有效镇痛药物的筛选研究提供实验基础。
1 材料与方法
1.1 实验动物
45 只8 周龄SPF 级雄性SD 大鼠,体质量为(220±20)g。购自北京维通利华实验动物技术有限公司[SCXK (京) 2016-0011], 质 量 合 格 证 号 为110011211108238156。大鼠饲养于北京协和医院动物实验中心[SYXK(京)2020-0026]。饲养环境:室温(23±2)℃,12 h循环灯光,自由饮食。本实验方案通过北京协和医院实验动物福利伦理委员会审核批准(伦理审批号:XHDW-2019-019),所有操作均遵循中华人民共和国《实验动物管理条例》及相关要求。
1.2 主要仪器与试剂
异氟烷购自上海恒丰强动物药业有限公司(批号20200303); LPS 购 自 美 国Sigma 公 司(批 号20201210);Caviton 购自日本而至陶齿工业株式会社(批号2012091);4%多聚甲醛组织固定液(批号20200904)、EDTA 脱钙液(批号20200618)和HE 染色试剂盒(批号20201207)均购自北京索莱宝科技有限公司;大鼠白细胞介素1β(interleukin-1β,IL-1β)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)检测用ELISA 试剂盒购自杭州联科生物技术股份有限公司(批号分别为A301B10755、A38210815)。动物麻醉机为天津森迪恒生科技公司产品(型号SD-MIII);大鼠口腔手术用鼻罩为本实验室自制(专利号:ZL 2020 2 2238865.5);冷热板测痛仪为北京众实迪创科技公司产品(型号1056316);Von Frey Hairs Test 触觉纤维丝为美国Stoelting 公司产品(型号Von-Frey);牙齿冷测试仪为南京卡尔文生物科技有限公司产品(型号KW-YL),动物行为视频跟踪分析系统为深圳市腾安科技有限公司产品(型号TSAFE-JK6985)。
1.3 分组与造模
将大鼠适应性喂养1 周后,采用随机数字表法进行分组:45 只雄性SD 大鼠分为空白对照组(SHAM组)、脂多糖组(LPS组)、生理盐水组(NS组),每组15只。LPS组造模方法:2%异氟烷吸入麻醉下将大鼠的右侧上磨牙开髓,表面放置浸满5 g/L LPS 溶液的棉球,待棉球作用30 min后,Caviton暂封;NS组以同样方式封入生理盐水(即0.9%氯化钠溶液);SHAM组仅进行异氟烷麻醉。实验前将每组15 只大鼠随机放入5个笼子中,每笼3 只,分别于造模前(记为0 h)及造模后2 h、24 h、48 h和72 h,随机选取3只大鼠,依次进行自发性疼痛行为学评分、疼痛指标测定及处死取材。
1.4 自发性疼痛行为学评分
分别于造模前及造模后2 h、24 h、48 h 和72 h 将大鼠逐一置于70 cm×70 cm×30 cm(长×宽×高)的有机玻璃透明观察箱中。待大鼠预适应30 min 后,使用架空于实验场上方2 m 的视频跟踪系统记录动物在观察箱内30 min 的行为,记录参数包括活动时间(测试过程中的动作秒数)、面部梳理时间和直立时间。时间记录采用秒表测量后人工计算。
1.5 机械痛阈检测
1.5.1 足机械刺激反射
分别于造模前及造模后2 h、24 h、48 h 和72 h,采用Chaplan 等[6]创建的Up-Down 方法对3 组大鼠进行机械痛阈的检测。测量前将大鼠置于特定的铁丝网上,并盖上透明的有机玻璃罩(20 cm×20 cm×15 cm),使大鼠适应环境30 min。待大鼠安静(停止梳理毛发和探索活动)后,选用不同的Von Frey 刺激丝(力量分别为0.4 g、0.6 g、1.0 g、2.0 g、4.0 g、6.0 g、8.0 g、15.0 g、26.0 g),以4.0 g 开始将Von-Frey 丝垂直刺向大鼠后足的足底中央(避开足垫),垂直用力使其轻微弯曲;每次的刺激时间≤5 s,间隔时间>2 min。当大鼠出现缩足或舔足行为即为阳性反应,记为“X”,下一次更换低一级力度进行刺激;反之,若出现阴性反应(大鼠无缩足或舔足行为),记为“O”,下一次换高一级力度进行刺激。由此可得到一串以“O”或“X”组合的序列。以第一次出现“X”的前一次“O”作为起点,选择包括该起点的连续6 次的检测结果作为推算50%缩足反射阈值(paw withdrawal threshold,PWT)的关键序列。计算公式为50% PWT(g)= 10(xf+kδ)/10 000,式中xf为序列中最末次检测Von Frey 纤维丝的对数值,k为根据检测所得“X”“O”序列查表所得,δ为0.231。
1.5.2 舌机械刺激反射
分别于造模前及造模后2 h、24 h、48 h 和72 h,在2%异氟烷轻度麻醉下,对大鼠造模牙齿侧舌缘(舌尖后方3 mm)部位进行机械刺激,将双极搪瓷涂层不锈钢丝电极放置在头夹肌中记录反射响应肌电图(电极间距离5~6 mm),测定头部退缩反射阈值(head withdrawal threshold,HWT)[7]。具体是用塑料绳轻轻牵动大鼠下颌,拉开大鼠口腔,使用尖端扁平的钳子将0~130 g 的机械刺激作用于造模牙同侧的舌外侧边缘进行机械刺激测试;刺激速度由人工控制,连续从0 g 到阈值,速度约为10 g/s,诱发头部肌电活动改变的机械刺激阈值强度被定义为舌机械刺激HWT。
1.6 冷痛敏检测
1.6.1 足趾冷刺激反射
分别于造模前及造模后2 h、24 h、48 h 和72 h,采用足底冷板测试仪检测两组大鼠患侧缩足反射潜伏期(paw withdrawal latency,PWL)。测量时将大鼠置于透明冷板测痛仪上,室温保持在(25±2)℃。大鼠安静(停止梳理毛发和探索性活动)后,从开始足底冷刺激至大鼠出现抬腿回避时的时间作为大鼠的冷刺激PWL。每只脚测试3次,每次间隔5~6 min,取3次结果的平均值[8]。
1.6.2 牙齿冷刺激反射
分别于造模前及造模后2 h、24 h、48 h 和72 h,在2%异氟烷轻度麻醉下,使用牙冷测试仪对大鼠造模牙齿表面施加逐渐降温至零度的冷刺激,将双极搪瓷涂层不锈钢丝电极放置在头夹肌中记录反射响应肌电图(电极间距离5~6 mm),测定牙齿冷痛敏潜伏期。具体是用塑料绳轻轻牵动大鼠下颌,拉开大鼠口腔,将测试仪探头置于造模牙齿表面;开启仪器,探头从室温降至0 ℃大约需要180 s,降温过程中冷刺激牙齿诱发肌电活动的接触秒数定义为牙齿冷刺激诱发头部退缩反射潜伏期(head withdrawal latency,HWL);采用冷刺激3 次,每次间隔5~6 min,取3 次结果的平均值。
1.7 外周血炎性指标检测
分别于造模前及造模后的2 h、24 h、48 h和72 h,痛阈指标检测完成后,将异氟烷剂量迅速调大至5%;待大鼠失去意识后,采集各组大鼠心脏血液;血液经离心(2 000 r/min)后,留取血清,采用ELISA法测定各组大鼠血清中IL-1β和TNF-α水平。
1.8 牙髓组织病理学观察
3组大鼠分别于造模前及造模后的2 h、24 h、48 h和72 h,5%异氟烷麻醉取血后断颈处死,然后将右侧造模患牙及周围牙槽骨完整取出,用质量分数为4%的多聚甲醛溶液固定,用EDTA溶液浸泡脱钙8周,脱水包埋切片后进行苏木精-伊红染色。光学显微镜下观察组织病理学改变。
1.9 统计学分析
2 结果
2.1 各组大鼠的自发疼痛行为学差异
造模前,3组大鼠的自发性疼痛行为学评分均无明显差异。造模后2 h、24 h、48 h 和72 h,NS 组大鼠面部梳理时间显著多于SHAM 组,同时LPS 组大鼠面部梳理时间明显多于SHAM 组和NS 组(P<0.01 或P<0.05),提示造模后大鼠面部呈现渐进性疼痛(图1A)。造模后48 h,LPS组大鼠的直立时间较SHAM组明显升高(P<0.05),其余组间未见明显差异(P>0.05,图1B)。造模后各组大鼠的活动时间差异均没有统计学意义(P>0.05,图1C)。
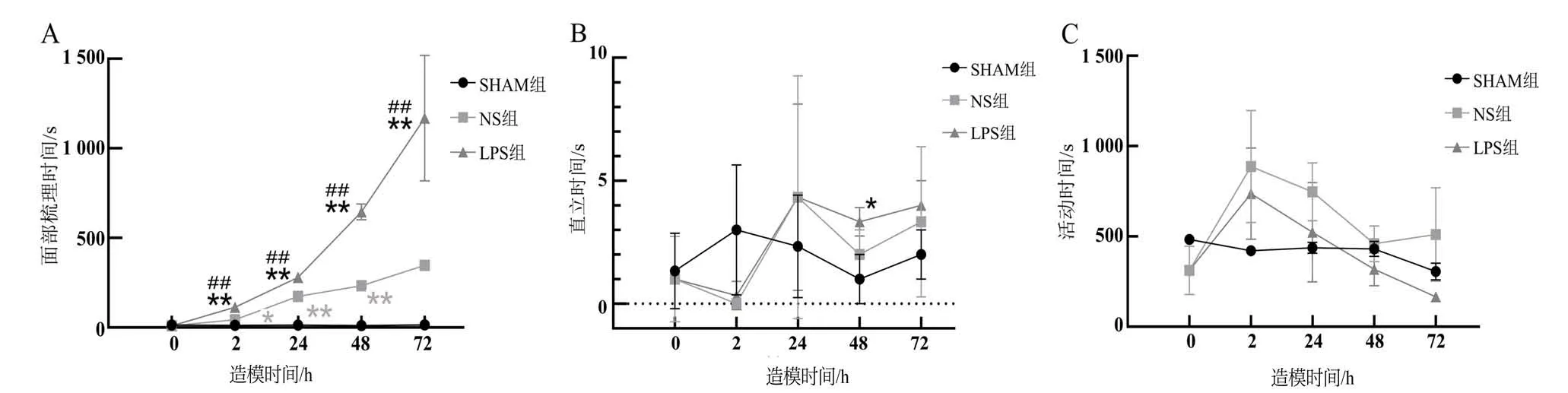
图1 急性牙髓炎模型大鼠自发性疼痛行为学评价Figure 1 Evaluation of spontaneous pain in acute pulpitis model rats
2.2 各组大鼠的机械痛觉过敏行为学差异
造模前,3组大鼠的50%PWT均无明显差异(P>0.05);造模后,LPS 组和NS 组之间大鼠50% PWT 差异无统计学意义(P>0.05)。造模后2 h、24 h、48 h和72 h,NS 组大鼠的50%HWT 明显低于SHAM 组(P<0.01 或P<0.05);造模后2 h、48 h 和72 h,LPS 组大鼠的50% HWT 明显低于SHAM 组(P<0.01 或P<0.05),提示大鼠发生机械痛觉过敏现象(图2A)。
造模前,3组大鼠HWT未见明显差异(P>0.05);造模后72 h,3组间HWT 也未见明显差异(P>0.05)。造模后24 h,NS 组大鼠的HWT 明显低于SHAM 组(P<0.01);造模后2 h、24 h 及48 h,LPS 组大鼠的HWT明显低于SHAM组及NS组(P<0.01),提示大鼠出现面部机械痛觉过敏(图2B)。
2.3 各组大鼠的冷刺激痛觉过敏差异
造模前,3 组大鼠PWL 均无明显差异(P>0.05)。造模后2 h,NS 组大鼠PWL 较SHAM 组明显升高(P<0.05);造模后48 h,NS 组大鼠PWL 较SHAM 组明显降低(P<0.05);造模后48 h和72 h,LPS组PWL较SHAM组明显降低(P<0.01);造模后72 h,LPS组PWL 较SHAM 组 及NS 组 明 显 减 低(P<0.01)(图2C)。
造模前,3组大鼠HWL均无明显差异(P>0.05)。造模后2 h 和24 h,NS 组大鼠较SHAM 组大鼠的HWL明显降低(P<0.01,P<0.05);造模后2 h、24 h、48 h和72 h,LPS组较SHAM组大鼠的HWL明显降低(P<0.01或P<0.05);造模后的2 h和48 h,LPS组较NS组大鼠的HWL 明显降低(P<0.01 或P<0.05),提示大鼠出现牙齿冷刺激痛觉过敏(图2D)。
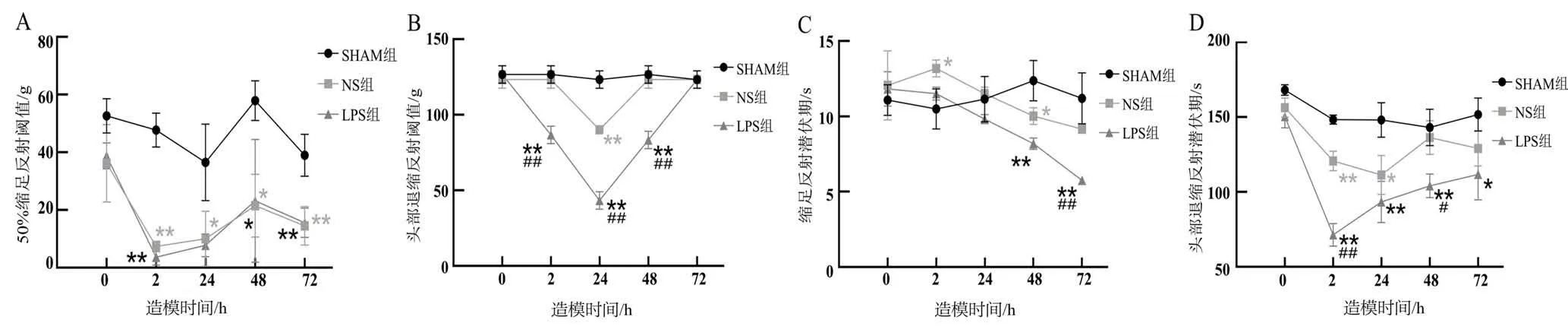
图2 急性牙髓炎模型大鼠机械刺激及冷刺激下的痛阈变化Figure 2 Mechanical and cold pain threshold of acute pulpitis model rats
2.4 各组大鼠的患牙组织病理学变化
HE 染色结果提示,造模后24 h,LPS 组可见穿髓点下方呈现以中性粒细胞浸润为主的急性浆液性炎症,局部充血;成牙本质细胞层排列稍紊乱;部分牙髓变性坏死,根髓基本正常(图3A)。NS 组与LPS 组情况基本相同(图3E)。SHAM 组成牙本质细胞排列规则,未见明显的炎性细胞浸润及血管扩张(图3D)。
造模后48 h,LPS 组穿髓点周围呈现部分灶性坏死,中性粒细胞浸润较前更为明显;成牙本质细胞层排列稍紊乱;根髓充血(图3B)。NS 组与LPS 组情况基本相同(图3F)。
造模后72 h,LPS组冠髓区范围扩大,累及上段根髓,周围有大量粒细胞和部分单核-巨噬细胞浸润,偶见淋巴细胞;炎细胞浸润区周围可见少量纤维组织包绕,成纤维细胞增生,部分细胞呈环状排列;根髓小血管明显扩张,根髓成牙本质细胞排列紊乱、变性,无炎细胞浸润(图3C)。与LPS 组相比,NS 组炎症表现程度较轻(图3G)。
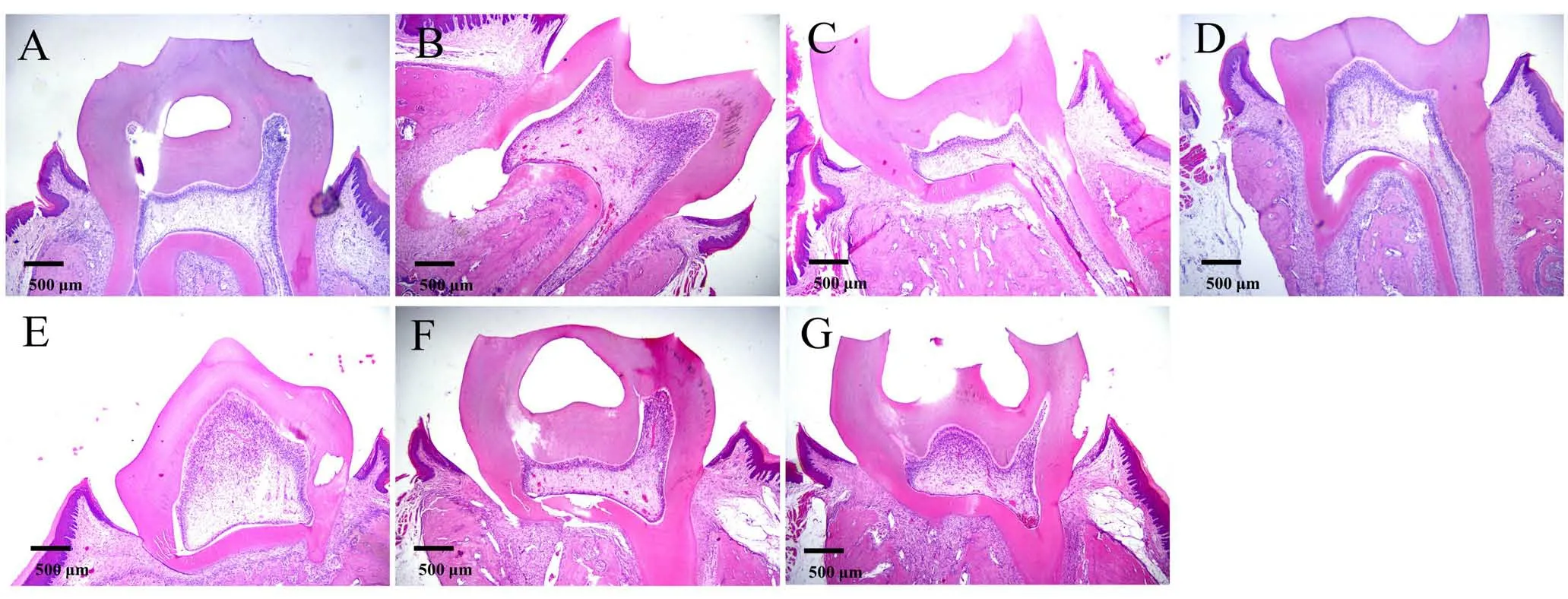
图3 LPS和NS诱导大鼠急性牙髓炎的组织病理变化(HE,40倍)Figure 3 Histopathological changes of LPS and NS induced acute pulpitis in rats(HE,×40)
2.5 各组大鼠的血清IL-1β和TNF-α蛋白表达水平
造模后,LPS组和NS组大鼠血清中IL-1β和TNFα蛋白表达水平显著高于SHAM组(P<0.01),并均在造模后48 h 达到最高值;造模后24 h 和48 h,LPS 组IL-1β 蛋白表达水平显著高于NS 组(P<0.01);造模后2 h、24 h、48 h 和72 h,LPS 组TNF-α 蛋白表达水平明显高于NS组(P<0.01或P<0.05)(图4)。
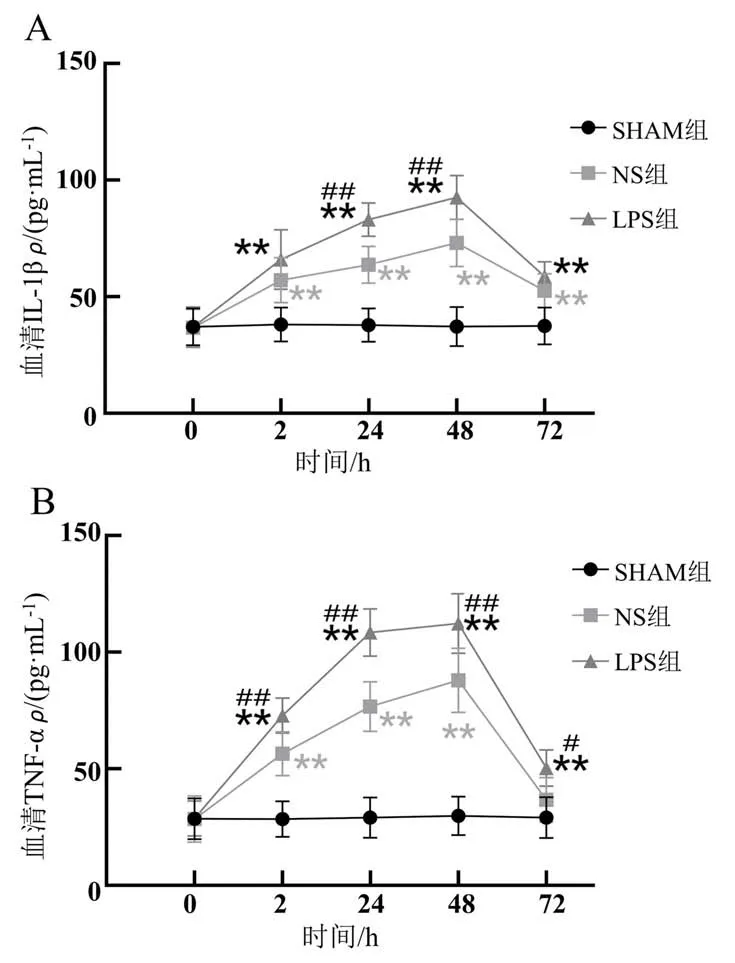
图4 急性牙髓炎模型大鼠血清炎症因子水平变化Figure 4 Changes in serum inflammatory factors in acute pulpitis model rats
3 讨论
急性牙髓炎痛敏评价模型的建立是研究牙痛传导机制的基础。通过在动物模型上模拟临床急性牙髓炎的发生发展过程,研究者可以重现急性牙髓炎的症状体征以及病理改变,并进一步探究牙髓炎的发病机制及开发牙痛治疗新方法。目前,国内外有多种成熟的牙髓炎造模方法,然而对牙髓炎动物模型的痛敏评价较为简单粗糙,缺乏一个完善的系统。
由于疼痛效应测量体系的影响因素复杂多样,因此选择稳定的急性牙髓炎造模方法,稳定可控地完成疾病模型的建立十分重要。牙髓炎的病理改变可分为三种类型:Ⅰ型为牙髓轻度损伤无坏死;Ⅱ型为中度牙髓损伤,牙髓部分坏死;Ⅲ型为不可逆性牙髓炎,牙髓逐步坏死并出现全身炎性反应[9]。本研究选取稳定的Ⅲ型牙髓病理结果作为造模标准,并进行痛敏评价。目前,不可逆性牙髓炎的造模方法主要包括LPS诱导法、弗氏佐剂诱导法、软龋置入法、牙髓暴露法等[10]。由于弗氏佐剂诱导大鼠牙髓炎的病程较长,软龋置入法具有较大的操作误差,牙髓暴露法将牙髓直接暴露于口腔环境,因此均不利于建立稳定的急性牙髓炎模型。LPS 是革兰阴性菌细胞壁的组成部分,广泛存在于组织炎性反应中[11]。本研究采取LPS诱导法进行大鼠急性牙髓炎的造模。病理结果显示,造模后24~72 h,LPS模型组冠髓区域出现充血至灶性坏死表现,炎症范围逐渐扩散至根髓区域。顾斌等[12]采用将LPS 纸尖封入窝洞后暂封的方法,由于纸尖吸纳的LPS 剂量大,病程进展较快,造模后48 h 可见冠髓区脓肿明显,根髓散在大量中性粒细胞,部分动物出现牙槽骨脓肿。牙髓暴露法建立牙髓炎模型的相对病程较长,造模后7~14 d 患牙的冠髓及根髓相继坏死[10,13-14]。
急性牙髓炎的疼痛表现多样,包括自发牙痛、临近组织放射痛和冷刺激诱发神经痛[15]。目前,牙髓炎疼痛的传导机制尚不明确。有学者提出,牙髓炎机械刺激及冷刺激疼痛可能是外周感受器和中枢神经系统敏化[16]共同导致的痛觉超敏现象[17]。曾有多位学者建立大鼠牙髓炎模型并进行疼痛评价,但检测部位多为牙齿旁边组织如面部皮肤、舌体组织,检测类型多为机械痛阈的测定[4,7-19]。虽然面部皮肤、舌体、牙髓均为三叉神经分支的分布区域,但牙齿与软组织在解剖结构上存在明显差异。目前的研究存在缺少对牙齿痛阈的检测、痛阈类型测量不够全面、外周与中枢敏化检测尚未得到有效区分等问题。因此,需要新的痛敏评价体系对大鼠疼痛状态进行包括患牙在内多部位、多方法的系统性评价。
本研究结果显示,在自发痛行为评价中,LPS 组与NS组的大鼠面部梳理时间均随牙髓炎的炎症程度加重而显著增加,与Lin等[4]研究一致。LPS组与NS组存在显著差异,可见面部梳理时间可较为准确地反映大鼠牙髓炎自发痛的程度。活动时间和直立时间分别反映了大鼠自发行为和探索行为[18]。本研究并未直接评估颌面部大鼠行为,对口腔颌面部疼痛评估的特异性欠佳。本实验发现,造模后大鼠足爪50% PWT 和HWT 明显降低,提示外周及中枢机械痛觉过敏的发生,与Ohara 等[7]和Watase 等[19]学者的研究结果一致。本实验中,对造模后不同时间的血清炎症因子IL-1β和TNF-α进行检测,结果显示,IL-1β和TNF-α在造模后升高,并在术后48 h 达到峰值。Lin 等[4]研究表明,急性牙髓炎模型大鼠血清炎症因子IL-1β 和TNF-α水平在术后1 d时显著升高。IL-1β和TNF-α可增加神经元的兴奋性和敏感性,从而导致温度及机械痛觉过敏。此外,Worsley 等[20]也证实,大鼠牙髓炎症可导致长期中枢致敏改变。
此前尚无大鼠急性牙髓炎的冷刺激痛觉过敏研究。本实验结果发现,LPS 组与NS 组大鼠牙齿冷刺激痛觉过敏阈值降低,且两组间存在显著差异;而足爪冷刺激阈值差异不明显,与临床研究结果存在一致性。临床研究显示,不可逆性牙髓炎患者的口内机械痛觉过敏及冷痛觉过敏反应的发生率明显高于健康人群[21],牙本质过敏[22]和不典型牙痛患者[23]的牙齿冷刺激敏感程度均有升高,而全身冷刺激阈值无明显改变。因此,牙齿冷刺激痛觉过敏可能仅与牙齿内部神经元改变有关。最近一项研究通过体外制备小鼠下颌神经超活体模型发现,成牙本质细胞是牙齿冷传导的起始部位[24]。
综上所述,本实验成功建立了大鼠急性牙髓炎痛敏评价模型,该模型可有效引发大鼠的局部牙髓炎症状,疼痛效应评价符合牙髓炎患者的临床测试结果。由于实验研究对象是大鼠的主观感受,在模型动物以及实验者主观感觉判断上均存在一定程度的不稳定性,因此导致本实验中部分痛阈指标存在标准误较大的情况;但是血清学检测结果相对稳定,证实了本研究造模的可信性。此外,本实验还存在着疼痛评价较为复杂、疼痛机制研究不够深入等问题,仍需要继续探索。总之,急性牙髓炎痛敏模型对牙髓炎疼痛传导、外周及中枢致敏机制以及牙痛治疗方法研究具有重要的应用价值,值得进一步推广。
[医学伦理声明Medical Ethics Statement]
本研究涉及的所有动物实验均已通过北京协和医院实验动物管理与伦理委员会审查批准(伦理审批号:XHDW-2019-019)。所有实验过程均遵照实验动物相关法律法规条例要求进行。
All experimental protocols in this study were reviewed and approved by Experimental Animal Ethics Committee of Peking Union Medical College Hospital(Approval Letter No. XHDW-2019-019),and all experimental protocols were carried out following the guidelines such asAnimal Management Regulations(01/03/2017),Laboratory Animal:Guideline for Ethical Review of Animal Welfare(GB/T 35892—2018) and ARRIVE 2.0.
[作者贡献Author Contribution]
赵斯佳负责实验设计、采集分析数据和文章撰写;何新宇负责实验内容补充整理和文章修改指导;景泉负责实验相关英文材料的翻译和整理;马林和郭春岚负责实验指导和技术支持;万阔负责实验指导和经费支持。
[利益声明Declaration of Interest]
所有作者均声明本文不存在利益冲突。
