皮肤致敏性替代试验方法的研究进展
2022-09-05黄静怡李培宁刘香梅刘忠华黄宇锋
黄静怡, 李培宁, 刘香梅, 刘忠华, 黄宇锋
(1. 华南农业大学兽医学院,广州 510630; 2. 广州质量监督检测研究院,广州 511447)
过敏性接触性皮炎(allergic contact dermatitis,ACD) 是由低分子量化合物(low molecular weight,LMW)与存在于皮肤中的内源蛋白结合形成的Ⅳ型超敏反应。ACD 的临床症状通常表现为皮肤瘙痒、红斑及丘疹等。LMW普遍存在于化学品、药品以及个人护理用品中,LMW与皮肤的频繁接触会导致ACD发病率增加。研究表明,在欧洲特定人群中,ACD 的患病率高达18.6%,占西方世界工作人口中所有职业性皮肤病的85%~90%[1]。因此,ACD 已经成为一种职业性皮肤病,在一定程度上影响了人类的正常生活和工作。
传统的皮肤致敏性测试通常采用的是动物实验,譬如豚鼠最大值试验(guinea pig maximization test,GPMT)、Buehler 封 闭 斑 贴 试 验(Buehler test,BT)等。然而,随着近年来毒理检测技术的进步、研究方法的更新、动物伦理被越来越多的国家重视和关注,皮肤致敏性测试替代方法的开发就显得尤为重要。因此,本文结合国内外研究进展,就体内替代致敏方法、基于有害结局通路(adverse outcome pathway,AOP)机制的体外替代方法以及基因组过敏原快速检测法(genomic allergen rapid detection,GARD)等目前几类皮肤致敏性测试替代方法进行综述。
1 体内替代方法
皮肤致敏体内替代方法是指使用小鼠替代豚鼠作为实验动物主体,建立小鼠局部淋巴结测试法(local lymph note assay,LLNA)。根据LLNA 法的优点和局限性,研究人员开发了基于LLNA 法的改良方法,即5-溴 脱 氧 尿 嘧 啶 核 苷 (5-bromo-2-deoxyuridine,BrdU)-酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)-LLNA 法和LLNA-内源性三磷酸腺苷(adenosine triphosphate,ATP)检测法。
1.1 基础的LLNA法
LLNA是鉴别化学物质是否具有致敏潜力的替代测试方法之一,已被欧盟67/548/EEC 指令认可。LLNA是以致敏物能诱导皮肤接触部位引流淋巴结中的T 细胞活化增殖为基础,将被放射性物质标记的核酸(如3H-甲基胸腺嘧啶脱氧核苷、125I-碘脱氧尿嘧啶核苷等)由尾静脉注入小鼠体内[2],5 h后取诱导部位淋巴结制备单细胞悬液,测定T细胞增殖情况。
该方法的检测指标有两个。一是刺激指数(stimulation index,SI),即受试组与对照组增殖T细胞的比值,该指标用于判断受试物是否为致敏剂。当SI≥3 时,受试物被判定为致敏剂[3]。另一个检测指标是SI=3时的有效化学品浓度(effective chemical 3,EC3),该值可以通过剂量-反应数据的线性差值得出[4],用于受试物的致敏能力分级。根据欧洲化学品生态毒理学和毒理学中心公布的数据,当EC3<0.1%时,受试物判定为极强致敏剂;当EC3在0.1%~1%时,受试物为强致敏剂;EC3在1%~10%时,受试物为中度致敏剂;EC≥10%,则为弱致敏剂[5]。
LLNA法具有周期短、实验动物使用量少、判定方法更为客观准确等优点,同时不需用弗氏佐剂来刺激受 试 动 物, 符 合 3R (reduction、 repIacement、refinement)原则。LLNA 法已于2010 年被世界经济合作与发展组织(Organization for Economic Co-operation and Development,OECD)纳入皮肤致敏检测方法指南[6]。值得一提的是,LLNA 法易被受试物的溶解性所限制。因水溶性大分子物质很难在小鼠的皮肤上涂抹均匀并被吸收[7],因此该方法只适用于脂溶性的小分子物质。
1.2 已通过验证的LLNA改良法
1.2.1 BrdU-ELISA-LLNA法
2003 年,Takeyoshi 等[8]利用示踪剂代替放射性标志物建立了LLNA 的改良方法,即BrdU-ELISALLNA(又称LLNA:BrdU-ELISA)。其在原理和检测指标方面,与LLNA 法基本一致,但在核酸标志物方面改用与胸腺嘧啶结构相似的BrdU。即在末次染毒24 h 后腹腔注射BrdU,处死小鼠取淋巴结,称重后制备细胞悬液,然后采用ELISA 法检测增殖细胞中BrdU的标记数。
该方法综合了LLNA 试验周期短、动物用量少、判定方法客观的优点,还解决了LLNA 法使用放射性标记物的安全性问题。在OECD 指南中,该方法推荐使用CBA 小鼠,但这种品系的小鼠在我国供应数量较少,且价格偏贵。因此,有学者通过对比分析BALB/c和CBA 两种品系小鼠用该方法试验的结果,证实可以使用BALB/c 小鼠替代CBA 小鼠进行LLNA:BrdUELISA法检测[9]。除此之外,该法腹腔注射BrdU时会使小鼠痛苦,不符合动物福利。基于此,有研究团队改进了LLNA:BrdU-ELISA 法,先给小鼠耳部染毒后处死,取耳后引流淋巴结,在含有BrdU的培养基中体外培养淋巴细胞24 h后,再对淋巴细胞中的BrdU含量进行测定[10]。
1.2.2 LLNA-ATP检测法
LLNA-ATP 检测法(又称LLNA:DA) 是基于ATP水平与活细胞数呈正相关,并且可与荧光素-荧光素酶复合物作用产生可测定光这一原理,因此可以通过生物荧光法检测细胞中ATP 的含量来确定受试物的致敏性[11]。该法选用的测试指标包括ATP发光值、淋巴结质量、增殖的淋巴细胞数,以及SI和EC值[12]。
该方法具有LLNA:BrdU-ELISA 法的全部优点,但因将ATP 数量作为测试指标,有着明显的局限性。(1)时间限制:动物死后体内ATP 数量会逐渐下降,若长时间不进行测定,测试结果会出现偏差。因此,OECD 指南明确规定待测样本从取材到检测的时间应在20 min以内[13]。(2)假阳性:为解决这个问题,有研究人员提出,可以同时开展耳重、耳厚差等活组织检测以及红斑评级,以排除受试物的刺激性对结果的影响[14]。(3)该法不适用于影响ATP生成和稳定性的受试物,例如ATP抑制剂等[14]。
2 基于AOP的体外替代方法
2007 年,由美国国家科学研究委员会首次提出AOP,用以描述皮肤敏化从分子起始事件到系统敏化效应产生过程中的一系列反应事件。2012 年,OECD提出将皮肤变态反应的体外研究方法整合,建立基于AOP原理的皮肤致敏预测方法[15-16],包括直接反应肽试验(direct peptide reactivity assay,DPRA)、氨基酸衍生物反应性测定(amino acid derivative reactivity assay,ADRA)、KeratinoSensTM/LuSens试验和人细胞系活化试验(human cell line activation test,h-CLAT)。
皮肤致敏AOP 机制由4 个要素组成:(1)起始事件(molecular initiating event,MIE)是抗原和皮肤蛋白结合形成免疫复合物半抗原;(2)角质细胞反应是半抗原被角质细胞摄取,发生炎性反应,产生的炎性因子激活树突状细胞(dendritic cells,DCs);(3)DCs反应是DCs 被激活后摄取呈递抗原,表面特异性标志物表达上升,释放的细胞因子激活T 细胞;(4)组织/器官层次事件是DCs 提呈相容性复合物(major histocompatibility complex,MHC)后迁移至淋巴结,T细胞识别MHC 形成特异性T 细胞,当机体再次接触同种抗原时发生ACD。与毒性反应不同,AOP 最关键的特征是以可检测到的4 种分子事件的定向关系为研究要点[17]。
2.1 DPRA化学法
Gerberick 团队于2004 年开发了DPRA 法,该方法模拟致敏物质与皮肤蛋白共价结合形成半抗原(即AOP 通路中起始事件)的过程。采用化学方法将致敏原与谷胱甘肽以及半胱氨酸和赖氨酸多肽的肽模板反应结合,再使用高效液相色谱-紫外线检测(high performance liquid chromatography-ultraviolet,HPLC-UV)测定两种结合抗原的消耗情况,以此来判定受试物致敏能力[18]。其检测结果与LLNA法的一致性可达到89%。该方法已于2015年被OECD收录至TG 442C指南[19]。
目前该法主要用于单一化学品或化妆品原料的致敏测定,未能应用到化妆品成品检测。2009 年,Gerberick等[20]对DPRA法进行了改良,在反应体系中加入了辣根过氧化物酶-过氧化氢,使该方法拥有检测抗原前体物的能力,扩大了检测范围,为拓展DPRA法的应用范围打下了强有力的基础。
为了提高检测通量、灵敏度及准确性,Wei等[21]开发了一种基于384 孔板的快速固相萃取(solid phase extraction,SPE)-串联质谱(tandem mass spectrometry,MS)-DPRA自动化快速检测法。与HPLC-UV法相比,SPE-MS通量从每份样品的16 min缩短到10 s,底物使用量也从100 mmol/L 减少到5 μmol/L,大大提高了检测效率。
2.2 ADRA法
化学方法代替动物实验进行皮肤致敏测试的局限性在于,HPLC-UV分析中待测化学品与亲核试剂的共同洗脱,导致无法准确量化未反应的亲核试剂以及预测待测物的致敏能力[22]。为解决这个问题,Fujita等[23]开发并验证了一种新型的皮肤致敏替代方法,即ADRA法。
该方法的原理与DPRA 法类似,同样模拟AOP 通路中的起始事件,只是在使用HPLC-UV 定量时改为281 nm 进行,提高了基线稳定性。该方法中使用的亲核试剂是由Fujita团队制定合成的两种氨基酸衍生物乙酰半胱氨酸(N-acetyl-L-cysteine,NAC)和乙酰赖氨酸(N-α-acetyl-L-lysine,NAL)[24]。ADRA 法测试终点为NAC/NAL 的反应性,即根据待测物中未反应的NAC/NAL 浓度相对于对照组平均浓度下降值而计算出的消耗百分比。
2019年,Fujita团队通过改用荧光检测开发了新的ADRA-荧光检测法(ADRA-fluorescence detection,ADRA-FL)[25]。相对于传统ADRA 法使用HPLC-UV和高效液相色谱-荧光法(high performance liquid chromatography-fluorescence, HPLC-FL), ADRA-FL
测量NAC和NAL时拥有更高的灵敏度和信噪比(指电子设备或者电子系统中信号与噪声的比例)。研究人员对化妆品常用植物提取物溶液(芦荟、甘草、绿茶)分析的结果显示,该方法存在预测多成分物质致敏风险的可能性,但因受试物中含有免疫抑制剂,故无法评估免疫抑制效应。
2.3 KeratinoSensTM/LuSens试验
半抗原由抗原和皮肤蛋白结合生成,当其接触表皮角质形成细胞后,可引起氧化应激反应(即关键事件2)。在机体发生氧化应激时,抗氧化应激感受器的主要调控因子Kelch 样ECH 相关蛋白1(Kelch-like ECH-associated protein 1,Keap1)与核转录因子E2 相关 因 子2 (nuclear factor erythroid 2 related factor 2,Nrf2)相互作用,对改善氧化应激至关重要[26]。
基于上述原理,研究人员开发了两种来源于角质细胞水平的测试方法KeratinoSensTM和LuSens试验。这两种检测方法的区别在于抗氧化反应元件(antioxidant response element,ARE)不同:KeratinoSensTM试验的ARE 来源于人的AKR1C2(Aldo-keto reductase family 1 member C2)基因,而后者来自大鼠的NQO1(NAD(P)H quinone dehydrogenase 1)基因[27]。两种基因均含荧光素酶,因此都以荧光素酶的诱导倍数(fold of induction,FI)作为评价指标[27],当FI>1.5时可判断受试物为致敏物。
有研究表明,与人类皮肤致敏数据以及LLNA 测试结果相比,KeratinoSensTM试验的准确率分别为94%和93%,而LuSens 试验稍低,分别为83%和74%[28]。目前,KeratinoSensTM试验已被纳入OECD 指南442D中[28],而LuSens试验还处于验证阶段。
2.4 h-CLAT法
h-CLAT 法的开发基于AOP 通路的关键事件3 和4(即DCs事件和组织/器官层次事件)。将急性单核细胞白血病THP-1细胞暴露于无细胞毒性的受试物中24 h,终止暴露后收集细胞,利用流式细胞仪测定细胞表面表达物CD86和CD54的相对荧光强度变化[29],以此为依据判定待测物是否具有致敏性。
该测试方法需要重复3次试验,且保证2次试验结果均为有效,才能进行下一步判定。将结果与阴性对照组进行比对,如CD86>150%且CD54>200%,则表明THP-1 细胞被活化,判定受试物为致敏剂。研究表明,h-CLAT 法与LLNA 法的试验结果一致性为84%[30]。2018 年,该方法被OECD 纳入毒理学测试指南[31]。
治疗前两组患者的SAS、SDS评分对比差异并不显著,P>0.05;治疗前后比较两组差异显著,P<0.05;组间比较差异具有统计学意义(P<0.05)。见表2:
袁园等[32]通过对h-CLAT 法验证的10 种物质分别采用CCK-8细胞增殖/毒性检测法和流式细胞仪法进行检测,结果显示两种方法的组内相关系数为0.993,一致性很高。此外,研究人员还发现将IL-8 与CD86结合作为检测终点也能够对致敏物进行判定[33]。同时,该方法也可以用于筛选致敏生物标志物。Karkhanis 团队于2021 年利用强致敏剂1-氯-2,4-二硝基苯(1-chloro-2,4-dinitrobenzene,DNCB)、中等强度致敏剂二氯化镍(NiCl2)以及阴性对照二甲基亚砜(dimethyl sulfoxide,DMSO)处理TPH-1 细胞,通过RNA 测序确定了5 种新型的h-CLAT 标志物:CD109、CD181、CD183、CLEC5A和CD354[34]。
3 基于基因组学的过敏原快速检测法
随着基因组学技术的发展以及对皮肤变态反应发生机制的研究不断深入,研究人员将目光投向了基因组学方面。2011 年,Johansson 等[35]发现了一种细胞系——人类急性髓细胞白血病细胞系MUTZ-3,其在转录和诱导特异性T细胞产生应答等方面与DCs相似。MUTZ-3 分化后其免疫相关表型类似于未成熟的DCs,表达CD1d、MHCⅠ和MHCⅡ呈递抗原,并诱导特异性T细胞增殖。
变态反应产生的生物标志物能够对致敏物和非致敏物进行识别,并出现不同转录结果。因此,这些不同致敏剂的有效预测指标统称为GARD 预测信号(GARD predictive signals,GPS)。GPS包括与先天免疫反应信号、DCs 成熟、应激反应和外来物质识别相关的基因,有着完整的能够识别和监测皮肤致敏中各种关键事件的能力。基于这一原理,研究人员建立了一种基于MUTZ-3 细胞的GARD 法。该方法的判断终点是根据GPS 的转录水平,使用支持向量机(support vector machine,SVM) 赋予待测样本一个决定值(decision value,DC)。DC>0,为致敏剂;DC≤0,则为非致敏剂[36]。
GARD 是一种基于基因组读数、新型且灵活的体外致敏评估法,该方法可测试200 个与致敏相关的基因转录组的变化。这些基因的生物标志物特征包括参与氧化应激、DCs 成熟以及细胞因子反应的转录本[37]。体内完整基因组所带来的巨大的多功能性,为进一步发展和拓宽皮肤致敏分析方法提供了条件,也为进一步了解体内致敏的过程提供了参考。其次,整体基因组读数提供的大量信息,还可用于特定信号或代谢途径机制的研究[38]。此外,GARD法还可用于判定呼吸致敏剂,如Masinja 等[39]发现了一种能够区分呼吸致敏剂和非致敏剂的生物标志物,并整理在尚未公开的数据库中。
4 皮肤致敏替代方法的比较分析
随着毒理学技术不断发展以及人类对动物实验越来越重视,研究人员逐步将目光投向皮肤致敏试验替代方法的开发验证。因而,越来越多的替代方法如LLNA、LLNA:BrdU-ELISA、DPRA、GARD等相继出现,并通过验证。
如表1 所示,各种替代方法均有不同的优缺点。这些方法的优势大多集中于实验动物的使用量减少,甚至是使用细胞替代了实验动物,灵敏度和准确度较高,以及测试时间缩短等方面。但各个方法的局限性也很突出,尤其是结果假阳性以及对待测物的性质和溶解度要求较高等问题。皮肤致敏AOP 是一个完整的生物过程,而现有的替代方法无法完全覆盖整个通路,因此有必要通过组合方法来改善。
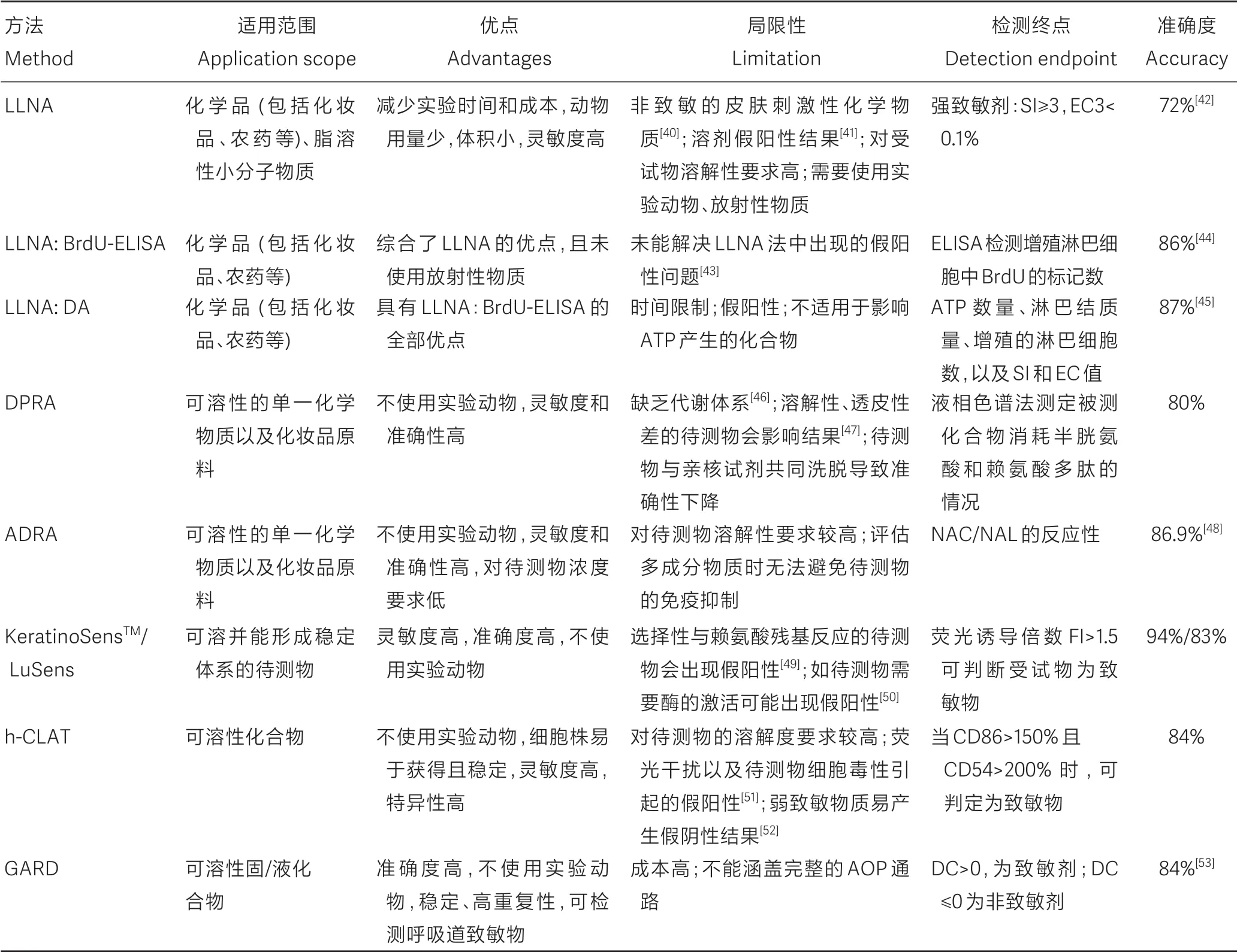
表1 皮肤致敏替代方法的比较Table 1 Comparison of alternative methods of skin sensitization
5 整合策略与评估方法
皮肤变态反应是一个极为复杂的过程,凭借单独的体外测试方法无法完整获取皮肤致敏信息,若对皮肤致敏反应进行更进一步的探索,则需结合各种替代方法的灵敏度、优缺点等方面建立方法组合策略。因此,OECD 于2016 年发布了整合策略与评估方法来评价未知化合物的致敏性及其致敏效力。整合策略与评估方法是一种基于科学、实用的化学危害特征描述方法,即依据现有的化学结构特征信息、毒理学信息、计算机模型、体外实验结果进行的综合分析及整合测试策略,以评价受试物的致敏性和风险类别[54]。
定量构效关系(quantitative structure activity relationship,QSAR)是通过分析现有的某一系列具有相同生物活性且结构相似的化合物,以其理化或结构参数为自变量,生物活性为因变量,利用数理统计方法,建立化合物结构与其生物活性之间的定量关系[58]。QSAR 系统能够对多个毒理学终点进行预测。近年来,研究人员尝试将其应用到化妆品皮肤致敏性评价中,开发了类似的皮肤渗透性QSAR 模型,并阐明了化合物的皮肤渗透性与致敏性之间的关系[59]。同时,采用计算机模拟QSAR 软件进行化妆品毒理学评价,也得到了越来越多的重视,例如化合物毒性预测工具树(toxic hazard estimation,Toxtree)、OECD 开发的QSAR 工具箱(OECD QSAR Toolbox)、组织新陈代谢 模 拟 器(tissue metabolism simulator,TIMES-SS)等[60]。但这类软件是作为单一致敏评估方法来开发和验证的,因此一些国外大型日化企业将基于AOP 通路的皮肤致敏替代方法与这些QSAR 软件结合后自主开发出皮肤致敏测试整合策略。
目前,OECD 在整合策略与评估方法指导文件中纳入的整合策略大都由国外大型日化企业开发,例如德国巴斯夫(BASF) 公司开发的“3 选2”原则(BASF‘2 out of 3’)、美国宝洁(P&G)公司开发的贝叶斯网络整合测试策略(Bayesian network integrated testing strategy)、法国欧莱雅(L’ORÉAL)公司开发的堆叠元模型(Stacking Meta-mode),以及日本资生堂(Shiseido) 公司开发的人工神经网络分析法(artificial neural network)等[61]。
5.1 “3选2”原则
该方法由德国巴斯夫公司开发,综合了DPRA、KeratinoSensTM/LuSens 和h-CLAT 这3 种单一替代试验方法[62],该方法覆盖了AOP中至少两个关键事件。其判定方式为:若3种试验中有2种结果呈阳性,则判定受试物为致敏剂,反之则为非致敏剂。与单一试验相比,该整合策略预测结果的准确率为81%~88%。
5.2 贝叶斯网络整合测试策略
该方法由美国宝洁公司开发,在涵盖了DPRA、KeratinoSensTM和h-CLAT 这3 种单一替代方法的基础上,增加了TIMES-SS基于受试物结构的预测以及生物利用度等数据信息[63-64]。该方法主要应用于致敏性及致敏效力的判断。与LLNA 结果相比,致敏性判定的准确率为100%,致敏效力分级的准确率为89%。
5.3 堆叠元模型
该方法由法国欧莱雅公司开发,在结合了覆盖AOP的3个关键事件的DPRA法、KeratinoSensTM法和骨髓U937细胞皮肤致敏试验(bone marrow U937 cell skin sensitization test,U-SENSTM)这3种单一替代方法的基础上,又增加了两种分析工具TIME-SS、Toxtree 以及受试物的理化性质,进而结合5 种不同的统计方法组合而成[65]。该模型的判定方式为:对5种不同统计方法给出的数据进行分析后,根据定义阈值判定受试物是否具有致敏性[66]。与单一试验方法相比,该方法的准确性为93%。
5.4 人工神经网络分析法
该方法由日本资生堂公司开发,覆盖了AOP 关键事件1~3,同时综合了受试物的理化性质和计算机模拟参数,构成一个非线性统计模型[67]。该方法将DPRA 法、KeratinoSensTM法、ARE、h-CLAT 法和硫醇基蛋白反应性测试作为单一元素,利用模型对单一元素的不同组合进行回归分析,判定受试物的致敏性及致敏效力[68]。与LLNA 法相比,该模型的准确性为91%。
6 小结
随着对皮肤致敏机制的深入研究,从LLNA 法到基于AOP 通路建立的替代试验,以及基于体内皮肤致敏过程所建立的整合策略已经逐步建立,但目前我们所掌握的AOP 通路还只是很小的一部分,任何体内外替代方法都无法完整模拟致敏后体内的真实反应。因此,建立皮肤致敏替代试验仍然面临着巨大的挑战,寻找能够模拟出皮肤变态反应整个过程或是关键步骤的替代方法将会是未来皮肤致敏替代方法研究的发展趋势。另一方面,伴随着基因组学皮肤致敏测试方法的开发,相信不久的将来,皮肤致敏测试方法必将陆续迭代,检测结果会更加灵敏、准确和快速。
[作者贡献Author Contribution]
黄静怡参与讨论并确定主体框架,查找及筛选相关文献,撰写初稿并修改;李培宁参与讨论并确定主体框架,查找及筛选相关文献,参与文稿的修订;刘香梅共同讨论并确定文章主体框架,参与文稿修订;刘忠华共同讨论并确定文章主体框架,并对整体框架给予修改意见;黄宇锋共同讨论并确定文章主体框架,审核初稿并给予修改意见。
[利益声明Declaration of Interest]
所有作者均声明本文不存在利益冲突。
