结核病分子生物学诊断新技术的研究进展
2022-09-05马俊,沙巍
马 俊, 沙 巍
(同济大学附属上海市肺科医院上海市感染性疾病(结核病)临床医学研究中心,上海 200433)
结核病是由结核分枝杆菌(Mycobacteriumtuberculosis, MTB)感染引起的传染病,是危害我国乃至世界人民生活健康的严重公共卫生问题[1]。肺结核病原学诊断的传统方法是抗酸涂片镜检和分枝杆菌培养,但是抗酸涂片镜检检出率且敏感性较低;培养出结核分枝杆菌虽然是诊断活动性结核的金标准,但其阳性率也较低、培养时间长,不利于早期诊断[2-3]。世界卫生组织(World Health Organization, WHO)在《2021全球结核报告》[4]中提到: 中国新发病患者数约84.2万,约占全球8.5%,居全球第2位,病原学检出率为55%,高于去年的47%,但仍低于全世界的平均水平。因此,使用包括分子生物学新技术在内的新的诊断策略是提高结核分枝杆菌病原学检出率的快速有效手段。2013年,WHO修订了结核病的诊断标准,将其推荐的GeneXpert MTB/RIF和LAMP技术的阳性检出结果视为等同于细菌学检测阳性,作为病原学阳性结核的诊断依据[5];我国也在肺结核诊断标准中进行了相应的修订,将基于分子生物学检测结果阳性作为结核病诊断的金标准之一[6]。
根据诊断目的,目前分子生物学技术在结核病中的应用分为两大类: 结核分枝杆菌病原学检测以及其耐药性检测。根据检测原理,将现有的分子生物学技术分类如下: (1) 荧光定量聚合酶链反应(polymerase chain reaction, PCR)技术;(2) 恒温扩增技术;(3) 探针-反向杂交技术;(4) 探针-熔解曲线;(5) 基因测序技术。本文将就这5类分子生物学检测的代表技术(表1)对结核分枝杆菌病原学及其耐药性的诊断效能和最新研究进展进行综述。
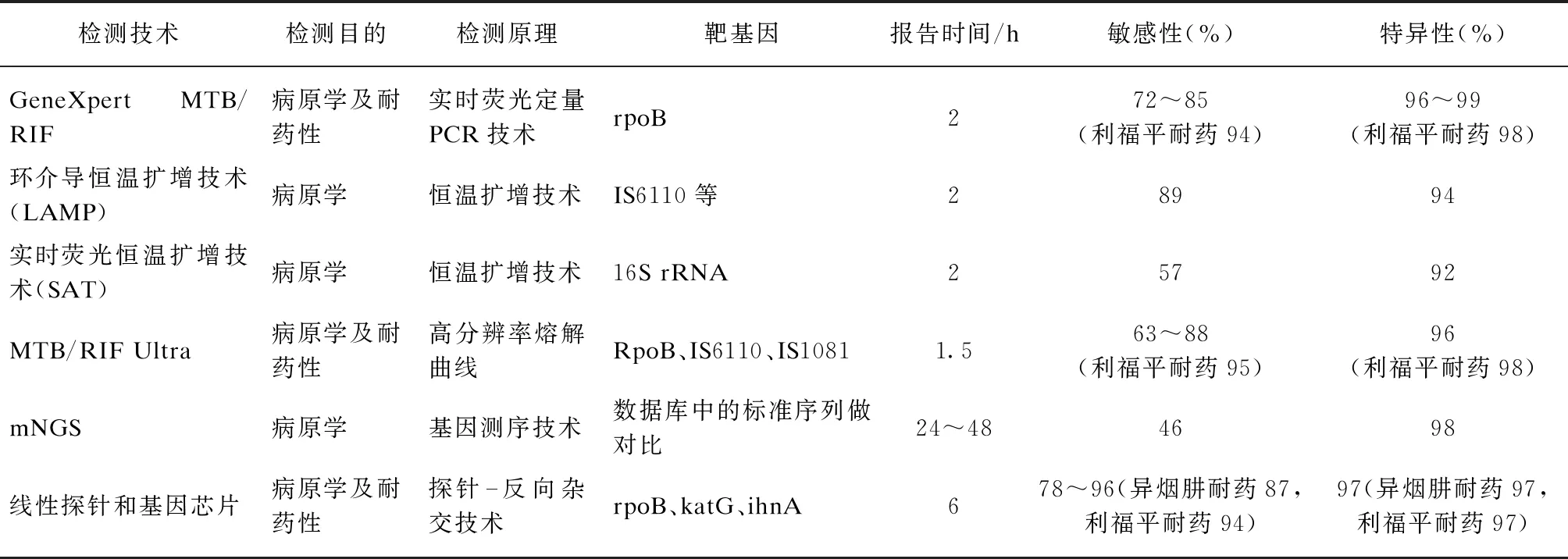
表1 各种分子生物学检测技术的比较(以培养及表型药敏为金标准)
1 结核分枝杆菌病原学及其耐药性检测的分子生物学技术
1.1 实时荧光定量PCR技术
实时荧光定量PCR技术原理是通过荧光基团标记特异性探针,对基因扩增产物进行标记,利用DNA聚合酶5′→3′外切酶活性,在PCR扩增过程中切下探针中荧光基因,使其远离淬灭基因,产生荧光检测信号[7]。
GeneXpertMTB/RIF(简称Xpert)是目前荧光定量PCR技术的典型代表,以半巢式实时PCR技术为基础的快速全自动核酸扩增检测技术。通过半巢式PCR扩增rpoB基因的192 bp结核分枝杆菌复合群的特异性序列,其中包含了81 bp的利福平耐药决定区域(RRDR)序列,该区域用5个分子信标(探针A到E)进行探测,探针为寡核苷酸,可在2 h内完成MTB检测和利福平耐药检测。一项国外多中心研究报道,共纳入6 648例患者,其中1 033例痰培养阳性患者,Xpert法检测敏感性为90.3%;以痰培养为金标准,Xpert法在菌阴肺结核患者中的敏感性76.9%,特异性为99.0%[8]。另一项国内双中心研究共纳入190例患者,以痰培养为金标准,Xper法检测敏感性72.1%,特异性为96.6%[9],与国外报道相接近。Xpert技术不仅可直接用于检测呼吸道样本,还能检测其他类型标本,包括脑脊液、淋巴结组织、胸腹腔积液、尿液、透析液和脓液等,但其敏感性不尽相同,对于检测淋巴结组织、脓液、尿液标本更具优势[10-11]。
该技术的另一优势为对利福平耐药的快速诊断。一项国外多中心研究报道,1 060例患者以表型药敏为金标准,Xpert法对利福平耐药的检测敏感性为94.4%,特异性为98.3%[8],为早期诊断耐利福平肺结核提供了有力保障,尤其在结核病高负担且经济欠发达地区的,该技术发挥的作用更为明显[12-13]。
另外,国内有研究发现使用Xpert检测肺泡灌洗液来诊断肺结核时,174例对照组中出现了28例假阳性结果,其中7例检测结果为“低”,21例为“非常低”,因此对于Xpert结果为“非常低”这一半定量阳性结果的解读需充分结合临床,考虑到存在假阳性的可能性,不能完全作为确诊依据[14]。
1.2 恒温扩增技术
恒温扩增技术其最大特点是基因扩增过程中不需要检测温度梯度循环,温度保持恒定,临床主要应用于呼吸道标本进行病原学检测,包括痰液及肺泡灌洗液。目前代表技术主要包括环介导恒温扩增技术(loop-mediatedisothermal amplification, LAMP)和实时荧光恒温扩增技术(simultaneous amplification and testing, SAT)。
LAMP是一种独特的DNA恒温扩增方式,经过2 h反应即可完成核酸扩增,可肉眼目测检测结果,对实验室设备和生物安全要求较低。LAMP技术扩增的靶基因是多样化的,包括IS6110、hspX、mpb64、gyrB、rrs、rimM或sdaA基因。其中,IS6110基因是最多被使用的,因为它显示出更高的敏感性和特异性[5]。一项荟萃分析对26项研究中的9 330份痰样本检测结果进行了汇总,以痰培养为金标准,LAMP法的敏感性为89.6%,特异性为94.0%[15]。另有两项研究均提示LAMP法与Xpert法具有相似的敏感性,且显著高于涂片法[16-17]。但需要认识到高温、高湿度、试剂量不足和样品之间的交叉污染是出现假阳性结果的主要原因[15]。
SAT原理是通过设计特异性的结核分枝杆菌核糖体16SrRNA扩增引物及优化探针技术,使用M-MLV反转录酶及T7RNA多聚酶来同时实现核酸恒温扩增和实时荧光检测,由于RNA在环境中极易降解,且MTB死亡后RNA也会降解,因此认为此技术不仅能有效避免污染,还能监测肺结核的活动性[18]。沙巍等[19]报道在156例肺结核中,以临床诊断为金标准,SAT法诊断结核的敏感度为58.3%,特异度为100.0%,对于痰菌阳性肺结核患者,SAT法阳性率为84.9%;对于痰菌阴性患者,其阳性率为19.0%。Fan等[20]提出建立培养法+Xpert法+SAT法的平行试验模型,联合检测258例菌阴肺结核患者痰液及肺泡灌洗液标本,其敏感性达到85.7%,是较为有效的辅助检测方法。
1.3 探针-反向杂交技术
探针-反向杂交技术原理是利用特殊标记的探针和靶DNA序列在一定条件下形成双链分子,荧光基团标记这种双链分子显影的检测方法,该方法一次可以完成多个耐药相关基因位点的检测。线性探针和基因芯片是基于该技术的两种检测方法,能检测利福平相关的耐药基因rpoB及与异烟肼相关的耐药基因katG及ihnA。国外一项报道利用线性探针技术,对痰菌阳性患者敏感性达到96.4%,特异性为100%,对痰菌阴性患者敏感性为77.8%,特异性为97.2%[21]。国内一项研究以痰培养及表型药敏为金标准,使用基因芯片法对异烟肼耐药的检测敏感度为86.7%,特异度为96.5%,对利福平耐药的检测敏感度为93.8%,特异度为97.0%。上述结果均表明该项技术有助于耐多药结核病的早期诊断[22]。
1.4 探针-熔解曲线技术
探针-熔解曲线技术原理是探针与特异性扩增产物形成双链,再检测解链温度,完成针对于靶序列的分析[23],可检测呼吸道标本及肺外标本,并通过对扩增产物的熔解曲线的分析判断,从序列中检测是否存在基因突变而实现耐药性检测。其中有代表性的XpertMTB/RIF Ultra(简称Ultra)技术,采用的是高分辨率熔解曲线技术,用时更短;同时在rpoB基因的基础上,增加检测IS6110和IS1081两个多拷贝的靶基因,敏感性更高。国外一项针对Ultra技术的多中心研究共纳入1 439例患者,基于培养为金标准,使用该检测方法诊断肺结核的敏感性高于Xpert法(63%vs46%),但特异性有所下降(96%vs98%)[24]。基于Ultra技术的高敏感性,2017年WHO推荐由Ultra技术替代Xpert法[25],但是需要充分考虑到特异性下降的情况[26]。
Ultra技术另一项优势是对肺外结核的诊断效率更高,尽管针对不同肺外结核标本检测的敏感性各不相同,但特异性均较高。一项基于Ultra技术对结核性脑膜炎诊断的研究显示,对于疑似结核脑膜炎的患者,其敏感性达到47.2%,而Xpert法为39.6%,特异性均为100%[27];另一项针对于结核性胸膜炎诊断的研究显示,基于综合诊断模型为金标准,Ultra技术的敏感性高于Xpert(44.2%vs19.2%),特异性均为98.7%[28];一项荟萃分析对于纵隔肺门淋巴结结核的诊断,基于综合诊断模型为金标准,Ultra技术的敏感性为70.0%,特异性为100%,Xpert法的敏感性为81.6%,特异性为96.4%[29]。
Ultra技术在利福平耐药性的快速检测能力方面同样具有优势。国外一项研究报道,551例痰培养阳性患者基于表型药敏为金标准,该法检测利福平耐药的敏感性为95%,特异性为98%,与Xpert法相接近[24]。另一项研究报道了Ultra技术对肺外标本检测利福平耐药情况,基于表型药敏为金标准,敏感性和特异性均为100%,而Xpert法敏感性为96.5%,特异性为99.1%。Ultra技术和Xpert法,两者对利福平耐药的检测能力较为接近[29],均为早期诊断耐利福平肺结核及肺外结核提供了更好的保障。
1.5 基因测序技术
从1977年第一代Sanger测序技术发展以来,基因测序技术取得了长足的进步,目前已经发展到了第四代[30]。该方法是通过对MTB靶基因中序列的测定,与数据库中的标准序列做对比,从而精确测定病原的检测方法。宏基因组二代测序技术(meta-genomicnext-generation sequencing, mNGS)是一项能对微生物脱氧核糖核酸含量进行高通量测序的代表技术,通过对呼吸道标本及肺外标本的DNA或RNA进行测序,可以同时检测多种病原微生物,对包括结核病在内的感染性疾病的诊断有一定价值[31]。一项回顾性研究显示466例被纳入患者中,感染性病变敏感度为50.7%,特异度为85.7,其中诊断结核病的敏感度为45.7%,高于培养法[32]。有报道认为,对于外周型肺部感染性疾病,进行肺部病灶相对应的支气管肺泡灌洗液检测并送检mNGS,可以获得更高的检测敏感性[33]。
然而受mNGS自身技术、测序成本及相关数据库等影响,常规mNGS常无法获得样本中所有微生物的序列,且对于真菌和分枝杆菌等厚壁细菌需要破壁前处理,临床标本中低浓度致病微生物可能会漏检[34]。《高通量宏基因组测序技术检测病原微生物的临床应用规范化专家共识》[35]建议: 传统检验方法未能给出明确病原学结果从而影响患者准确诊疗的感染性疾病、新发突发传染病、验证常规检验结果或排除其他发热疾病,可考虑使用mNGS技术;对于危急重症、疑难感染、群体性感染事件等,可考虑作为一线检测方法,不盲目使用mNGS技术。
2 最新的分子生物学诊断技术
目前结核病分子生物学仍在高速发展中,新技术不断涌现,一部分处于研发早期阶段,一部分属于小样本临床研究,但均展现出良好的诊断效能和应用前景。
2.1 Xpert MTB/XDR

2.2 聚集的规则间隔短回文重复序列系统(the clustered regularly interspaced short palindromic repeat, CRISPR)
1987年,日本科学家Yoshizumi Ishino于最先在大肠杆菌中发现CRISPR并根据其特征命名[38]。2002年,Jansen等[39]在原核生物中发现了与这段重复序列紧密相关的保守基因——Cas(CRISPR-asso-ciated systems),Cas基因可以编码具有核酸相关的功能性Cas蛋白,作为抵抗入侵病毒和噬菌体的适应性免疫系统。CRISPR系统由CRISPR相关蛋白(CRISPR-associated protein)和CRISPR RNA(crRNA)组成。Cas和crRNA可以形成有效的核蛋白(ri-bonu-cleoprotein, RNP)复合物,感知和降解与crRNA序列互补的外源核酸[40]。CRISPR诊断系统具有快速、灵敏度高、特异性好、方便、成本低等优点。国内已有报道基于CRISPR-Cas12的平台建立了结核分枝杆菌DNA检测方法[41],利用该法在肺结核患者的痰液或肺泡灌洗液标本中的检测敏感性为86.8%,其中针对菌阴肺结核患者的检测敏感性更是高达80.5%,明显高于涂片法及Xpert方法[42]。然而该研究尚属于小样本临床研究,还需要通过进一步大量本的研究结果来进一步证明其检测优越性。
2.3 全基因组测序(whole-genome sequencing, WGS)

3 展 望
虽然分子生物学技术极大地推动了结核病的诊断,但也必须清楚地认识分子生物学检测技术有其局限性,一方面对仪器设备、操作人员技术水平等有较高要求,另一方面检测结果也可能出现假阴性和假阳性的情况。一部分临床医生没有把握好检查适应证,对患者的病情造成延误甚至误诊,还极大加重患者的经济负担。针对结核病的诊断,建议可以进行以下选择[50-51]: (1) 当患者疑似结核病时,可行PCR法进行相关检测,包括GeneXpert MTB/RIF 、LAMP及CRISPR等检查;(2) 在耐药高危结核患者中,应同时完善一线及二线分子药敏检测,必要时进行全基因组测序;(3) 必须再次强调不能忽略经典的结核病微生物学检查,需要两者紧密结合,取长补短。作为临床医务人员需要与时俱进,充实精准医疗理念,需根据不同患者的病情选择更合理、经济的检测手段,而不应盲目地寻求新方法、撒网式检查,扎实提高结核病诊疗水平。
