烟草附球菌叶斑病的病原及生物学特性
2022-09-05何世芳孙光军曾陨涛潘忠梅陈兴江桑维钧
何世芳,孙光军,曾陨涛,潘忠梅,陈兴江,桑维钧,曹 毅*
(1贵州省烟草科学研究院,贵州贵阳 550081;2贵州大学烟草学院,贵州贵阳 550025;3中国烟草总公司贵州省公司烟叶处,贵州贵阳 550004)
0 引言
【研究意义】贵州烟草种植历史悠久,近5年来,年均种植面积达12余万ha(闫新甫等,2021),为我国烟草生产第二大省份。烤烟作为贵州最重要的经济作物之一,在全省财政收入及脱贫致富方面发挥十分显著的作用(马云飞等,2020)。近年来,由于气候条件变化、种植品种单一和烟田连作比例较高等原因,导致烤烟病害发生呈上升趋势(商胜华等,2016)。烤烟以收获叶片为主,叶斑类病害是影响其产、质量最重要的因素之一。附球菌属真菌是一种重要的植物病原菌,其在烟草上可危害大田期成熟烟叶(Guo et al.,2020),也可侵染烤烟根部引起根腐病(Gai et al.,2020)。烟草附球菌叶斑病在贵州的危害有上升趋势,因此,明确贵州省内该病害的病原菌种类及生物学特性,对其有效防治具有重要意义。【前人研究进展】附球菌属()隶属子囊菌门(Ascomycota)座囊菌纲(Dothideomycetes)格孢腔菌目(Pleosporales)亚隔孢壳科(Didymellaceae),该属真菌寄主范围广,可侵染火龙果、高粱、猕猴桃和燕麦等多种作物(王俊丽等,2014;Stokholm et al.,2016;聂秀美等,2019;张国辉等,2021),引起根腐、叶斑、枝枯和果腐烂等症状,造成严重的经济损失。是2017年发表的新种,被认为属于内生菌、腐生菌或半寄生菌,但对该菌病理学方面的研究较少(Chen et al.,2017);方丽等(2021)于2018—2019年调查浙江省桐乡、武义等地的杭白菊种植基地的病虫害发生种类,发现sp.可引起杭白菊叶斑病,但未明确其菌株的分类地位。目前有关烟草附球菌叶斑病的研究主要集中在病害发生及病原鉴定方面,付景圆(2014)首次报道重庆地区烟草附球菌叶斑病,使用形态学观察以及rDNA-ITS和2种序列鉴定病原菌种类,但未能鉴定到种级;Guo等(2020)报道了贵州由附球菌属引起的烟草叶斑病,通过多基因系统发育分析,将其病原菌鉴定为;同年云南报道了由引起的烟草根腐病(Gai et al.,2020)。【本研究切入点】2020年本课题组在对贵州主产烟区烟草叶斑类病害调查时发现烟草附球菌叶斑病类似症状病叶,通过镜检测定初步判断病原菌为附球菌属;现有关于烟草附球菌叶斑病的报道主要集中在症状描述和病原鉴定上,尚无针对烟草附球菌叶斑病病原菌生物学特性的相关研究报道。【拟解决的关键问题】对采集自贵州省的烟草附球菌叶斑病病叶进行分离、Koch’s法则验证,使用形态学特征结合核糖体内转录间隔区(ITS)、28S rRNA(LSU)、-微管蛋白()和RNA聚合酶II第二大亚基()部分序列的多核苷酸序列系统学分析等方法对病原菌进行鉴定,从而明确贵州烟草附球菌叶斑病的病原菌种类及生物学特性,为烟草附球菌叶斑病的综合防治及抗病育种提供理论依据。
1 材料与方法
1.1 试验材料
2020年在贵州省兴义市种植的云烟87采集到烟草叶斑病标本,保湿后将其带回实验室进行病原菌分离纯化。
供试培养基:马铃薯葡萄糖琼脂(PDA)、玉米粉琼脂(CMA)、麦芽汁琼脂(MEA)、燕麦琼脂(OA)、察氏琼脂(CDA)、高氏合成1号琼脂(GSA)、水琼脂(WA:琼脂粉20 g,蒸馏水1000 mL)、马铃薯蔗糖琼脂(PSA)、烟叶煎汁琼脂(TA:新鲜烟叶200 g,琼脂粉20 g,蒸馏水1000 mL)、胡萝卜琼脂(CA:胡萝卜200 g,琼脂粉20 g,蒸馏水1000 mL)、营养琼脂(NA)和松针琼脂(PNA:新鲜松针叶200 g,琼脂粉20 g,蒸馏水1000 mL)共12种培养基。
1.2 试验方法
1.2.1 病原菌分离纯化及鉴定 病原菌的分离纯化及形态学鉴定:采用常规组织分离法对烟草附球菌叶斑病病原菌进行分离和纯化(方中达,1998),纯化鉴定的菌株保存于贵州省烟草科学研究院真菌实验室,菌株编号YC1105。将纯化菌株分别接种于PDA、OA和MEA培养基上,25 ℃培养7 d后,在显微镜下观察菌落和菌丝形态,同时在菌落边缘滴加2滴1 mol/L NaOH溶液10 min后开始观察,并记录培养基的颜色变化(韩帅等,2019),继续培养菌株待产生分生孢子后,挑取分生孢子在显微镜下观察病原菌的产孢结构、分生孢子等形态,并参照Boerema等(2004)的方法进行形态学鉴定。
分子生物学鉴定:采用试剂盒(DNeasy Ultra-Clean Microbial Kit,Qiagen)提取病原菌DNA,详细操作参照使用说明书;将提取的DNA作为模板,使用表1引物(上海捷瑞生物工程有限公司合成)扩增菌株序列,反应体系和扩增条件参照Chen等(2015b)的方法进行。PCR产物经1%琼脂糖凝胶检测后,送至生工生物工程(上海)股份有限公司进行测序。将所得到的核苷酸序列通过BLAST进行序列比较,依据比对结果下载相关序列,使用MAFF(http://mafft.cbrc.jp/alignment/server/)和Trim AI(v.1.3)分别对序列进行比对和剪切(Chen et al.,2015a),通过raxml-GUI 2.0使用最大似然法(Maximumlikelihood,ML)构建系统发育进化树(Edler et al.,2020)。

1.2.2 病原菌致病性测定 选取盆栽管理的健康K326烟叶,采用离体叶片刺伤和无伤接种法进行病原菌致病性测试(潘彤彤等,2020):将菌饼(直径6 mm)接种于有伤和无伤叶片上,用湿润灭菌棉花覆盖菌饼,以接种空白PDA培养基作对照,每处理3次重复,于28 ℃人工气候箱中培养,3 d后开始观察并记录发病情况,选取接种处产生明显病斑的叶片,根据柯赫氏法则,重新分离纯化并鉴定病原菌。
1.3 病原菌生物学测定
1.3.1 培养基对菌株YC1105生长的影响 将培养5 d的菌株使用灭菌打孔器(直径6 mm)在菌落边缘打取菌饼,接种至12种培养基上25 ℃恒温培养,培养基的配制参照吴希禹等(2019)的方法进行,每种培养基重复3次,培养5和7 d后观察菌落生长情况,使用十字交叉法测量菌落直径。
1.3.2 碳、氮源对菌株YC1105生长的影响 参照高晋等(2020)的方法测定:以Czapek Dox Agar为基本培养基,以蔗糖为碳源,并用等量的葡萄糖、乳糖、甘露醇、麦芽糖、果糖、山梨糖醇和可溶性淀粉代替蔗糖;同理,以硝酸钠为氮源,用等量的蛋白胨、牛肉浸粉、氯化铵、尿素、甘氨酸、丙氨酸和酵母浸粉代替硝酸钠,以制备含有不同碳源和氮源的培养基。在含有不同碳、氮源的培养基上接种6 mm菌饼,每处理重复3次,25 ℃暗培养,5和7 d后测量菌落直径。
1.3.3 温度对菌株YC1105生长的影响 参照郭强等(2019)的方法测定温度对病原菌生长的影响,设5、10、15、20、25、28、30和35 ℃等8个处理,将6 mm菌饼接种于PDA培养基上,每个温度重复3次,分别置于供试温度的恒温箱中培养,5和7 d后测量菌落直径。
1.3.4 pH对菌株YC1105生长的影响 以PDA培养基为基础,pH设定为4、5、6、7、8、9和10,共7个处理,3次重复。用1 mol/LHCl和1 mol/LNaOH溶液调节培养基pH,将6 mm菌饼接种于培养基上,25 ℃暗培养,5和7 d后测量菌落直径。
1.3.5 光照对菌株YC1105生长的影响 将6 mm菌饼接种于PDA培养基,设连续黑暗、连续光照和12 h/12 h光暗交替3种处理,每处理重复3次,25 ℃培养,5和7 d后测量菌落直径。
1.3.6 菌丝体致死温度测定 致死温度参照刘思睿等(2019)的方法进行测定:将6 mm菌饼放入无菌试管中,并加入2 mL无菌水,以45 ℃为基础温度,1 ℃为一个梯度,50 ℃为最高温度,将其放入水浴锅中处理10 min后迅速冷却,转接至PDA培养基培养5 d,观察各处理菌丝生长情况。
1.4 统计分析
采用Excel 2010和SPSS 18.0进行数据分析,多重比较采用Duncan’s新复极差法。
2 结果与分析
2.1 症状描述
病害发生于烤烟成熟期,主要危害叶片,主要症状为褐色病斑,圆形或椭圆形,病斑边缘伴有黄色晕圈(图1-A),病斑直径0.45~0.60 cm,严重时病斑融合呈枯焦叶或碎叶。
2.2 病原菌致病性
接种6 d后叶片开始发病,叶片上产生直径0.8~1.6 cm大小病斑,初期病斑呈淡黄色,随着时间的延长,病斑逐渐变成褐色,外围伴有黄色晕圈(图1-B),无伤接种(图1-B)及针刺接种(图1-C)均能引起叶片发生病斑;对照叶片未产生病斑(图1-D);在发病处重新分离到的菌株与原接种的菌株一致,证明该菌株为烟草附球菌叶斑病致病菌。

2.3 病原菌培养性状及形态
菌株YC1105在PDA培养基上培养7 d后,菌落直径为67.5 mm,边缘规则圆形,菌丝红色,外缘白色,毡状,致密,背面有红色色素沉积(图2-A)。在OA培养基上培养7 d后,菌落直径为81.3 mm,菌丝较浓密,绒毛状,背面无色素沉积(图2-B)。在MEA培养基上培养7 d后,菌落直径为76.4 mm,菌丝中央呈灰绿色,外缘白色,毡状,较PDA培养基上菌丝更浓密,菌落背面中心呈墨绿色,外围浅黄色(图2-C)。使用1 mol/L NaOH溶液处理MEA培养基20 min后,培养基颜色变为墨绿色,之后逐渐变为棕色,为阳性反应。分生孢子无色、无隔、椭圆形,单胞(图2-E),大小为4.35~6.44 μm×2.10~3.27 μm,分生孢子器椭圆形(图2-D),无刚毛,埋生或表生于培养基表面,菌丝末端着生浅粉色圆形膨大细胞(图2-F),结合鉴定手册描述细则可将菌株YC1105归入section中。

2.4 病原菌分子鉴定结果
通过ITS、LSU、和基因序列扩增和测序,分别获得大小约536、1329、341和882 bp基因片段,NCBI 登 录 号 分 别 为MZ496638、MZ496641、MZ672001和MZ672002。将所得序列与GenBank数据库中的相似序列进行BLAST比对分析,结果显示与和相似度高达100%,但未能准确鉴定到种。将NCBI下载的对应18条模式菌株基因序列与供试菌株序列构建系统发育进化树,从图3可看出,供试菌株与(NCBI登录号分别为:KY742102、KY742256、KY742344和KY742175)的遗传距离最近,聚于同一分支,且支持率为100%。结合形态特征及分子生物学鉴定结果,将烟草附球菌叶斑病致病菌鉴定为。

2.5 病原菌生物学特性分析结果
2.5.1 培养基对菌株YC1105生长的影响 从表2可看出,菌株YC1105在12种培养基上均可生长,但生长速度有所不同。该菌株在CA培养基上生长最快,其次为OA培养基,培养7 d时菌落直径分别为73.00和63.33 mm;在WA培养基上生长最差,菌丝稀疏,培养7 d时菌落直径为28.67 mm,显著小于其他处理菌落直径(<0.05,下同),不利于菌丝生长。

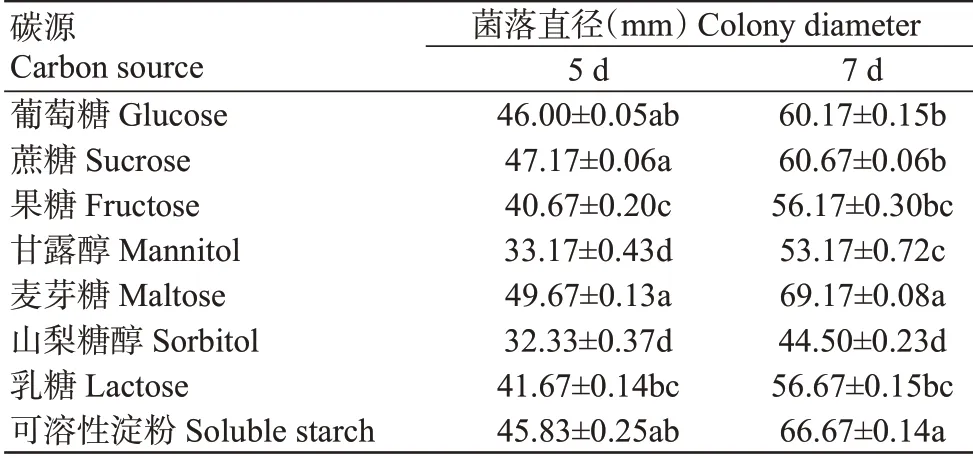
2.5.2 碳源对菌株YC1105生长的影响 如表3所示,菌株YC1105均能在供试的8种碳源培养基上生长,其中在麦芽糖和可溶性淀粉培养基上的长势较好,二者间无显著差异(>0.05,下同),培养7 d时菌落直径分别为69.17和66.67 mm;病原菌在山梨糖醇培养基上的长势较差,培养7 d时菌落直径为44.50 mm,显著小于其他碳源处理。
2.5.3 氮源对菌株YC1105生长的影响 8种氮源对菌株YC1105的生长影响结果(表4)表明,烟草附球菌叶斑病病原菌均能在供试的8种氮源上生长,但存在显著差异。其中在牛肉浸粉作氮源的培养基上菌丝生长最快,培养7 d后,菌落直径为69.83 mm;而尿素不利于菌丝生长,培养7 d后菌落直径为33.00 mm,显著小于其他处理的菌落直径。

2.5.4 温度对菌株YC1105生长的影响 由表5可知,菌株YC1105可在5~35 ℃下生长;在5 ℃条件下培养5 d菌丝不生长,培养7 d后菌丝开始生长,菌落直径为6.67 mm;病原菌最适宜生长温度为28 ℃,培养5和7 d的菌落直径均最大,分别为54.50和71.00 mm;当温度超过28 ℃后,菌丝生长速度开始下降。5和10 ℃菌丝生长较慢。

2.5.5 pH对菌株YC1105生长的影响 如表6所示,菌株YC1105在pH 4~10范围内均能生长,pH为6时,培养5和7 d的菌落直径均大于其他pH,分别为48.67和61.33 mm;菌丝在偏酸性环境中生长旺盛,培养7 d的菌落直径显著大于碱性环境菌落直径。综上,菌株在偏碱性条件下生长较缓慢,弱酸性则有利于菌株YC1105生长。

2.5.6 光照对菌株YC1105生长的影响 如表7所示,菌株YC1105在连续光照、连续黑暗和12 h/12 h光暗交替3种条件下菌丝生长无显著差异,光照对病原菌生长影响不明显;培养7 d后病原菌在3种光照条件下均未产孢。

2.5.7 致死温度的测定 菌株YC1105在45~50 ℃水浴10 min处理后菌丝生长情况见表8,48 ℃水浴10 min后仍可见菌丝生长,而49 ℃水浴10 min后未见菌丝生长。因此,推断菌株YC1105菌丝的致死温度为49 ℃,水浴10 min。

3 讨论
附球菌属是亚隔孢壳科一类致病性较强的真菌(陈倩,2015),该属早期鉴定主要采用传统形态学鉴定及寄主相关命名的方法,导致分类混乱,单靠形态学及ITS基因序列难以对其进行准确鉴定(Deng et al.,2011)。Aveskamp 等(2010)利用4 个 基 因(LSU、、ITS和)对亚隔孢壳科进行系统发育研究,对该科进行分类学修订,并新建立附球菌属,将原本属于广义茎点霉section部分的、和归入新建立的附球菌属中。Chen等(2017)年使用、LSU、ITS和进行多位点系统发育分析,对附球菌属进行了补充和完善。本研究通过形态学及分子生物学方法,将烟草附球菌叶斑病病原菌鉴定为,其在3种培养基上的菌落直径、分生孢子器、分生孢子大小,对NaOH反应呈阳性及菌丝末端分化出圆形膨大细胞,与Chen等(2015a)对的描述基本一致,但其菌丝颜色和产生的色素有所不同,可能与寄主、培养条件及生态适应性有关。
在火龙果(肖显梅等,2018)、山药(韩帅等,2019)和胡颓子(Qi et al.,2021)等作物上均有报道,但对其生物学特性的研究甚少。本研究生物学特性结果表明,烟草附球菌叶斑病病原菌在胡萝卜琼脂(CA)培养基上生长最快,其次为燕麦琼脂(OA)培养基,与黄鈜琳等(2021)报道茶叶斑病病原菌()在OA培养基上生长速率最快的结果不一致,出现差异的原因可能与其试验设计未使用CA培养基有关;病原菌最适pH为6,与肖显梅等(2018)报道火龙果茎斑病病原菌最适pH为6~7的研究结果基本相似。曾慧兰等(2018)报道百合叶尖干枯病病原菌生物学特性,表明最适氮源为牛肉浸膏、最适碳源为乳糖和葡萄糖,与本研究得出最适氮源为牛肉浸粉、最适碳源为麦芽糖的结果存在一定差异。烟草附球菌叶斑病病原菌生长最适温度为28 ℃,与肖显梅等(2018)报道火龙果茎斑病病原菌最适温度为26 ℃的结果不一致。上述差异的产生可能与生态环境和寄主不同有关,表明来自不同寄主的生物学特性有所差异。烟草附球菌叶斑病病原菌致死温度为49 ℃,水浴10 min,因此在生产上,播种前对种子进行温汤处理,可降低该病害的发生风险。
本研究较系统地对引起贵州烟草附球菌叶斑病病原菌进行了生物学特性分析,旨在为防治该病提供较全面的理论依据。鉴于叶斑病在烟草种植上造成的危害,今后应对该病原菌的药剂敏感性、发生流行规律及抗病品种的培育等开展系统、深入的研究,以有效控制烟草附球菌叶斑病的危害。
4 结论
本研究通过形态学和分子生物学方法,将分离获得的烟草附球菌叶斑病病原菌鉴定为;其菌丝生长温度和pH范围较宽,最适温度为28 ℃,弱酸性条件有利于菌丝生长;病原菌能利用多种氮源和碳源,最适碳源为麦芽糖,最适氮源为牛肉浸粉,致死温度为49 ℃,光照对菌丝生长影响不显著。
