玫瑰黄链霉菌活性代谢产物诱导烟草灰霉病抗性机制研究
2022-09-05刘海涛刘大群李亚宁
刘海涛,王 娇,刘大群,2,李亚宁*
(1河北农业大学植物保护学院/河北省农作物病虫害生物防治技术创新中心/国家北方山区农业工程技术研究中心,河北保定 071001;2中国农业科学院研究生院,北京 100081)
0 引言
【研究意义】烟草灰霉病是烟草整个生长期尤其是育苗期常发的世界性真菌病害(卢燕回等,2012),近年来,由于育苗集中化,该病害发生越发频繁,适宜条件下短时间内即可造成大面积传播和流行(陈宇春等,2020),严重时发病率可达100%,造成严重的经济损失。其病原为灰葡萄孢()(董金皋,2007),可引起烟苗黑茎、枯萎和叶斑等症状,湿度大时叶斑及病茎上密生灰色霉层。该病具有潜伏期较短、传播速度较快、易感染易发病等特点,且病原菌侵染烟草叶片可造成烟叶组织坏死、腐烂,对烟叶产量和品质造成一定影响(邓真等,2012)。世界上至少有97个国家和地区种植烟草,而我国烟叶产量约占世界烟叶总产量的36%,是最大的产烟国(张红涛等,2020),且我国各大烟区的气候及烟草种植品种等各不同,其中福建(邓真等,2012)、广西(谭海文,2012)、陕西(田佳等,2016)和黑龙江(周浩等,2019)等地烟草灰霉病发生较普遍。因此,烟草灰霉病防治是烟草生产中重要一环,对烟草产业的健康可持续发展具有重要意义。【前人研究进展】生产上防治烟草灰霉病的常用药剂有多菌灵、甲基硫菌灵、异菌脲、乙烯菌核利和嘧菌环胺等(张锐,2017),但化学农药的大量使用容易引起农药残留、病原菌产生抗药性等问题(郑媛萍,2018;宋郝棋等,2022),因此,烟草绿色防控技术越来越受到人们的重视(曾涛等,2022),主要包括烟草抗病性诱导(Naidu,2001)、拮抗微生物(陈磊,2021;张蒙蒙等,2022)、生物农药(王军等,2018;杜传印等,2019;Tang et al.,2022)等。利用物理、化学和生物方法预先处理植物,使感病反应产生局部或系统的抗性称为诱导抗病性(张元恩,1987)。诱导系统抗病性(Induced systemic resistance,ISR)可有效提高植株抗病能力(Kloepper et al.,2004),芽孢杆菌、木霉菌和链霉菌等生防微生物均可引起ISR。在拟南芥上发现假单胞菌可诱导植株产生ISR(van Loon et al.,1998)。烟草诱导抗病性对环境毒副作用小,是一种有潜力的烟草病害防治手段(李巧玲等,2015)。杨献营(1993)系统总结了用诱导抗病性的方法防治烟草病害的途径;张莉等(2017)用易脆毛霉多糖抑制烟草花叶病毒,防效达62%。脂氧合酶(LOX)、过氧化氢酶(CAT)和多酚氧化酶(PPO)等防御酶与植物的抗病性密切相关,可作为衡量诱导抗病性的重要指标;此外,植物受到诱导物的刺激后,也会引发活性氧暴发、胼胝质沉积和抗病相关基因上调(Lu et al.,2019;凤琦和张晶钰,2020),以及抗病相关蛋白PR蛋白的产生(梁颖博等,2019)。目前研究较多的PR基因有、和等,基因超量表达可诱导植物产生系统抗病性(van Loon and van Strien,1999;田华,2016),基因表达产生的类甜蛋白可降解真菌细胞壁,起到抗病作用(李白,2011)。基因表达植物苯丙烷类代谢限速酶,可调控植保素等的合成(朱海生等,2018)。【本研究切入点】玫瑰黄链霉菌Men-myco-93-63是分离自马铃薯疮痂病自然衰退土壤的生防链霉菌(Liu,1992),李亚宁等(2017)从该生防菌发酵液中提取到一组具有抑菌活性的多烯大环内酯类代谢产物Roflamycoin和Menmyco-A(简称R&M)。本课题组前期研究表明R&M可诱导黄瓜植株产生对白粉病的抗性(甄丹妹等,2019)、烟草植株产生对烟草灰霉病的抗性,但R&M诱导的烟草植株产生对灰霉病抗性的作用机制尚待进一步探究。【拟解决的关键问题】在实验室条件下,采用生理生化及实时荧光定量PCR(qRT-PCR)检测的方法,对4~5叶期本生烟草经R&M诱导处理后植株非R&M接触烟叶不同时间的抗病相关酶活性、抗病相关物质含量及抗病相关基因的表达量进行测定分析,旨在为利用R&M绿色防控植物灰霉病等重要病害提供理论依据。
1 材料与方法
1.1 试验材料
植物材料:本生烟(),由河北农业大学植物保护学院农作物病虫害生物防治工程技术研究中心保存提供。供试菌株:烟草灰霉病菌,采集自田间发病的烟草植株,用PDA培养基进行病原菌的单孢纯化,4 ℃保存备用;使用前在PDA培养基上保湿培养5~7 d。供试药剂:玫瑰黄链霉菌Men-myco-93-63活性代谢产物R&M(河北农业大学植物保护学院农作物病虫害生物防治工程技术研究中心自制)。
1.2 试验方法
1.2.1 供试烟草种植 温室内将本生烟播种于育苗穴盘中,25~30 ℃、光照14 h条件下土培(营养土∶蛭石=2∶1)种植,待长至2~3叶龄时移栽至直径为13 cm的花盆中,每盆1株,4~5叶期时用于后续试验。
1.2.2 玫瑰黄链霉菌发酵液的制备及R&M提取按照张艳(2006)的方法进行玫瑰黄链霉菌发酵液的制备,按照赵志泉等(2007)的方法进行玫瑰黄链霉菌活性代谢产物R&M的提取。
1.2.3 过敏反应(HR)的染色验证 采用0.4%台盼蓝染色法进行验证。依据本课题组前期R&M对烟草灰霉病诱导抗病性最佳诱抗浓度试验结果,将80 mg/L的R&M注射于4~5叶期本生烟叶片中,以清水作对照(CK),每处理1株,3次重复,处理12 h后观察,待有明显坏死斑出现后将叶片剪下,与对照组一起放入抽滤瓶中,加入0.4%台盼蓝染色液,真空抽滤5 min,用95%乙醇脱色至组织透明,于显微镜下观察。
1.2.4 R&M诱导抗病标志基因的表达 依据本课题组前期R&M对黄瓜白粉病诱导抗病性最佳诱抗浓度试验结果,将100 mg/L的R&M注射于4~5叶期本生烟叶片中,以清水作对照(CK),每处理1株,3次重复,处理后4 h剪下处理叶片(约100 mg),用锡箔纸包裹后,迅速放入液氮中冷冻,-80 ℃保存备用。采用半定量的方法检测基因的表达情况。PCR扩增引物序列见表1。PCR反应体系20.0 μL:2×PCR Master Mix 10.0 μL,上、下游引物(10 μmol/L)各1.0 μL,cDNA 模板2.0 μL,ddHO 6.0 μL。扩增程序:94 ℃预变性5 min;94 ℃1 min,55 ℃1 min,72 ℃1 min,进行30个循环;72 ℃延伸5 min,4 ℃保存。
1.2.5 非药剂接触烟叶中CAT和LOX活性及过氧化氢(HO)含量测定 将温室种植的4~5叶期本生烟幼苗分成2组,每组处理18株,3次重复,一组植株的一侧全部叶片进行套袋,不进行任何药剂处理,另一侧叶片进行喷施80 mg/L R&M药剂处理;对照组植株的一侧全部叶片进行套袋,不进行任何药剂处理,另一侧叶片进行喷施清水处理(CK)。分别于处理0、1、2、3、5和7 d时取本生烟幼苗非药剂接触叶片(即套袋一侧无R&M接触叶片)(胡能等,2017),采用北京索莱宝生物技术有限公司的相关试剂盒测定CAT和LOX活性及HO含量。
1.2.6 木质素合成基因及病程相关蛋白基因和相对表达量测定 将温室种植的4~5叶期本生烟幼苗分成2组,每组处理10株,3次重复,一组用100 mL浓度为80 mg/L的R&M溶液灌根处理2 d后,于上部第3片叶采用灰霉菌孢子悬浮液进行摩擦接种;对照组用100 mL清水灌根处理2 d后,于上部第3片叶采用清水进行摩擦接种(CK)。接种处理后1、12、24、48、72和120 h,用去酶、灭菌剪刀剪下各处理组烟苗对应时间段的非接种灰霉病菌叶片的相同部位(约100 mg),采后立即称重,并放入-80 ℃冰箱中低温保存。采用实时荧光定量PCR检测样品、和基因的相对表达量。qRT-PCR扩增引物序列见表1,试验所用试剂均购自TaKaRa公司。PCR反应体系20.0 μL:2×TransStartR Top Green qPCR SuperMix 10.0 μL,上、下游引物(10 μmol/L)各0.4 μL,cDNA模板2.0 μL,ddHO 7.2 μL。扩增程序:94 ℃预变性0.5 min;94 ℃5 s,56 ℃15 s,72 ℃10 s,进行40个循环,设置熔解曲线。反应结束后,查看结果,导出数据,基因的相对表达量利用2方法分析基因转录的差异。

1.3 统计分析
运用SPSS 21.0和Excel 2016进行试验数据处理和统计分析,应用Duncan’s新复极差法进行差异显著性检验。
2 结果与分析
2.1 R&M诱导抗病性验证结果
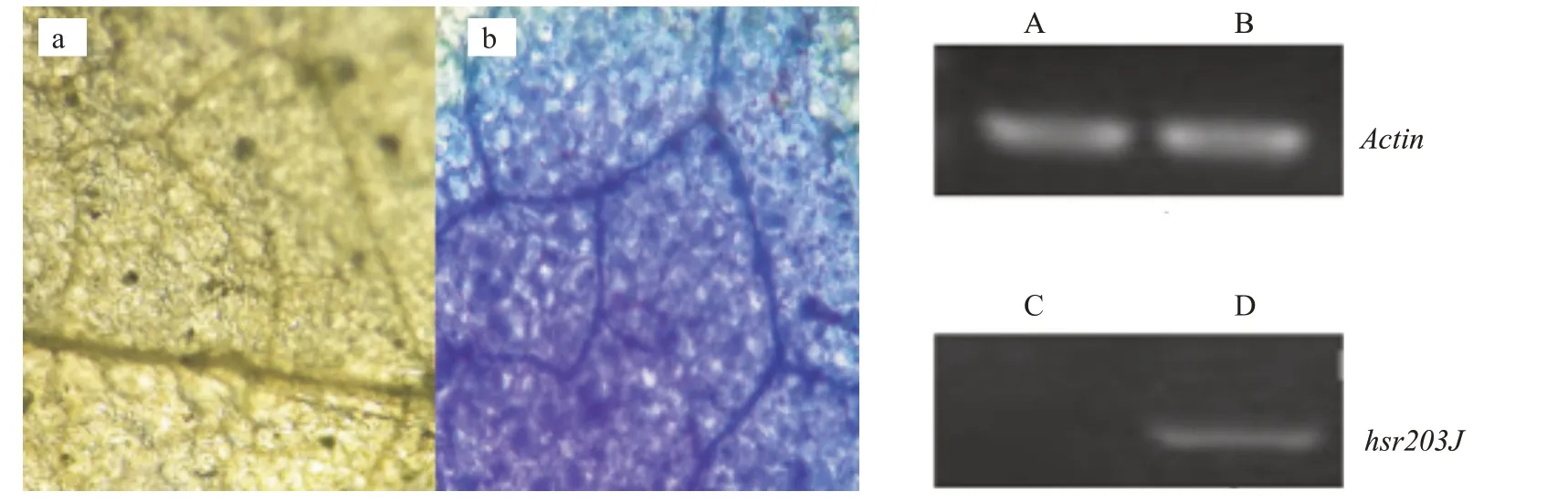
2.1.1 HR反应染色结果 将80 mg/L的R&M注射于4~5叶期本生烟叶片中,以清水作对照。参照郭景红等(2018)的方法进行样品的采集、处理、显微观察。结果(图1-a和图1-b)显示,经R&M处理的烟草叶片在台盼蓝作用下被染成蓝色,CK的烟草叶片未能被染色,表明出现了micro-HR反应,R&M能使烟叶细胞发生程序性死亡。
2.1.2 抗病标志基因的表达 植株受到病虫害等外界刺激后,常出现一系列生理反应,在受害部位出现坏死斑,伴随HR反应的标志基因的表达。由图1可知,100 mg/L R&M处理后,经RTPCR检测发现,烟草叶片中基因明显上调表达,而清水对照中基因不表达,表明R&M可诱导烟草叶片出现过敏反应。
2.2 R&M处理后烟草叶片中CAT和LOX活性及H2O2含量变化
2.2.1 CAT活性变化 CAT是一种诱导酶,由生物刺激素引起的植物体内CAT活性的增强与植株抗病性呈正相关。由图2可知,喷施R&M 2 d后CAT活性一直处于增强状态,且活性始终显著高于CK(<0.05,下同),表明喷施R&M可诱导烟叶CAT活性增高,从而提高植物抗病性。

2.2.2 LOX活性变化 图3显示,喷施R&M后第3 d ,烟草叶片中LOX活性开始显著高于CK,第7 d达最高值,为3600 U/g,是对照的1.66倍。LOX是茉莉酸(JA)形成的关键酶,推测R&M通过诱导烟叶LOX活性增强而参与JA合成的信号转导途径,从而提高植物抗病性。

2.2.3 HO含量变化 活性氧暴发在HR反应中起着非常重要的作用,活性氧主要有超氧阴离子、羟自由基和HO。由图4可看出,喷施R&M后第1 d,烟叶中HO含量迅速达最高值,为CK的1.13倍;喷施R&M 3 d后,可能由于体内防御酶活性增高,将HO分解为水,导致HO含量降低,且第2 d后HO含量逐渐降低,使植物避免了活性氧含量长时间过高对细胞的损害。

2.3 R&M处理后PAL、PR1和PR5基因相对表达量变化
2.3.1基因相对表达量变化基因是植物体内控制木质素合成的关键基因,其表达的苯丙氨酸解氨酶可促进酚类相关物质的合成,以及合成与抗病相关的木质素(朱海生等,2018)。如图5所示,R&M处理叶片中基因的相对表达量在处理后24 h达最高值,为CK的25.37倍,此后基因表达量下降;在1~120 h,R&M处理的基因表达量均显著高于CK。表明R&M可诱导烟草抗病相关基因的表达,从而增强植株系统抗病性。

2.3.2相对表达量的变化基因表达产物为类似β-1,3-葡聚糖酶活性的PR1蛋白,在抗真菌病害中发挥重要作用(Somssich et al.,1988)。由图6可见,R&M处理叶片中基因的相对表达量在处理后24 h达最高值,为CK的11.23倍。表明R&M通过增强基因的表达而提高烟草植株对灰霉病菌的抗性。
2.3.3基因相对表达量变化基因产物为类甜蛋白,可降解真菌细胞壁,起到抗真菌病害的作用(李白,2011)。由图7可见,R&M处理叶片中基因的相对表达量在处理后72 h达最高值,为CK的11.17倍。表明R&M通过增强基因的表达而提高烟草植株对灰霉病菌的抗性。

3 讨论
在生产实际中,通过诱导植物产生抗病性防控植物真菌病害是一种安全有效、经济环保的病害防治途径,已受到研究者们的关注和重视,如化学诱抗剂BABA、BTH和CTS等的使用(朱路路,2014)。农用抗生素诱导植株产生抗病性,其诱抗效果可通过植株内相关防御酶活性变化、防御物质含量变化及抗病相关基因表达量变化等反映出来(Lu et al.,2019;凤琦和张晶钰,2020)。甄丹妹等(2019)研究了R&M诱导黄瓜白粉病抗性,发现这种诱导作用在病原菌侵染的条件下表现得更明显。
正常生长的植株受到诱导处理后,与抗病反应相关的酶活性升高是诱导抗性产生的作用机制之一,其中CAT(Ehret et al.,2010)和LOX(Il' inskaya et al.,2000)活性的变化通常作为衡量植物体内防卫反应抵制病原微生物侵染的重要指标。已有研究表明,CAT活性可由生物刺激素诱导增强,进而诱导植株产生对病原菌的抗病性。本研究表明,温室条件下,用80 mg/L R&M喷雾处理4~5叶期本生烟草植株,可诱导烟草叶片中CAT和LOX活性增强,喷施R&M 1 d后CAT活性即处于增强状态,且1~7 d持续显著高于CK;LOX活性在80 mg/L R&M处理的前2 d活性几乎无变化,第3 d后LOX活性显著增强。R&M诱导烟草植株烟叶中CAT和LOX活性增强,与杜亚楠等(2012)研究发现链霉菌702中分离纯化的新型多烯大环内酯类抗生素农抗702通过诱导增强CAT活性进而增强植株抗病力的结论一致,亦与本课题组甄丹妹等(2019)前期研究发现R&M能诱导黄瓜叶片中CAT活性提高的结论一致。LOX是形成JA的关键酶(Oliw,2022),说明R&M也可能通过促使JA的形成,在植物体内充当抗病相关信号分子以促进JA介导的抗病信号转导途径,从而起到诱导烟草植株产生抗灰霉病菌的作用。
正常生长的植株受到诱导后,与抗病反应相关的活性物质含量变化是诱导抗性产生的作用机制之一,其中HO含量的变化通常作为衡量植物体内防卫反应抵制病原微生物侵染的重要指标。HO具有毒性,该物质产生的羟基自由基生物活性很强,因此,植株体内过量的HO需要CAT进行适量清除以维持细胞内的稳态(Willekens et al.,1995)。本研究中,温室条件下,80 mg/L R&M喷雾处理4~5叶期本生烟草植株,烟叶中防御物质HO含量1 d后迅速达最高值,为CK的1.13倍,表明R&M能迅速激发植株细胞内活性氧的产生;在第2~3 d,可能由于体内CAT防御酶活性持续增高,将HO分解为水,导致其含量第2 d后逐渐降低,并逐步稳定在与CK相近水平,避免了植物由于活性氧长时间含量过高而损伤细胞。因此,本研究中80 mg/L R&M处理使烟叶HO含量先升高后降低这一结论符合科学逻辑,且与本课题组甄丹妹等(2019)前期研究发现R&M处理后1~5 d诱导黄瓜叶片中HO含量升高的结论一致,但相比第1张真叶展开和第2张真叶展开2/3时的黄瓜,R&M诱导4~5叶期本生烟草植株HO含量显著升高出现的时间更早,为诱导处理后第1 d。研究结果充分证明R&M诱导植物抗病性的作用机制之一是由于R&M诱导了本生烟草植株体内HO含量的暴发并最终维持其稳态。
基因控制合成的木质素与植物的抗病性相关联,可参与植株的抗病防卫反应(朱海生等,2018)。抗病相关PR基因和经过诱导处理后其表达量的上调,可作为植物抗病能力增强的重要指标(van Loon and van Strien,1999;李白,2011;田华,2016)。本研究使用80 mg/L R&M溶液灌根处理4~5叶期本生烟草2 d后接种灰霉菌孢子悬浮液,结果显示,木质素合成基因及病程相关PR蛋白基因、相对表达量均有不同程度上调,分别在24、24和72 h时相对表达量达最高值,R&M诱导不同时间后的表达量始终显著高于CK,表明R&M的抗性诱导是玫瑰黄链霉菌Men-myco-93-63防治灰霉病的作用机制之一。
4 结论
R&M通过诱导烟叶产生过敏反应、协调活性氧水平、增强防御酶活性、促进抗病相关基因表达等提高烟草植株抗病性。R&M浓度在80 mg/L时即可诱导烟草植株产生对灰霉病菌的抗病性,药剂作用方式为喷雾,其操作简便,发酵易获得所需药品。玫瑰黄链霉菌Men-myco-93-63产生的活性代谢产物R&M具有作为植物病害诱抗剂的潜力,有望应用于植物灰霉病等重要病害的绿色防控。
