富硒芽孢杆菌对赤红壤硒转化及菜心硒吸收累积的影响
2022-09-05梁潘霞潘丽萍黄太庆陈锦平江泽普刘永贤
廖 青,邢 颖,梁潘霞,潘丽萍,黄太庆,陈锦平,江泽普,刘永贤
(广西农业科学院农业资源与环境研究所/广西富硒农业研究中心,广西南宁 530007)
0 引言
【研究意义】硒是15种人体必需微量元素之一,在疾病防治、提高人体免疫系统和防止衰老方面具有重要意义。由于人体自身不能合成硒,因此通过土壤—植物—动物转运补硒是目前最安全有效的人体补硒途径(Premarathna et al.,2012;Chilimba et al.,2012)。土壤硒是人体和动植物获得硒的主要来源。广西富硒土壤面积达7.57万km(唐广生等,2021),为目前中国圈定出的最大面积的富硒土壤区域。然而,在广西富硒土壤上种植的300多个作物样品中,只有70多个样品能达天然富硒水平,作物富硒率仅24%(刘永贤等,2015),且天然富硒作物硒含量处于富硒农产品标准硒含量要求范围的中下限水平(黄太庆等,2018)。土壤高硒低效问题制约了广西富硒农业产业的可持续发展。土壤硒的生物有效性受环境微生物的显著影响(徐巧林等,2016),微生物对土壤硒形态的转化起着重要作用,因此,研究微生物对富硒土壤中土壤硒形态转化作用及其对作物硒吸收累积的影响,对于开发利用广西富硒土壤资源及生产天然富硒农产品具有重要意义。【前人研究进展】作物对土壤硒的吸收受土壤硒含量、硒形态和硒价态等多种因素影响。土壤硒的形态和价态是土壤硒有效性和迁移转化的重要因素(Shardendu et al.,2003),而土壤硒的形态、价态、迁移及有效性受环境微生物的高度影响(Barillas et al.,2011;徐巧林等,2016)。李杰等(2013)研究发现水稻对富硒土壤中硒的吸收累积低于低硒土壤,说明土壤总硒含量并不是决定植物硒含量最主要的因素,土壤有效硒含量才是植物硒含量的决定性因素。土壤中硒通常分为可溶态硒(SOL-Se)、可交换态及碳酸盐结合态硒(EX-Se)、铁锰氧化物结合态硒(FMO-Se)、有机结合态硒(OM-Se)和残渣态硒(RES-Se)5种形态(Wang et al.,2012),其中SOL-Se和EX-Se易被植物吸收利用,为土壤有效硒(Hu et al.,2014)。土壤中硒价态包括Se、Se、Se和Se(Fernández-Martínez and Charlet,2009),其中能被植株吸收利用的硒价态有Se、Se(Qin et al.,2017)和部分Se(有机硒化合物,硒代蛋氨酸和硒代半胱氨酸)(Pilon Smits et al.,2017)。Durán等(2013)通过共接种耐硒菌(.B16)和丛枝菌根真菌()促进小麦谷粒对硒酸盐和亚硒酸盐的吸收,从而大幅提高了小麦谷粒中的硒含量;张如等(2018)从湖北恩施硒矿区超积累硒植物中分离到1株耐硒内生菌,能将亚硒酸钠(NaSeO)转化为硒代胱氨酸(SeCys),并能提高植株对硒的吸收和转运能力;Luo等(2019)在冬小麦苗期接种丛枝菌根真菌,发现其能明显促进冬小麦嫩芽和根部对硒酸盐或亚硒酸盐的吸收。接种富硒菌株是作物硒生物强化的有效手段(Durán et al.,2013,2015)。【本研究切入点】目前关于富硒微生物提高作物硒吸收的研究报道,多是基于在作物栽培过程中添加外源硒,通过接种富硒微生物对添加的外源硒进行转化,促进作物硒吸收,从而提高作物硒含量。然而,利用微生物直接活化土壤硒从而促进植物硒吸收利用的相关报道甚少。【拟解决的关键问题】以对环境适应性强的2株富硒芽孢杆菌为供试菌株,研究其对土壤硒形态、价态、pH及对菜心硒吸收累积的影响,探索微生物—土壤—植株的硒转化效应,为高效利用广西富硒土壤资源提供参考。
1 材料与方法
1.1 试验材料
供试富硒芽孢杆菌分别为YLB1-6(,硒转化率为74.22%)和TXB2-5(,硒转化率为55.31%),由广西农业科学院农业资源与环境研究所从富硒土壤分离、筛选获得,并由中国典型培养物保藏中心保存,菌株保藏编号分别为CCTCC NO.M2020342和CCTCC NO.M2020343。富硒芽孢杆菌培养所用培养基为灭菌的LB培养液和营养琼脂。试验土壤采自广西桂平市,为花岗岩母质赤红壤,土壤基本理化性状:全硒0.95 mg/kg,全氮1.30 g/kg,全磷0.736 g/kg,全钾4.76 g/kg,碱解氮129 mg/kg,速效磷46.0 mg/kg,速效钾82.6 mg/kg,有机质16.0 g/kg,pH 6.3。供试菜心品种为市售丰农旺50天尖叶甜菜心。
1.2 试验设计
1.2.1 富硒芽孢杆菌的活化 从斜面菌种挑取菌种,转接到营养琼脂培养基上,于37 ℃下培养24~48 h进行活化。从培养好的平板上挑取菌种,转接到营养琼脂培养基上,于37 ℃下培养24 h。
1.2.2 菌悬液的制备 将活化好的菌株转接到LB培养液中,于37 ℃、200 r/min摇床培养24 h后,将菌株培养液以5000 r/min转速离心10 min收集菌体,用无菌的0.85%氯化钠清洗菌体2次后,再用适量无菌水重悬,使菌悬液的最终含量约为1×10CFU/mL。制备好的菌悬液用于盆栽接种试验。
1.2.3 菜心种子处理 种子用75 %乙醇(没过种子)浸泡1 min,倒出乙醇溶液,然后用0.4%次氯酸钠(没过种子)浸泡2 min消毒后倒出,再用灭菌蒸馏水清洗3次,无菌条件下晾干,备用。
1.2.4 土壤处理 土壤自然风干、磨碎并过5 mm筛,用于盆栽试验。
1.2.5 盆栽试验 试验共设置3个处理:对照(CK,无菌水)、添加YLB1-6处理(YLB1-6)、添加TXB2-5处理(TXB2-5),每个处理3盆(重复),共9盆。盆栽试验于2020年11—12月在广西农业科学院本部科研基地塑料大棚中进行。采用内径18 cm、高度12 cm的塑料圆盆进行盆栽试验,每盆装土1.75 kg,加入300 mL蒸馏水湿润土壤。于2020年11月7日,每盆播种10颗处理过的菜心种子,待菜心苗长出4片真叶时进行间苗,每盆保留长势相当的6株菜心苗。间苗后,加入制备好的菌悬液至菜心植株根部,每盆施入菌悬液量为10 mL,并以施加等量无菌水作为CK。盆栽试验中浇水全部使用无菌水。盆栽置于塑料大棚内,植株生长期间保持自然光照及通风,棚内温度控制在15~35 ℃,保持土壤湿度约为田间持水量的70%。于2020年12月27日收获菜心。
1.3 测定项目及方法
1.3.1 植株相关指标测定 植株采样:将各盆菜心连根采收后,蒸馏水将其洗净并用吸水纸擦干,再用不锈钢剪刀将菜心地上部与地下部剪开,分别称取各盆菜心地上部与地下部鲜重;然后将植株样品105 ℃杀青30 min后,60 ℃烘至恒重,分别称干重后粉碎备用。经HNO-HClO(V∶V=4∶1)消解后,再用6 mol/L HCl还原,参照GB 5009.93—2017《食品安全国家标准 食品中硒的测定》,采用氢化物原子荧光光谱法测定菜心各部分中的Se含量。
菜心硒转移系数(TF)=地上部硒含量/地下部硒含量;每盆菜心硒总累积量(μg/盆)=地上部硒累积量+地下部硒累积量=[地上部硒含量×菜心地上部鲜样质量+菜心地下部硒含量×菜心地下部鲜样质量]×1000,式中,×1000为将mg换算成μg。
1.3.2 土壤相关指标测定 土壤去除植物及碎屑物质,自然风干后,部分过1 mm筛,部分过100目筛。过1 mm筛的土样用于pH测定,pH的检测依照《土壤分析技术规范》电位法。过100目筛的土样用于硒形态和硒价态测定。各土壤硒形态即SOL-Se、EX-Se、FMO-Se、OM-Se及RES-Se采用连续浸提法(瞿建国等,1997;邢颖等,2018)提取;土壤有效态硒(AVASe)为SOL-Se与EX-Se之和。土壤硒价态,包括SOLSe和EX-Se中的Se、Se、Se的提取、测定方法参考Wang等(2012)的方法,具体步骤为:(1)上清液中Se含量直接测定;(2)Se含量通过差减法求得,在上清液中加入6 mol/L HCl ,100 ℃水浴加热15 min还原后测定,此时测定的硒含量为Se与Se之和,扣除(1)中Se浓度后即为提取液中的Se含量;(3)Se含量也是通过差减法求得,在上清液中加入1 mL 5%KSO,90 ℃水浴加热1 h氧化,然后再加入6 mol/L HCl,100 ℃水浴加热15 min还原后测定,此时测定的硒含量为Se、Se和Se之和,扣除(2)中Se和Se浓度后即为提取液中的Se含量。土壤硒形态和硒价态均采用氢化物发生—原子荧光光谱法测定。
1.4 统计分析
使用Excel 2007对试验数据进行处理;用SPSS 17.0进行方差分析,应用Duncan’s新复极差法进行差异显著性检验。
2 结果与分析
2.1 富硒芽孢杆菌对土壤硒形态的影响
如表1所示,接种富硒芽孢杆菌促进了土壤硒形态的转化。与未接种相比,接种富硒芽孢杆菌处理其土壤RES-Se含量均极显著减少(<0.01,下同),而AVA-Se含量均有不同程度的增加,YLB1-6处理表现为极显著增加,TXB2-5处理显著增加(<0.05,下同);但接种不同富硒芽孢杆菌,土壤各形态硒含量变化并不一致。经菌株YLB1-6处理后,土壤RES-Se含量较CK减少13.18%(绝对值,下同),而EX-Se含量显著增加,SOL-Se和FMO-Se含量极显著增加,AVA-Se较CK增加4.21%,AVA-Se的增加来源于SOL-Se和EX-Se的增加;TXB2-5处理中,土壤RESSe较CK减少9.56%,而SOL-Se含量显著增加,OMSe含量极显著增加,AVA-Se含量较CK增加2.99%,AVA-Se的增加主要来源于SOL-Se的增加。分析结果表明,富硒芽孢杆菌的施入打破了土壤硒形态的平衡,激活土壤中无效态硒,促进RES-Se向不同硒形态的转化并提高土壤AVA-Se含量,但不同芽孢杆菌对土壤硒的形态转化存在一定的差异。

2.2 富硒芽孢杆菌对土壤硒价态的影响
由表2可知,供试富硒赤红壤的土壤有效硒以可溶态Se(SOL-Se)和Se(SOL-Se),以及可交换态及碳酸盐结合态Se(EX-Se)和Se(EX-Se)存在,不存在可溶态Se(SOL-Se)和可交换态及碳酸盐结合态Se(EX-Se)。CK中土壤硒各价态含量表现为EX-Se>EX-Se>SOL-Se>SOL-Se;接种富硒芽孢杆菌的处理其土壤硒各价态含量表现为EXSe>EX-Se>SOL-Se>SOL-Se。SOL-Se价态中,YLB1-6处理的SOL-Se较CK极显著增加,TXB2-5处理的SOL-Se较CK显著增加,但2种菌株处理SOL-Se与CK相比均无显著变化(>0.05,下同);EX-Se价态中,2种菌株处理的EX-Se与CK相比变化均无显著差异,而EX-Se均较CK极显著增加;相较CK和TXB2-5菌株处理,YLB1-6菌株处理的土壤SOL-Se和EX-Se含量增加更为显著。上述结果表明,富硒赤红壤条件下,接种富硒芽孢杆菌后所增加的AVA-Se主要是来自SOL-Se和EX-Se含量增加,且YLB1-6处理对于提高AVA-Se价态含量的效果优于TXB2-5处理。

2.3 富硒芽孢杆菌对环境pH的影响
前期研究中,菌株用灭菌LB培养液培养,并以未接种菌株的灭菌LB培养液作为对照,培养后测定培养液pH,结果(表3)发现,未接种菌株的培养液pH为7.43,而接种YLB1-6和TXB2-5菌株后培养液pH分别为8.03和7.66,与未接种菌株的培养液pH相比,分别提高8.08%和3.10%,推测菌株在生长代谢过程中能分泌碱性物质。盆栽接种菌株试验后测定各处理土壤pH,与CK相比,YLB1-6和TXB2-5处理的土壤pH分别提高4.31%和1.75%,其中YLB1-6处理达极显著水平。

2.4 富硒芽孢杆菌对菜心硒吸收、转移的影响
植株收获后,采集菜心地上部和地下部,分别进行硒含量分析。由图1可知,CK、YLB1-6和TXB2-5处理菜心地上部硒含量分别为0.021、0.042和0.037 mg/kg。经富硒芽孢杆菌处理,菜心地上部硒含量均显著高于CK,其中,YLB1-6处理地上部硒含量为CK的2.00倍,TXB2-5处理地上部硒含量为CK的1.76倍,说明接种富硒芽孢杆菌的处理能明显促进菜心地上部对土壤硒的吸收。此外,通过接种富硒芽孢杆菌,菜心地上部(可食部分)硒含量符合DB 45/T 1061—2014《富硒农产品硒含量分类要求》的蔬菜类富硒标准,即0.01~0.10 mg/kg,说明接种富硒芽孢杆菌是提高菜心可食部分硒含量的安全、有效的手段。接种富硒芽孢杆菌的2个处理菜心地下部硒含量差异明显,YLB1-6处理的菜心地下部硒含量与CK无显著差异,而TXB2-5处理却极显著高于CK,为CK的1.36倍。此外,每个处理菜心不同部位硒含量均表现为地下部>地上部,CK的地下部硒含量为地上部的2.71倍,YLB1-6和TXB2-5处理地下部硒含量分别为地上部的1.22倍和2.09倍,菜心地下部为吸收土壤硒的主要器官,地上部硒来源于地下部硒的往上转移。
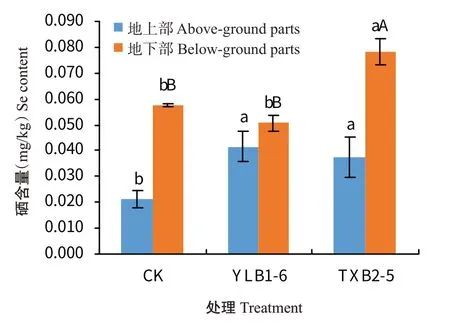
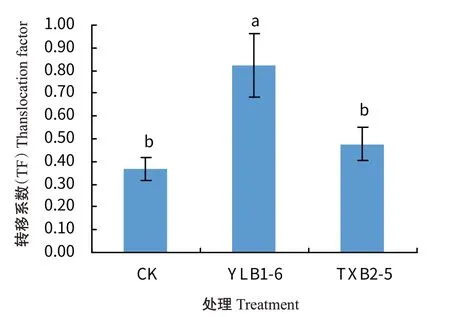
TF代表菜心植株中的硒由地下部转运至地上部的能力。由图2可知,CK、YLB1-6和TXB2-5处理的TF值分别为0.37、0.82和0.48,YLB1-6和TXB2-5处理的TF值较CK分别提高121.62%和29.73%,YLB1-6处理的TF值较CK和TXB2-5显著提高。可见YLB1-6处理更有利于菜心中硒往地上部转移,其中原因可能与YLB1-6处理下土壤SOL-Se和EX-Se含量较高有关,这2种硒价态在作物硒吸收转移上相对于有效态硒中其他价态更具有优势。而TXB2-5处理下菜心虽然地上部及地下部硒含量均明显提高,但地下部硒含量更高,硒往地上部转移的能力不及YLB1-6处理。2种富硒芽孢杆菌处理对菜心硒吸收、转移存在差异,可能是由于菌株所代谢转化的硒形态价态及其自身分泌物质差异所引起。
2.5 富硒芽孢杆菌对菜心生物量及硒累积量的影响
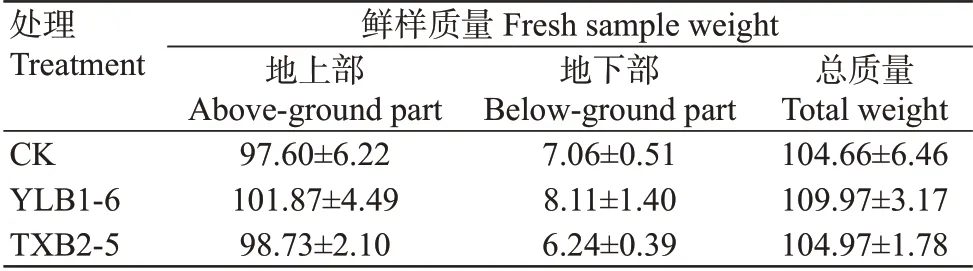
对各处理菜心生物量进行测定,如表4所示,接种富硒芽孢杆菌菜心地上部均表现为增产趋势,但与CK间鲜样质量差异未达显著水平,YLB1-6和TXB2-5 处理鲜样质量较CK 分别增加4.38%和1.16%;接种富硒芽孢杆处理地下部鲜样质量与CK相比,YLB1-6处理增加14.87%,而TXB2-5处理减少11.61%,但各处理间差异均未达显著水平。从菜心鲜样总质量来看,各处理间也无显著差异。可见,接种富硒芽孢杆菌对菜心生物量影响不大。
本研究进一步对菜心各部位硒累积量进行分析,由表5可知,YLB1-6和TXB2-5处理的菜心地上部硒累积量分别比CK增加104.82%和78.89%,且与CK间差异分别达极显著和显著水平,说明接种富硒芽孢杆菌能有效地促进菜心地上部硒的累积。各处理间地下部硒累积量并无显著差异;从菜心硒总累积量来看,与CK相比,YLB1-6处理的硒总累积量增加87.04%,差异达极显著水平,TXB2-5处理的硒总累积量增加68.83%,与CK间差异显著。

3 讨论
广西主要富硒土壤中赤红壤总硒含量最高,平均含量0.964 mg/kg(邢颖等,2018),而有效态硒含量却很低,仅占总硒的1.73%,赤红壤高硒低效特征尤为突出。富硒赤红壤具有强酸性、高铁铝氧化物及大量黏粒吸附固定的特性,制约了富硒赤红壤硒资源的利用。土壤中硒的形态、价态及迁移、生物有效性与微生物息息相关。微生物通过对硒的转运、还原、同化、氧化和甲基化等代谢作用,参与土壤硒各价态(Se、Se、Se、Se)的转化及有机态硒的形成,是土壤硒转化的决定性因子(Dowdle and Oremland,1998;Winkel et al.,2012)。利用微生物活化土壤中硒,提高硒的有效性,是开发利用土壤自然硒资源的有效途径。本课题组在对土壤耐硒菌株进行分离筛选及鉴定时发现,芽孢杆菌对硒具有较强的耐受性,环境适应性较强(廖青等,2017)。且室内接种菌株土壤培养试验表明,接种富硒菌株能活化土壤硒,增加水溶态硒或交换态硒含量,从而提高土壤有效硒含量(龙云川等,2017;廖青等,2018)。
为进一步了解所分离的富硒芽孢杆菌对土壤中硒的转化作用,以及对植物硒吸收、转移、累积和植物生物量的影响,本研究开展富硒芽孢杆菌接种的盆栽试验。接种不同富硒芽孢杆菌,菜心地上部硒含量均较CK有明显提高,其原因可能是接种富硒芽孢杆菌的处理,促进了土壤RES-Se向AVA-Se转化,土壤SOL-Se和EX-Se显著增加,而植物对这些Se(主要是有机硒化合物)的吸收速率极高(Kikkert and Berkelaar,2013);另外,陈大清(2004)研究表明不同形态硒在植物中的转运速率Se>Se>Se,Se和Se能较快速地向作物地上部转移,在这2种价态硒的共同作用下作物地上部累积较多的硒。菜心地下部对土壤硒的吸收、转移能力存在差异,可能与土壤中存在的Se总量差异有关,因为相对于Se和Se,植物对Se的转移能力较低,根部吸收Se后易转化为其他形态而累积在植物根部,不易转移到地上部(Jiang et al.,2015)。因此,与CK和YLB1-6处理相比,TXB2-5处理菜心地下部硒含量较高。植株硒累积量与植株鲜样质量及其硒含量有关(黄太庆,2018;熊军,2019),是表征土壤硒活化能力的重要指标。菜心增加的硒累积量是富硒芽孢杆菌活化土壤硒能力强弱的体现,本研究发现接种富硒芽孢杆菌显著提高了菜心硒累积量,且YLB1-6处理菜心硒累积量高于TXB2-5处理,说明YLB1-6菌株活化土壤硒的能力强于TXB2-5菌株。另外,研究表明,外源适量施硒对菜心产量无显著影响(莫海珍,2006;郭巨先,2020);本研究中,在没有外源硒补充的条件下,接种富硒芽孢杆菌提高了土壤有效硒含量、促进了菜心硒吸收,但对菜心生物量无显著影响,与前人研究有类似的结论,可能是由于硒并非菜心生长必需的营养元素,对菜心产量无显著正效应。
土壤pH是影响土壤有效硒的重要因素之一,土壤pH可控制硒与土壤组分的吸附和解吸过程,也可以通过氧化还原电位、土壤微生物种类和活性等影响硒的有效性(Goh and Lim,2004)。本研究中,接种富硒芽孢杆菌后,土壤pH均有不同程度的提高,土壤pH的改变,反过来也会影响土壤中硒形态的转化,从而影响硒的有效性。本研究中,接种富硒芽孢杆菌后,土壤pH均有不同程度的提高,土壤SOL-Se含量也明显增加,与张艳玲等(2002)的研究结果相一致。不同富硒芽孢杆菌均能对RES-Se进行转化,但转化后的硒形态有所不同,可能是不同富硒芽孢杆菌所代谢产生的物质成分不同,其与硒结合的产物不同所致。此外,土壤pH还可通过氧化还原电位、微生物活性种类等间接影响土壤硒价态变化,这可能是接种富硒芽孢杆菌后,土壤SOL-Se和EXSe增加的原因。
目前,利用富硒菌株促进植物硒吸收的相关研究多是在添加外源硒的基础上开展,而本研究通过在天然富硒土壤中接种富硒芽孢杆菌盆栽试验,证实富硒芽孢杆菌能有效地活化土壤硒,对于促进作物地上部对土壤硒的吸收、累积有较好的效果,为作物硒生物强化提供了更多的技术手段。
4 结论
富硒芽孢杆菌具有活化土壤硒的能力,能促进土壤残渣态硒向有效态硒转化,并促进菜心地上部对土壤硒的吸收累积。与TXB2-5相比,YLB1-6更有利于植株体内硒向地上部转移,具有更好的田间应用价值。
