苯并三氮唑基乙酸HOF的制备及质子导电性能研究
——推荐一个绿色综合化学实验
2022-09-03孟祥茹余一泓江远帆刘宇阳李纲
孟祥茹,余一泓,江远帆,刘宇阳,李纲
郑州大学化学学院,绿色催化中心,郑州 450001
随着世界经济的快速发展,人类社会所消耗的化石能源与日俱增,由此造成了能源短缺以及严重的环境污染问题,因此寻找清洁、可持续的新能源成了全世界亟待解决的问题。质子交换膜燃料电池作为一种新的能源形式,备受研究者的青睐[1],其原理上相当于水电解逆装置,由阳极、阴极和质子交换膜组成,是目前最有应用前景的新能源之一。质子交换膜是其核心部件,直接决定着电池的寿命和性能。然而,目前商用的全氟烷基磺酸系Nafion膜存在着成本高、价格昂贵、制备复杂以及工作条件要求苛刻等缺陷,限制着其广泛应用。因此,人们一直致力于寻找新的具有高的质子导电率、结构稳定的可替代材料[2,3]。
近年来,有机结构单元通过氢键自组装而构筑成的氢键有机框架(Hydrogen-bonded organic frameworks,HOFs)材料,以其高结晶度、多孔性、含有丰富氢键网络等特点[4,5],非常有利于质子的高效传输,因而受到了研究者的高度关注。2016年,Ghosh课题组[6]首次报道了两例具有良好质子导电性能的多孔HOFs材料HOF-GS-10和HOF-GS-11,并且其质子导电率可与常用的质子传导膜如Nifion隔膜相媲美。另外,由于氢键非常灵活且易于再生,因此HOFs能够通过重结晶等方法自我修复和再生,同时还具有合成简便和成本低廉的特点[4],非常有利于开发其质子导电应用等功能[7]。
本实验来源于国家自然科学基金和国家级大学生创新创业训练计划项目的最新成果,是以训练本科生的综合实验能力以及开拓知识视野、树立“绿色化学”理念和环保意识为目的而设计的一个综合性实验。据我们所知,这也是第一次在本科生的化学实验中引入有关HOF材料的制备与质子导电性能的研究。首先,选择环境友好的水为溶剂,采用一步合成法绿色高效地制备苯并三氮唑基乙酸晶体(HOF 1),再借助红外光谱、元素分析以及粉末X射线衍射(PXRD)确认HOF 1的组成和纯度。随后,把晶体研磨压制成圆片,采用准四电极法,测试其交流阻抗图谱,计算质子导电率和活化能,据此判断其质子导电机理,完成一个基本的科学研究训练过程。
为了方便该综合实验的顺利完成,我们对HOF 1的制备时间、反应温度以及交流阻抗测试的耗时、测试湿度和温度等实验条件进行了反复优化,在确定最优条件后又做了多次重复实验进行验证,以确保实验结果的可重现性以及实验课时的可行性。
1 实验目的
(1) 掌握一种HOF的制备方法。
(2) 使学生了解HOFs材料的基本特征和质子导电的一般原理。
(3) 掌握元素分析、红外光谱、粉末X射线衍射图谱的测试及分析方法。
(4) 掌握一定湿度下质子导电率的测试方法,了解质子导电机理的判断依据。
(5) 通过实验,使学生接触科技前沿、开拓视野、激发科研兴趣、训练科学思维、培养综合运用知识的能力。
2 实验原理
氢键有机框架一般是通过设计合适的有机化合物(如携有电负性大的功能基团等),选用适当的溶剂重结晶而得到的[7]。本实验以苯并三氮唑和氯乙酸为原料,以水为溶剂,通过亲核取代反应,一步即可制备苯并三氮唑基乙酸(合成路线见图1),然后用水重结晶即可得到HOF 1的晶体。

图1 苯并三氮唑基乙酸(HOF 1)的合成路线
单晶X射线衍射结果表明,HOF 1的框架中含有丰富的氢键网络(图2、图3),非常有利于质子的传输。热分析测试表明其在200 °C之前呈现出很高的热稳定性(图4)。此外,将HOF 1样品在水中浸泡2周后,其PXRD图谱与浸泡前的PXRD图谱吻合的很好(图5),说明其具有优良的水稳定性,这些都为质子导电性能研究奠定了坚实的物质基础。

图2 由氢键支撑的HOF 1的二维图(虚线表示氢键)

图3 HOF 1的三维固态堆积图(虚线表示氢键)

图4 HOF 1的热重分析图
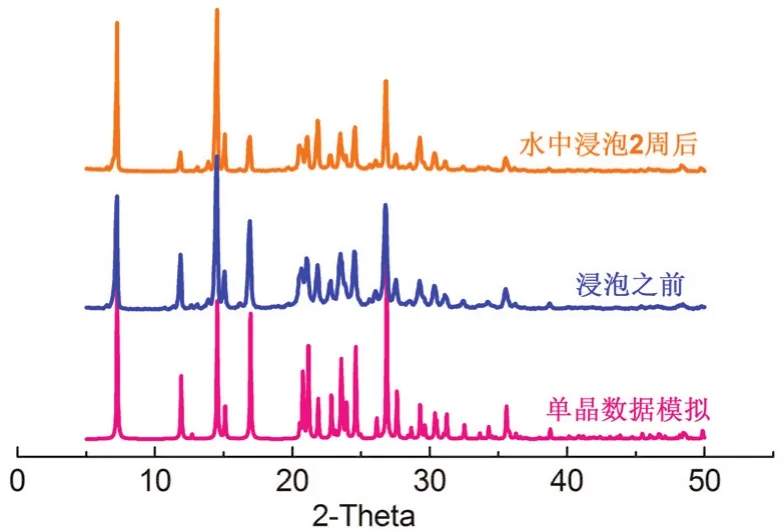
图5 HOF 1的单晶模拟图以及样品在水中浸泡前后的粉末X射线衍射图谱
质子导电的基本原理是质子的定向移动,它主要与质子载体、质子源等有关。质子是氢原子失去仅有的一个电子后形成,大小在费米级(10−13cm),是最轻、最小的离子。质子是一个裸露的带正电的原子核,极易与其他原子的电子发生相互作用,通常以氢键的形式与溶剂分子结合以更稳定的溶剂化分子形式存在,例如H3O+,NH4+等。质子运输机理一般可分为跳跃机理(Grotthuss mechanism)和运载机理(Vehicle mechanism) (图6)。判断质子传导机理的主要方法是通过实验得到质子导电率数据,进而采用阿仑尼乌兹方程拟合得到活化能(Ea)数值,然后判断质子导电机理[8]。当活化能<0.4 eV,质子主要通过体系内的氢键网络进行传输,为跳跃机理。当活化能>0.4 eV,由于质子与水分子结合形成水合离子(溶剂离子),而水合离子解离需要克服更高能垒,因此水合离子依靠载体浓度梯度进行定向移动,所以质子电导率是载体扩散速率的函数,此时质子导电机理为运载机制。

图6 质子传导机理示意图[8]
3 主要试剂和仪器
3.1 试剂
氯乙酸(分析纯,天津市大茂化学试剂厂),苯并三氮唑(分析纯,罗恩试剂公司),氢氧化钠(分析纯,国药集团化学试剂有限责任公司),盐酸(分析纯,洛阳市化学试剂厂),广泛pH试纸,去离子水。自制银片电极(将厚度为0.2 mm的银箔加工成直径为5 mm的圆片,圆片的一侧焊接铜导线),相对湿度分别为75%、85%、98%的测试瓶(在瓶内分别装上适量的NaCl饱和溶液、KCl饱和溶液和纯水)。
3.2 仪器
常规玻璃仪器(三口瓶、球形冷凝管、恒压滴液漏斗、烧杯、布氏漏斗,抽滤瓶等)。GM-0.33A型隔膜泵(天津市津腾实验设备有限公司);DF-1015集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司);90-2磁力搅拌器(上海沪西分析仪器有限公司);HH-11-1电热恒温水浴锅(常州诺基仪器有限公司);DHG-9140A恒温干燥箱(上海一恒科学仪器有限公司);YP601N台秤(上海精密科学仪器有限公司);BSA 124S电子分析天平(赛多利斯科学仪器(北京)公司);FLASH smart元素分析仪(德国,Elementar);Nicolet iso 50 FTIR红外分光光度仪(美国,Thermo Fisher);D8 ADVANCE X射线粉末衍射仪(德国,布鲁克);CHI660E型电化学工作站(上海辰华仪器有限公司);FW-4A压片机(天津天光光学仪器有限公司)。
4 实验步骤
4.1 HOF 1晶体的制备
首先向100 mL的三口瓶中加入2.35 g (0.025 mol)氯乙酸,搅拌下,通过滴液漏斗缓慢向其中滴加5%氢氧化钠水溶液,调至pH = 7 (广泛pH试纸控制),然后向其中加入3.0 g (0.025 mol)苯并三氮唑固体。采用油浴加热,回流1.5 h,期间补加5%氢氧化钠溶液,使反应体系的pH始终维持在8-10之间。随后降至室温,溶液转移至100 mL的烧杯中,用3 mol·L−1盐酸调至pH为2-3之间,有大量白色沉淀生成。抽滤,得乳白色固体。用少量纯水洗涤2-3次,再用水进行重结晶,得到大量无色长条状晶体。在150 °C下烘干(10 min左右)。称重,计算产率。
4.2 元素分析测试
实验员提前开机,设置仪器参数,测试标样,做标准曲线。学生在教师的指导下,在百万分之一的天平上准确称取三份质量在1.800-2.100 mg之间的HOF 1样品于锡杯中,记下样品质量,包好后再次称量,在确认锡杯无破损的情况下,再次记录样品的质量以及样品编号并放入样品盘,进行测试,得到元素分析结果。
4.3 红外光谱测定
实验员事先把优级纯的溴化钾在110 °C的烘箱中烘8-10 h,在红外灯下将此溴化钾置于玛瑙研钵中研磨成100-200目左右的粉末,置于干燥器中备用。取1 mg左右的HOF 1和约100 mg的干燥溴化钾粉末置于玛瑙研钵中,混匀研细。将研磨好的粉末转移到钢制模具中,置于压片机上,制成透明的样品片。先扫描背景,再将样品片放入红外分光光度仪的光路中进行扫描,得到红外光谱图。
4.4 粉末X射线衍射图谱测试
把10 mg左右的HOF 1晶体在玛瑙研钵中研磨成粉末,然后转移至样品架的凹槽中间,用载玻片把样品压实压平。再把样品架放入样品室的样品卡槽中进行测试,即可得到HOF 1的PXRD图谱。
4.5 质子导电性能测定
采用交流阻抗谱法,测试不同温度和湿度条件下的阻抗值。测试步骤如下:首先,称取三份质量均为35 mg的HOF 1样品于玛瑙研钵中,研磨并在2-3 Mpa压力下压成三个直径均为5 mm的圆片。随后,用两个自制银片电极将样品片夹紧(样品片处于两电极之间,类似三明治),然后将电极装置分别悬挂于三个相对湿度为75%、85%、98%的测试瓶中,平衡6 h。连接到电化学工作站进行交流阻抗数值测试。温度范围60-100 °C,采用水浴控温,每隔10 °C测量一次交流阻抗值(平行测定三次,取平均值)。
5 结果与讨论
5.1 HOF 1的元素分析
从表1可以看出,三次测试的结果非常接近,并且HOF 1中N、C、H的实际含量与理论计算值也吻合的很好,说明得到了目标产物并且其纯度足够高,可以满足性质测试的需要。如果三次元素分析的结果不平行或者与理论值相差较大,则需要再次进行重结晶。

表1 HOF 1的元素分析结果
5.2 HOF 1的红外光谱
学生可以根据波谱分析的理论知识,对红外光谱图中比较典型的吸收峰进行指认。比如在图7中,可以观察到在3439 cm−1左右出现羟基的伸缩振动峰;在3081 cm−1附近出现苯环的C-H伸缩振动峰;2997 cm−1左右可以观察到CH2基团的伸缩振动峰;在1728 cm−1左右出现羰基的伸缩振动峰,说明羧基没有脱质子;在1500和1462 cm−1附近较强的吸收峰是典型的C=C、C=N、N=N伸缩振动峰;747 cm−1附近出现的C-H面外弯曲振动吸收峰是典型的苯环邻位取代标志。

图7 HOF 1的红外光谱图
5.3 HOF 1的PXRD图谱
通常情况下,借助粉末X射线衍射仪测定化合物的PXRD图谱,然后与标准卡片对照,即可确定化合物的组成和物相结构。但是,对于本实验的目标产物HOF 1,其标准PXRD图谱无法在卡片库中找到。因此我们事先培养了HOF 1的单晶,并且借助单晶X射线衍射仪测定了其单晶结构。借助mercury软件和HOF 1的单晶数据(cif数据)可以模拟出其PXRD图谱(图5)。学生只需要测定该产物的PXRD图谱,然后与图5比较即可确定目标产物的组成。另外,从图5可以看出,实验测得的HOF 1的PXRD图谱与根据单晶数据模拟得到的谱图吻合的很好,说明所制备的产物是我们的目标产物,并且相纯度足够高,可以满足性质测试的需要。
5.4 质子导电分析和数据处理
为了直观比较阻抗值R的变化趋势,可借助Origin绘图软件将同一湿度下、不同温度下的Nyquist图进行叠加(图8)。从图中可以看出,同一湿度下,从60 °C上升到100 °C,HOF 1的阻抗值随温度的升高而降低。

图8 不同湿度及不同温度下HOF 1的Nyquist图
随后,根据公式σ = L/SR(其中,σ(S·cm−1)表示质子电导率;L(cm)为样品圆片的厚度,S(cm2)为样品片与电极的接触面积;R(Ω)为阻抗值),计算出相应的质子电导率σ。由表2可以看出,在同一温度下,随着湿度升高,质子导电率不断升高。在同一湿度下,随着温度升高,质子导电率也在不断升高。在98% RH和100 °C条件下,HOF 1呈现最高的质子电导率。

表2 不同湿度及不同温度下HOF 1的质子导电率
根据公式,σ = σ0exp(−Ea/kBT) (σ0为指数前因子;kB为玻尔兹曼常数(kB= 1.3806505 (24) × 10−23J·K−1),T为温度),画出lnσ与1/T的关系图。从图9观察到,lnσ与1/T呈线性关系。根据斜率值,计算得到活化能Ea=0.72 eV。据此判断,98%湿度下,HOF 1的质子导电机制主要受运载机制控制。
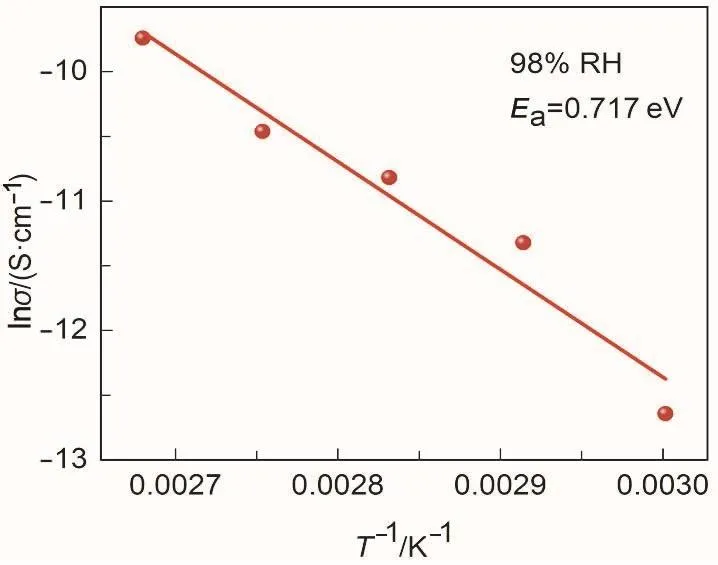
图9 在98% RH下,HOF 1的Arrhenius图
6 实验安排和教学组织建议
本实验可采用模块化教学模式,分为苯并三氮唑基乙酸(HOF 1)的制备(模块I,4学时,本实验的4.1小节)、结构及组成的测定(模块II,4学时,包括本实验的4.2、4.3、4.4小节)、质子导电性能测定及机理分析(模块III,4学时,本实验的4.5小节)三个模块。模块I涉及有机合成,模块II涉及仪器分析,模块III涉及物理化学实验。在实际开展教学的过程中,各学校可以根据实际实验教学的课时数量、教学目标以及仪器设备的具体情况,按照表3灵活安排适宜的实验内容。

表3 实验学时与对应的内容
在本实验的具体实施过程中,每个教学时段参与的学生人数为12-16人。其中苯并三氮唑基乙酸(HOF 1)的制备以两个学生为一组来进行实验。结构及组成的测定时间段,6-8组学生可以交替进行,1/3的同学先进行元素分析测试,另外1/3的同学先进行红外光谱测定,剩下的1/3同学先进行粉末X射线衍射测试,然后依次轮换,这样就可以保证所有学生在4学时之内完成测试。测试完成之后,每组学生按要求称取HOF 1的样品,研磨并压成直径为5 mm的圆片(三个),用银片电极将样品片夹紧,然后分别悬挂于三个相对湿度为75%、85%、98%的测试瓶中进行平衡,为下一时间段质子导电性能测定做好准备。质子导电性能测定间段,可以根据学生人数提供6-8台电化学工作站,每台工作站配备三个电热恒温水浴锅,使得所有同学可同时进行质子导电性能的测试。
7 结语
本实验把晶态材料质子导电的最新研究成果引入到本科生的综合实验教学中,实现了科研与教学的完美对接。通过亲核取代反应一步制备了含有丰富氢键网络的苯并三氮唑基乙酸(HOF 1)。通过对其组成和结构的表征,使学生进一步认识到元素分析、红外光谱以及粉末X射线衍射技术等在现代化学中的应用。进而,通过测试HOF 1在不同温度和湿度下的质子电导率,推算出活化能Ea数值(0.72 eV),并对HOF 1的质子导电机理(运载机理)进行判断与分析。该实验具有安全性高、重现性好、绿色环保、操作简便、成本低廉、便于推广等特点。通过环环相扣的实验操作,使学生了解HOF材料的结构优势,掌握质子导电性能的研究方法,激发科研兴趣,训练学生的科研能力。同时,本实验的开展还有助于高年级本科生在四大基础课实验的基础上独立完成一个基本的科研训练过程,为后续从事科学研究打下良好的基础。
