一种高效溶磷解钾微生物菌剂的筛选及应用研究
2022-09-03张心青田杰伟马娜娜蔡倩倩王红霞部丽群
张心青,田杰伟,马娜娜,蔡倩倩,王红霞,部丽群
(1.黄河三角洲京博化工研究院有限公司,山东 滨州 256500;2.山东京博控股集团有限公司,山东 滨州 256500)
施用化肥是补充土壤养分的重要措施,化肥在促进作物生长发育、提高作物产量中发挥了巨大作用,但肥料利用率低造成的土壤质量退化、养分流失、微生物数量减少等一系列负面影响已成为农业生产面临的主要难题,可持续化生产已然成为未来农业发展的必然趋势。氮、磷、钾作为农作物生长发育所必须的三大营养元素,在植物的生长发育过程中发挥着极其重要的作用。我国土壤中含有丰富的磷钾元素,但绝大多数的磷钾元素都是以难溶性盐的形式存在,其中90%以上不能被植物直接吸收利用。如何提高土壤中磷钾含量,成为限制农作物生长的重要因素。为了提高农作物产量,需要每年施用大量的化学肥料或有机肥料,但施入的肥料利用率却极低,并不能被农作物有效吸收利用,当季利用率低于25%。由于化学肥料的大量施用及施肥结构的不合理,造成了我国的农业生态环境污染和破坏以及土壤理化性能下降。已有大量的研究表明,土壤中存在许多有益微生物,其中部分微生物具有溶磷、解钾效果,能够将植物难吸收的养分转化为植物可吸收利用的形态,进而在降低化肥使用量的同时提高作用的产量。若增加土壤中此类有益微生物的含量,能够有效将土壤中不溶性养分转化为作物可直接吸收利用的养分,降低肥料的使用量和成本,提高产量,同时降低大量肥料使用对生态环境造成的破坏。
1 材料和方法
1.1 材料
1.1.1 试验菌株 试验所用的WB1、Q1、L4 均是从番茄、黄瓜及小麦等大田连作土壤中分离得到的,对照菌株巨大芽孢杆菌11、西安胶质芽孢杆菌、凝结芽孢杆菌均为本实验室保藏。
1.1.2 试验用培养基 ①LB 培养基(1 L):氯化钠10 g、蛋白胨10 g、酵母粉5 g,搅拌至完全溶解后定容至1 000 mL,固体培养基加入1.8%~2%的琼脂粉,121℃灭菌20 min。②PDA 培养基(1 L):取200 g土豆去皮切块,于800~900 mL 蒸馏水中煮30~40 min,冷却后过滤,滤液中加入20 g 葡萄糖,搅拌至完全溶解后定容至1 000 mL,固体培养基加入1.8%~2%的琼脂粉后,分装入三角瓶内并用纱布封口,121 ℃灭菌20 min。③发酵培养基(1 L):葡萄糖10 g,酵母膏3 g,KHPO·3HO 2 g,MgSO0.25 g,豆粕20 g,氯化钠10 g,pH 值7.5,用蒸馏水混匀并定容至1 000 mL,121 ℃灭菌20 min。
1.1.3 主要设备 XSP-BM 系列生物显微镜购自上海彼爱姆光学仪器制造有限公司;SHP-150 智能生化培养箱购自上海博迅实业股份有限公司;SW-CJ-2F 超净工作台购自苏州苏洁净化设备有限公司;恒温振荡器购自上海旻泉仪器有限公司;TG-16WS 台式高速离心机购自长沙湘智离心机仪器有限公司;ARTP 常压室温等离子体诱变系统购自北京思清源生物科技有限公司。
1.2 试验方法
1.2.1 溶磷解钾菌株的筛选(1)菌株的分离纯化。本研究筛菌所用的土壤采集自山东省滨州市番茄根际土、黄瓜根际土、小麦根际土。称取10 g 土壤样品,置于90 mL 无菌水中,放于35 ℃摇床中振荡处理2 h,制成土壤菌悬液。然后对菌悬液进行梯度稀释后涂布在LB 固体培养基上,倒置于生化培养箱中30 ℃培养1~3 d。挑取平板上菌落形态不同的菌株在新的LB 固体培养基上划线分离纯化,将分离纯化的纯菌进行保存。
(2)溶磷解钾菌株的初筛。先将融化后的1.5%素琼脂(已灭菌)倒入已灭菌的平板中,形成一层薄薄的琼脂层,使其恰好覆盖平板底部。待琼脂凝固后,每个平板按照等边三角形的三个角放置3 个牛津杯,每个平板倒入10 mL 初筛培养基,待凝固后用灭菌的镊子将牛津杯取出。每个孔内加入相应初筛菌液30 μL,于30 ℃培养5~7 d。用直尺测量透明圈的直径(D)和菌斑的直径(d),根据公式(1)计算直径比(M)。

式中,M 为直径比;D 为透明圈直径;d 为菌斑直径。
(3)溶磷解钾菌株的复筛。将待测菌株转接入LB 液体培养基内,35 ℃170 r·min过夜培养,测定OD600,用LB 液体培养基调节各菌液的OD600 相同,按照相同的比例添加至对应的复筛液体培养基内,32 ℃170 r·min处理7 d,将发酵培养液置于离心管中,12 000 r·min离心取上清液,用钼锑抗显色法和火焰光度法分别检测可溶性磷和钾离子浓度的变化情况,对比溶磷能力和解钾能力。
1.2.2 溶磷解钾菌株的诱变 采用ARTP 的方法进行诱变,通过设置不同的诱变条件,得到诱变曲线。设置通气量为10 SLM,功率为120 W,诱变时间 依次 为0,10,30,60,70,80,90,100,110,120 s。将诱变后的载片置于1 mL 无菌水中,振荡1 min以上,梯度稀释至10,取65 μL 涂布,过夜培养后,计数,计算致死率,绘制致死率曲线,确定最佳诱变条件。
以最佳诱变条件对无机磷溶解菌菌株和解钾菌菌株进行诱变。将诱变后的载片置于1 mL 无菌水中,振荡1 min 以上,梯度稀释至10,培养过夜后,挑取突变子于4 ℃保存。
采用初筛和复筛的方法对诱变子进行筛选,筛选方法见1.2.1。
1.3 大田试验
将活化后的Q1、L4、WB1 于5 500 r·min4 ℃离心15 min,去掉上清液,其中WB1 离心前添加絮凝剂吸附,用蒸馏水重悬,将菌液和肥料按照表1所示的量进行添加,每棵番茄苗按照10 mL 的量浇灌,每周取样检测土壤中有效磷和速效钾含量的变化情况。

表1 大田番茄试验体系配制方案
2 结果与分析
2.1 溶磷解钾菌株的筛选
2.1.1 菌株的分离纯化 通过各地大田采集土样等方式,共获得了23 种样品,并对这23 种样品进行了分离纯化,经过分离纯化得到了84 种单菌。
2.1.2 溶磷解钾菌株的初筛 通过对84 株单菌进行有机磷溶解菌的初筛,以实验室现有菌种库中溶磷效果最好的菌株巨大芽孢杆菌11 为对照菌株,初步筛选得到溶磷能力较对照菌株提高菌株有13 株,具体见图1,初筛试验中部分菌株溶解圈的效果图见图2。

图1 有机磷溶解菌的初筛结果

图2 有机磷溶解菌的溶解圈
通过对84 株单菌进行无机磷溶解菌的初筛,以实验室现有菌种库中溶磷效果最好的菌株凝结芽孢杆菌为对照菌株,初步筛选得到溶磷能力较对照菌株提高菌株5 株,具体见图3。

图3 溶无机磷菌的初筛结果
通过对84 株单菌进行解钾菌的初筛,以实验室现有菌种库中解钾效果最好的菌株西安胶质芽孢杆菌为对照菌株,筛选得到解钾能力较好的菌株8 株,其中最高的为L4。具体见图4。

图4 解钾菌的初筛结果
2.1.3 溶磷解钾菌株的复筛 对初筛得到的有机磷溶解效果较好的菌株进行了复筛,通过复筛发现,其中溶磷能力高于对照菌株巨大芽孢杆菌11 的有10株(见图5),溶磷能力提高50%以上的有6 株,提高120%以上的有1 株(Q1)。经过16S rDNA 鉴定确定Q1 为解淀粉芽孢杆菌。

图5 有机磷溶解菌的复筛结果
对初筛得到的无机磷溶解效果较好的菌株进行了复筛,其中溶磷能力高于对照菌株的有4 株(图6)。溶磷能力提高5%以上的有2 株。将这4 株复筛效果较好的菌株又进行了同批次对比处理,通过检测发现,仍然是WB1 的溶磷能力最高,因此选定WB1 为诱变出发菌株。经过16S rDNA 鉴定和BioLOG 鉴定确定WB1 为产酸克雷伯氏菌。

图6 无机磷溶解菌的复筛结果
对8 株初筛得到的解钾效果较好的菌株进行了复筛(表2),以西安胶质芽孢杆菌作为对照菌株,培养4 d 后,L4 释放钾离子含量为33.88 μg·mL,pH值为5.59,钾离子含量高于对照组西安胶质芽孢杆菌269.06%,高于空白组35.2%,TU13 菌株在培养6 d 时,钾离子含量达到最大为30.79 μg·mL,pH 值为4.68,选择L4 进行下一步诱变处理。经过16S rDNA 鉴定确定L4 为枯草芽孢杆菌。
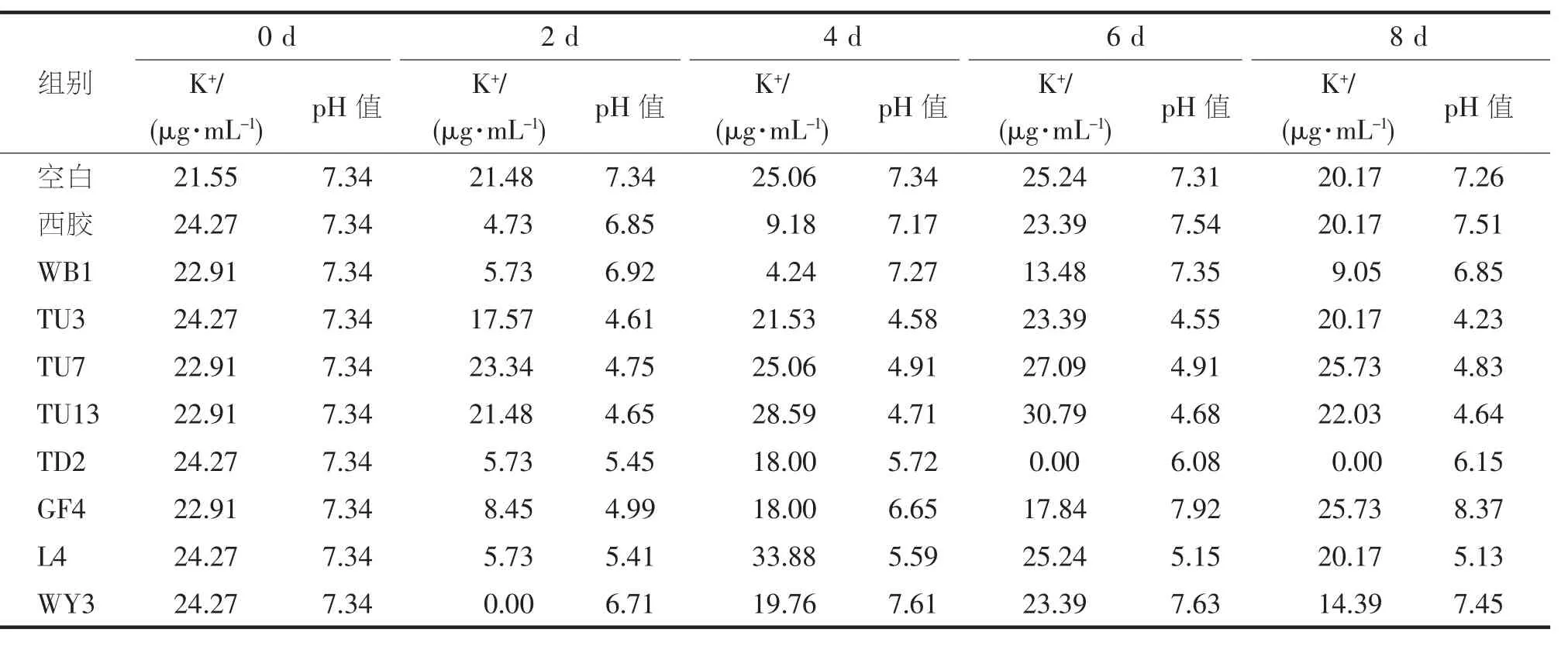
表2 解钾菌复筛检测结果
2.2 溶磷解钾菌株的诱变
由图7 可知,致死率随着ARTP 诱变时间的延长而增长,诱变时间在90 s 内时致死率呈急剧增长趋势,90 s 时致死率为89.91%,故确定最佳诱变条件为80~90 s。

图7 ARTP 诱变试验
根据上述确定的最佳诱变条件,进行了4 批次的无机磷溶解菌的诱变,共计获得诱变子833 个,并完成了对这833 个诱变子的初筛,从溶磷圈的直径比D/d 来看,其中正突变子有364 个,其余为负突变子,直径比D/d 明显较诱变出发菌株增大的有56 株菌(图8)。

图8 正突变子的溶磷圈
选取初筛效果较好的无机磷溶解菌株188 株进行了复筛,从检测结果来看,有110 个正突变子,溶磷能力较诱变出发菌株(野生菌WB1)提高30%以上的有6 株,提高40%以上的有1 株,为4p-462(44.10%),提高60%以上的有1 株,为4p-449(63.23%),确定后期应用4p-449 诱变子(表3)。

表3 溶磷菌部分诱变子复筛结果
进行了2 批次的解钾菌的诱变,共计获得诱变子410 个,并完成了对这410 个诱变子的初筛,从溶磷圈的直径比D/d 来看,其中正突变子有7 个,诱变子编号分别为编号为6、7、13、55、57、64、82。
选取初筛效果较好的菌株7 株进行了复筛,从检测结果来看,编号为64 的菌株培养7 d 后,钾离子含量高于对照原始菌30.94%,pH 值为6.52,确定后期应用编号为64 诱变子(表4)。

表4 解钾菌部分诱变子复筛结果
2.3 溶磷解钾菌的大田试验
空白组、L4+WB1、L4+Q1 3 个组做对比,速效钾和可溶性磷呈先下降后上升的趋势。其中,21 d 后,L4+WB1 组、L4+Q1 组的速效钾和有效磷含量都提高了100%以上,甚至有的提高200%以上,充分说明溶磷解钾菌能够释放土壤中的难溶性磷、钾;随着植物生长,速效钾和有效磷含量略有下降,但基本能够维持在一定的水平,且高于空白组,说明解钾菌L4、溶磷菌WB1、Q1 能够成功定植土壤,并发挥了高效溶磷解钾的作用。
减肥40%+L4+WB1、减肥20%+L4+WB1、全肥试验组在施用微生物菌剂肥料后,速效钾、可溶性磷均大幅升高,其中减肥40%+L4+WB1 和减肥20%+L4+WB1 2 组试验组呈先下降后上升的趋势,全肥组一直呈下降趋势,21 d 后,减肥组的有效磷和速效钾含量高于全肥组50%以上;直到下一次施肥,全肥组有效磷和速效钾含量略有升高,后又呈下降趋势,而减肥40%+L4+WB1 和减肥20%+L4+WB1 2组能够维持一直高于全肥组,说明添加解钾溶磷复合菌剂后,在减肥40%情况下,土壤中溶磷解钾菌持续释放土壤中速效钾、可溶性磷,避免植物生长对速效钾、可溶性磷大量使用后下降的情况出现,使其含量能够高于施用全肥的效果,满足植物生长需求。
对大棚种植番茄株高、茎粗进行检测,通过对平均值的对比,其中,试验组WB1+L4 和试验组Q1+L4,茎粗分别为10.98,10.97 mm,株高分别为189,202.05 mm。试验组减肥40%+WB1+L4 与试验组减肥20%+WB1+L4、全肥(未接种解磷解钾菌剂),茎粗分别为9.96,10.30,10.8 mm,株高分别为188.83,190.75,181.58 mm。通过减肥组与复合菌剂组的对比,复合菌剂组株高、茎粗略高于减肥组、全肥组,说明仅添加复合菌剂的试验组中番茄生长未出现明显影响,能够达到与施用全肥相当的效果。考虑番茄苗种植前,土壤中施用过一次有机肥作为底肥,解钾溶磷复合菌剂定植土壤后,主要起到了持续释放土壤中难溶性钾元素、磷元素的作用,使土壤保持丰富磷钾元素,满足植物生长需求,可以有效减少后期追肥次数及肥料施用量。
3 结论与讨论
本研究开发的高效溶磷解钾微生物菌剂具有高效溶磷解钾功能,经过诱变改造,溶磷解钾功能提高30%以上,且该菌剂在土壤中的定植情况良好,能够提高土壤中速效磷含量3 倍以上,提高速效钾含量30%以上;通过大田试验发现,高效溶磷解钾微生物菌剂能够有效促进植物的生长,植株生物量提高25%以上,茎粗提高5%以上,有效提高植株的抗逆性。大田应用发现,溶磷解钾菌剂的添加能够有效释放土壤中的磷、钾元素,通过减肥组与全肥组对比,复合菌剂组与施肥组对比,发现施用复合菌剂组土壤中有效磷和速效钾含量能够达到施肥组的水平,效果明显,且施用复合菌剂组的番茄茎粗和株高与施肥组相当,甚至高于空白组,这与溶磷解钾菌不仅具有溶磷解钾功能,还具有固氮等其他功能有关。
