丛枝菌根真菌对人工湿地植物生长及水质净化的影响研究
2022-09-02刘宁刘洋续京平宋慧平冯政君程芳琴
刘宁,刘洋,续京平,宋慧平,冯政君 ,程芳琴
1.山西大学资源与环境工程研究所,山西 太原 030006;2.山西省黄河实验室,山西 太原 030006;3.山西大学黄土高原研究所,山西 太原 030006;4.北京北华中清环境工程技术有限公司,北京 100176;5.北京诺曼斯佰环保科技有限公司,北京 102200
人工湿地作为一种近自然状态下的水质净化处理系统,具有处理费用低,生态效益高等特点(叶振坤等,2020)。现已被广泛应用于工业及生活废水的处理,其主要依靠湿地中基质的吸附固定、微生物的降解沉积及植物的吸收提取等途径来实现污水的净化(彭麟等,2012),同时基质、微生物和植物也会产生相互作用,进一步提高去污效果。如何提高人工湿地对氮、磷、COD等的去除率一直是人们关注的问题(黄锦楼等,2013)。
丛枝菌根真菌(arbuscular mycorrhiza fungi,AM真菌),是一类共生真菌(罗鹏程,2016),它广泛分布于自然界中,能够与地球上绝大多数植物形成AM菌根(王立等,2010)。AM真菌可以促进宿主植物根系的发育、增强植物对矿质养分的吸收并改善植物根际的微生物群落结构(Ansari et al.,2013;Ramírez-Viga et al.,2018),从而促进植物的生长、提高植物的抗逆性(Mohammad et al.,2011;Xu et al.,2018)。
越来越多的研究证实AM真菌是湿地植物的主要共生菌之一(鄢金灼等,2008),同时也是湿地生态系统的重要组成部分(Wang et al.,2018),它广泛存在于盐沼、草甸、沼泽地、河流、湖泊、红树林等湿地生境中(Xu et al.,2016)。彭麟等(2012)认为,AM真菌是一种潜在的提高人工湿地污染物去除效率的微生物,主要的机制包括:(1)直接促进湿地植物的生长发育,增加植物对氮、磷等污染物的吸收;(2)促进植物根系发育,从而强化根际共生微生物对污染物的去除;(3)提高植物的抗逆性,提升湿地运行的稳定性。因此,将AM真菌应用于人工湿地可提高湿地运行效率,值得进一步的探索和研究。但是,目前对AM真菌在湿地环境中的研究大多关注它在湿地中种类分布特征,而关于 AM 真菌在实际人工湿地中应用及其效果评价的研究较少。
鉴于此,本文在北京某人工湿地进行了现场实验,构建了AM真菌-湿地植物共生体系,并探讨了 AM 真菌对人工湿地植物生长和水质净化的影响,旨在为中国人工湿地的高效运行提供理论依据和技术支持。
1 材料与方法
1.1 研究地概况
实验所在的人工湿地位于北京市,于 2019年开工建设和使用。该地属暖温带半湿润大陆性季风气候,年平均气温11—12 ℃,无霜期181 d,平均降雨量约600 mm。降水季节分配不均匀,全年降水量的80%集中在6—8月。该人工湿地由潜流段和表流段组成,其中潜流段由139个单元滤池组成,每个单元滤池设计尺寸为20 m×40 m,面积为800 m2,总面积为103200 m2。其基质配比为陶粒:V(碎石)∶V(沸石)∶V(火山岩)=15∶40∶115。该人工湿地采用连续进水、连续出水的运行模式,污水经潜流湿地(多级砂滤池)过滤沉淀后,再由表流湿地净化流回原河流。其设计处理规模为22300 m3·L-1,水力停留时间为 48 h,水力负荷为 0.5 m3·m-2·d-1。湿地系统内水生植物主要包括黄菖蒲(Irispseudacorus)、水葱(Scirpustabernaemontani)等,植被覆盖度较高,可达70%—90%。
1.2 污水状况
污水来源于北京某河流,经中央布水通道均匀进入人工湿地各处理区域,处理后再流回原河流。污水原水质状况属于劣 V类,COD质量浓度为(36.32±1.21) mg·L-1,氨氮质量浓度为 (4.12±0.33)mg·L-1,TP 质量浓度为 (0.49±0.04) mg·L-1。
1.3 供试植物和菌种
实验所用 AM 真菌为专用于湿地挺水植物生长发育的挺水植物生长促进剂(AMF-WL2颗粒剂),购于捷克Symbiom公司。该产品的主要成分为 5种不同种类 AM 真菌(近明球囊霉属Claroideoglomusetunicatum、近明球囊霉属Claroideoglomusclaroideum、根孢囊霉属Rhizophagusirregularis、斗管囊霉属Funneliformis geosporus、斗管囊霉属Funneliformismosseae)的生物活性颗粒(包含有定殖根碎片、孢子和菌丝体碎片等),通过最可能数检验得其最小繁殖体数和典型平均感染繁殖体数分别为200、325 pcs·g-1,其载体为膨胀粘土、斜发沸石等惰性颗粒。根据AMF-WL2的适用性和湿地种植品种,选定水葱、黄菖蒲作为对比实验植物。
1.4 试验设计
试验共设4个处理,即2个植物种类处理(水葱、黄菖蒲)和2个AM真菌处理(NM:不接种;AM:接种AM真菌)。试验在人工湿地进行,于2019年 9月开始移植植物,2020年 4月以 180 g·m-2的AMF-WL2颗粒剂用量一次性全面积播撒。各处理试验区域面积及环境状况一致,具体种植面积及密度见表1,结构示意图见图1。试验期间自然采光,不施肥、打药、修剪、去漂浮和清淤。每月进行采样观察、拍照,于2020年10月30日收获植物。

表1 试验区域植物种植面积及密度Table 1 Plant planting area and density in the test area

图1 试验区域结构示意图Figure 1 Schematic diagram of test area structure
1.5 测定指标与方法
1.5.1 菌根侵染率的测定
菌根侵染率:将采集的植株根系用超纯水洗净后,剪成长约1 cm的根段,置于10% KOH溶液中,于90 ℃的水浴条件下45 min;将根系用超纯水冲洗干净,置于 2% HCl酸化 5 min;随后移至0.05%台盼蓝-乳酸甘油中于90 ℃水浴条件下染色30 min;在显微镜下观察菌根侵染状况;用根段频率法计算菌根侵染率(Phillips et al.,1970)。

式中:
F——菌根侵染率;
RAM——菌根浸染的根段数;
Rtotal——被检查的总根段数。
1.5.2 植物生长指标的测定
收获后,每个处理随机选取5株植物,测定其株高、根长及植物鲜质量。
1.5.3 水体指标的测定
试验期间,定期采集水样测水体指标,主要监测COD、氨氮和TP,其分析方法及来源见表2。

表2 水样监测指标与分析方法Table 2 Water sample monitoring index and analysis method
1.6 统计方法
所有试验数据均用Excel 2019进行平均值及标准误差的计算,用SPSS 23.0进行统计分析,选择方差检验、Duncan检验、LSD多重比较检验各处理平均值之间的差异的显著性(P<0.05)。使用Origin 9.0软件绘图。
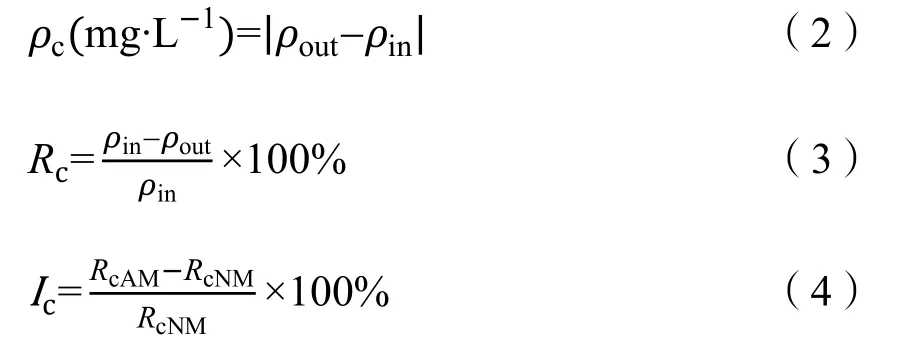
式中:
ρc——污染物浓度变化;
Rc——污染物去除率;
Ic——污染物去除率提高比例;
ρout——污染物出水浓度;
ρin——污染物进水浓度;
RcAM——AM区污染物去除率;
RcNM——NM区污染物去除率。
2 结果与分析
2.1 接种AM真菌对植物菌根侵染状况的影响
由图2和图3可知,未接种处理也会观察到菌根真菌侵染的迹象,而接种处理显著提高了植物根系中的菌根侵染率和菌根侵染强度(P<0.05)。对比两种挺水植物接种 AM 真菌后的菌根侵染率发现,水葱>黄菖蒲。其中,水葱高达37.66%,与不接种AM真菌相比提高了20.62%。

图2 AM真菌对不同植物菌根侵染率的影响Figure 2 Effects of AM fungi on mycorrhizal infection rate of different plants

图3 NM组(A)和AM组(B)的植物根系菌根侵染状况Figure 3 Mycorrhizal infection of plant roots in NM group (A) and AM group (B)
2.2 接种AM真菌对植物生长的影响
由表3和图4可知,AM真菌对植物的生长有很大的影响,接种处理植物的株高、根长、鲜物质量相对于未接种处理的植物均得到了显著增加(P<0.05),接种处理的植物根系也明显发达,根面积和根体积均得到了增加。其中,与未接种处理相比,接种处理的株高提高了17.79%—31.35%,根长提高了 18.79%—29.14%,鲜物质量提高了54.56%—116.43%。

图4 NM组(A)和AM组(B)的黄菖蒲根系生长状况Figure 4 Root growth of Iris pseudacorus in NM group (A) and AM group (B)

表3 AM真菌对不同植物生长的影响Table 3 Effects of AM fungi on the growth of different plants
2.3 接种AM真菌对人工湿地水质净化的影响
试验水质监测从2020年5月运行至2020年10月,即AMF-WL2施加期间。跟踪监测了人工湿地去污效果,监测项目包括COD、氨氮、TP等水质指标。
2.3.1 COD去除效果
从表4和图5可以看出,该人工湿地的COD进水质量浓度约为 36.32 mg·L-1,经人工湿地处理后,COD质量浓度显著下降。且与未接种处理相比,接种处理 COD去除效果更优,质量浓度降低了0.46—1.30 mg·L-1,去除提高了12.32%—24.19%。其中,2020年5、9和10月COD的质量浓度变化达到了显著影响,质量浓度分别降低了0.46、1.30、1.10 mg·L-1,去除提高了21.59%、16.83%、21.59%,表明AM真菌增强了人工湿地对COD的去除能力。

图5 人工湿地进出水COD质量浓度变化及去除率提高比例Figure 5 Change and removal improvement ratio of COD mass concentration in inlet and outlet water of constructed wetland
2.3.2 氨氮净化效果
从表4和图6可以看出,该人工湿地的氨氮进水质量浓度约为4.12 mg·L-1,经人工湿地处理后,氨氮浓度有所下降。且与未接种处理相比,接种处理氨氮去除效果更优,质量浓度降低了 0.03—0.23 mg·L-1,去除提高了 5.45%—45.31%。其中,2020年6月氨氮的质量浓度变化达到了显著影响,质量浓度降低了0.21 mg·L-1,去除提高了21.59%,表明AM真菌增强了人工湿地对氨氮的去除能力。

图6 人工湿地进出水氨氮质量浓度变化及去除率提高比例Figure 6 Change and removal improvement ratio of NH3-N mass concentration in inlet and outlet water of constructed wetland

表4 人工湿地进出水质量浓度及其所属水质标准Table 4 The concentration of inlet and outlet water and its quality standard of constructed wetland
2.3.3 TP净化效果
从表4和图7可以看出,该人工湿地的TP进水质量浓度约为0.49 mg·L-1,经人工湿地处理后,TP浓度有所下降。且与未接种处理相比,接种处理TP去除效果更优,质量浓度降低了 0.01—0.03 mg·L-1,去除提高了 5.30%—57.06%。其中,2020年10月TP的质量浓度变化达到了显著影响,质量浓度降低了0.03 mg·L-1,去除提高了57.06%,表明AM真菌增强了人工湿地对TP的去除能力。

图7 人工湿地进出水TP质量浓度及去除率提高比例Figure 7 Change and removal improvement ratio of TP mass concentration in inlet and outlet water of constructed wetland
由表4可知,经人工湿地处理6个月后,两个区域水体的COD、氨氮、TP质量浓度均达到了地表水Ⅲ类水质标准。
3 讨论
菌根侵染率是判断AM真菌能否与植物形成共生体系的基本指标(李信茹,2021),也是判断AM真菌能否影响植物生长和水质净化的前提条件。只有当AM真菌与植物建立共生体系时,才可以进一步研究AM真菌对植物生长及水质净化的影响。且菌根侵染率越高,说明其在宿主根系上扩展的能力越大(周霞等,2012;郭佳等,2014)。研究发现,2种湿地植物(水葱、黄菖蒲)均能与AM真菌建立良好的共生关系,且水葱明显优于黄菖蒲,这为后续的研究打下了良好的基础。
先前的研究表明,AM真菌对植物的生长有明显的促进作用。莫惠芝等(2019)研究发现,不同AM真菌均能不同程度的提高翠芦莉和蓝花鸢尾的生长量、生物量,且促进效果与AM真菌种类和植物种类有关。这与本实验中AM真菌对两种挺水植物的促生效应因植物种类而异的结果一致。王宁等(2012)研究发现,接种 AM 真菌显著增加了三叶鬼针草的生物量、根长、根面积和根体积等,且他们认为AM真菌是通过影响宿主植物的根系形态来促进其生长的。同样,本实验也发现接种AM真菌后植物根系明显发达,根长、根面积、根体积得到了显著增加。马学淼等(2020)研究发现,接种摩西球囊霉菌(G.m)改善了玉米的氮磷营养水平,从而促进了玉米的生长,达到了增产的效果。赵敏等(2021)研究发现,接种摩西球囊霉菌(G.m)和根内球囊霉菌(G.i)两种AM真菌均能促进油樟幼苗的生长,且G.m促进效应更强,与其菌根侵染状况一致。这与本实验中菌根侵染率较高的植物生长状况较好的研究结果一致。总的来说,AM真菌促进了水葱和黄菖蒲的生长,其促进机制主要为:(1)AM真菌的接种会影响宿主植物的根系形态,增加根长、根面积、根体积;(2)AM真菌会提高植物对氮磷等的获取能力,从而增加植物对养分的吸收。本研究中发现水葱的促生效应明显优于黄菖蒲,这可能是因为水葱与AM真菌的共生状况比黄菖蒲好,从而使得菌根发挥出更大的作用。
AM真菌对人工湿地水质的净化也起到了一定的促进作用(吉云秀等,2005;李世阳,2010;丁怡等,2017)。与未接种组相比,接种AM真菌降低了COD、氨氮、TP的质量浓度,分别降低了0.46—1.30、0.03—0.23、0.01—0.03 mg·L-1;污染物去除分别提高了 12.32%—24.19%、5.45%—45.31%、5.30%—57.06%。特别是在2020年5月、9月和10月COD质量浓度显著下降,2020年6月氨氮质量浓度显著下降,2020年10月TP质量浓度显著下降。Zheng et al.(2015)和高文礼等(2021)指出AM真菌具有庞大的菌丝网络,它可以到达植物根系到不了的区域吸收氮磷等元素。Jiang et al.(2020)和屈明华等(2019)指出AM真菌可以将环境中的有机磷活化,使其分解为无机磷被植物吸收。孙秀秀等(2017)指出AM真菌能提高植物根际土壤中磷酸酶的活性,从而加强对磷的分解。陈明利等(2006)指出氨氮的去除与硝化细菌和反硝化细菌的数量有关,而陈媛(2015)发现AM真菌可以提高硝化细菌和反硝化细菌数量,因此增强了氮的去除。梁威等(2002)指出COD的去除与人工湿地基质中细菌和真菌的数量有极显著相关,而袁丽环等(2010)发现AM真菌能提高植物根际土壤中细菌、真菌和放线菌的数量,因此加强了 COD的去除。总的来说,AM真菌提高了COD、氨氮和TP的去除能力,其去除机制主要为:(1)AM真菌具有庞大的菌丝网络及其可以活化植物根际环境中的有机磷,从而增强了植物对氮磷等元素的吸收,降低了水中氨氮、总磷的质量浓度;(2)AM真菌可以提高植物根际土壤中微生物的数量,增强某些酶(如磷酸酶)的活性,从而提高了人工湿地对氨氮、COD、总磷的去除。
4 结论
综上所述,2种湿地植物(水葱、黄菖蒲)均能与AM真菌建立良好的共生关系。接种AM真菌显著提高了植物的株高、根长和鲜物质量,分别提高了17.79%—31.35%、18.79%—29.14%、54.56%—116.43%。且与未接种区相比,接种AM真菌提高了人工湿地对COD、氨氮、TP的去除,污染物去除分别提高了12.32%—24.19%、5.45%—45.31%、5.30%—57.06%。经人工湿地处理 6个月后,两个区域水体的COD、氨氮、TP质量浓度均达到了地表水Ⅲ类水质标准。总的来说,接种AM真菌促进了植物的生长,且对人工湿地的水质净化起到了积极作用。
