大黄药材HPLC指纹图谱及其真伪鉴别研究
2022-09-02章平平吴少杰唐传球
章平平,甘 莉,吴少杰,唐传球
(汉江师范学院化学与环境工程学院,湖北十堰 442000)
大黄,在国内和国外都是常用的中药材,它是一种蓼科草本植物,品种很多,是一味临床常用药材,化学成分复杂,主要药效成分为蒽醌类衍生物,主要包括大黄酸、大黄素、大黄酚、大黄素甲醚、芦荟大黄素等34种成分。一般将掌叶大黄、药用大黄和唐古特大黄这3个品种称为正品大黄。正品大黄不含土大黄苷,含番泻苷,泻下作用强,而非正品大黄不含番泻苷,只含土大黄苷,无泻下作用或泻下作用很弱;且有资料显示土大黄不含或少含大黄酸。
虽然蒽醌类成分并不能作为酸模属土大黄的专属性成分,但2020年版《中国药典》规定大黄含5种游离蒽醌的总量不得少于0.2%,而其泻下的主要活性成分番泻苷的含量未作要求,此外,虽然大黄中多成分的含量测定方法均有报道,有薄层色谱法、高效液相色谱-紫外检测法、高效液相色谱-质谱法、高效毛细管电泳法。目前,在大黄中各种蒽醌类物质的定量分析中,常采用配备紫外检测器的高效液相色谱仪。相比于比色法、化学光淬灭法和高效毛细管电泳色谱法,高效液相色谱法(HPLC)分离效果好、灵敏度高、重复性好、精确度高,而且设备的价格也比较低廉,在中药的复杂成分分析中广泛的应用。笔者参照中国药典及相关品种质量标准以及相关文献,以10份来源不同的大黄饮片为研究对象,采用反相高效液相色谱法(RP-HPLC)对不同来源的大黄药材进行研究,建立大黄药材的指纹图谱,为大黄的质量控制提供有效方法。
1 材料与方法
大黄药材。10个样品采购于不同的药店或网上的店铺,采购品种及地点见表1。
主要仪器。显微镜Phemix MC-D500U(C)/TP;ThermoU-3000型高效液相色谱仪(美国,SR-3000 Slvent Rack真空在线脱气机,LPG-3400SDN四元梯度泵,WSP-3000 SLANALYTICAL自动进样仪,Tcc-3000SD柱温箱,VWD-3100二极管阵列检测器)。
主要试剂。芦荟大黄素、大黄素、大黄酸、大黄酚、大黄素甲醚、土大黄苷、大黄对照药材均购自中国食品药品检定研究院;甲醇为色谱纯,购自默克公司。
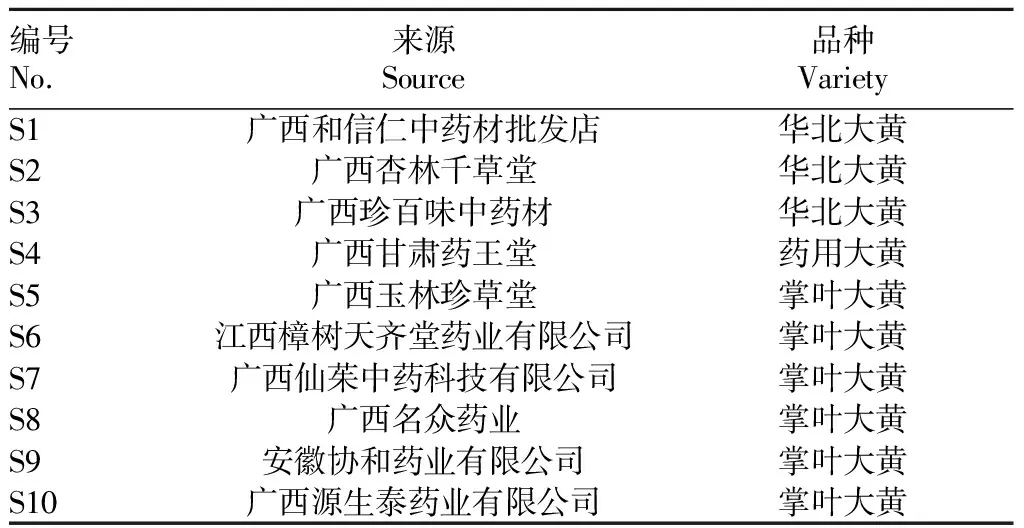
表1 大黄饮片来源Table 1 Sources of rhubarb drink tablets
性状鉴别。通过简单的试验器材进行判别,主要对可见的形状、大小、表面特征、断层面、气味、口感等判别来对药材进行初步鉴别,达到区分中药材的质量和真伪问题。
显微鉴别。以S10为检验样品为例,取饮片粉碎并过4号筛,挑取少量放置在载玻片上,滴加甘油醋酸试液,使得粉末均匀散开,并在酒精灯下微热1 s左右,缓慢盖上盖玻片,放在显微镜下进行观察,观察大黄药材导管、淀粉粒、草酸钙簇晶等内部物质。取少量上述S10粉末,置于蒸发皿上,用滤纸覆盖,采用酒精灯加热,温度不要过高,火焰距离蒸发皿1 cm左右,避免温度过高碳化,加热1 min左右,可以看到有物质附在滤纸上,并进行显微观察。
薄层色谱检查。
对照品溶液配制。精密称取土大黄苷0.11 mg于10 mL容量瓶,甲醇定容,超声5 min后,即得。
供试品溶液配制。精密称取0.1 g左右大黄细粉(过4号筛),置于锥形瓶中,加甲醇10 mL,超声提取20 min,滤过,精密移取1 mL滤液,用甲醇定容到10 mL容量瓶,摇匀即得。
对照药材溶液配制。精密称取0.1 g左右大黄细粉,置于锥形瓶中,加甲醇10 mL,超声提取20 min,滤过,精密移取1 mL滤液,用甲醇定容到10 mL容量瓶,摇匀即得,临用新制。
薄层层析。吸取S1~S10供试品溶液、对照药材溶液、土大黄苷对照品溶液各5 L,分别点于同一聚酰胺薄层膜上,以甲苯-甲酸乙酯-丙酮-甲醇-甲酸(30∶5∶5∶20∶0.1)为展开剂,展开,取出,晾干,置紫外光灯(365 nm)下检视。
大黄含量测定。
对照品溶液的制备。在电子分析天平中分别称取芦荟大黄素对照品1.65 mg、大黄酚对照品1.57 mg、大黄酸对照品0.79 mg、大黄素对照品0.86 mg、大黄素甲醚对照品0.68 mg于5个10 mL容量瓶中,甲醇溶解并用甲醇定容,超声5 min后,得到各对照品溶液。再在5 mL容量瓶内分别加入上述各溶液1~5 mL,配制成对照品混合溶液,其中芦荟大黄素16.219 g/mL、大黄酚15.605 g/mL、大黄酸15.688 g/mL、大黄素16.512 g/mL和大黄素甲醚8.993 g/mL,保存在4 ℃备用。
供试品溶液的制备。取本品粉末(过四号筛)0.100 0 g,置于50 mL离心管中,然后精确地加入25 mL甲醇,记录此时的称定重量,用记号笔在离心管液面处画标记线,加热回流1.5 h(在整个过程中,确定该液体是轻微沸腾的),然后将其移出,待温度冷却到在室温下,称其重量。按标志线加适量甲醇,摇晃使其均匀,然后过滤,取出滤液,用0.22 μm的微孔滤膜过滤除去杂质,装入玻璃瓶中,待用。
色谱条件。色谱柱为JADE-PAK KM-C(250 mm×4.6 mm,5 μm);柱温30 ℃,进样量10 μL;流速1.0 mL/min。二极管阵列检测器(VWD),检测波长280 nm,按照梯度进行洗脱,流动相为甲醇(A)-0.2%磷酸溶液(B),流动相比例(0~10 min,5~30% A;10~40 min,30%~60%A;40~60 min,60%A;60~70 min,60%~100% A;70~75 min,100% A;75~76 min,100%~5% A;76~87 min,5% A)。
线性关系考察。按“...”色谱分析条件,精密吸取“...”对照品溶液2、4、6、8、10、12 μL注入高效液相色谱仪,记录色谱图,以进样浓度(,μg/mL)为横坐标、峰面积()为纵坐标绘制标准曲线,计算线性回归方程。
精密度试验。精密吸取S1号土大黄供试品溶液10 μL,按“...”色谱条件连续重复进样6次,依法测定芦荟大黄素、大黄素、大黄酸、大黄酚、大黄素甲醚的峰面积,并计算其RSD。
稳定性试验。精密吸取S1号土大黄供试品溶液10 μL,分别于室温下放置0、2、4、6、8、12 h时按“...”色谱条件进样测定,测得芦荟大黄素、大黄素、大黄酸、大黄酚、大黄素甲醚的峰面积,并计算其RSD值。
重复性试验。按“...”方法制备供试品溶液6份(样品批号为S1),按“...”色谱条件进样,进样量为10 μL,测定峰面积,计算平均含量和RSD。
含量测定。该试验对不同批次大黄中芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚5个游离型蒽醌类成分含量进行测定。
2 结果与分析
性状鉴定结果如图1所示,通过对10份大黄的鉴别发现,大黄在表面颜色、有无星点及气味强弱等方面均具有一定差异。掌叶大黄和药用大黄表面呈现黄棕色至红棕色,断面呈淡红棕色或黄棕色,根茎髓部有星点、具清香气味;土大黄表面颜色较深,多为黄灰色、棕灰色或棕褐色,断面无星点,香气微弱。
显微鉴别是当前对中药材最经济有效的鉴别方法之一,采用简单的显微仪器设备,对药材的外观及内部的细胞形态特征等结构进行判别,此检验过程快速高效,结果准确性高于性状鉴别,能有效地减少仪器设备的使用与成本。
采用显微鉴别可以有效地看到大黄细胞的内部结构且具有特征性的物质。图2显示的是以S10样品为例的细胞结构,可以明显地看到大黄的导管、淀粉粒、草酸钙簇晶以及羽状的蒸发晶体,其草酸钙簇晶少见,棱角短钝,网纹导管、螺纹导管非木化,糊粉粒甚多,与《中国药典》鉴别一栏检测要求符合。
按照上述方法,依次镜检S1~S9供试品,相比较S10,在导管、淀粉粒、草酸钙簇晶、羽状的蒸发晶体4个特征上无明显差异。

图1 10个批次大黄样品外表面及其断面Fig.1 External surface and cross section of 10 batches of rhubarb samples
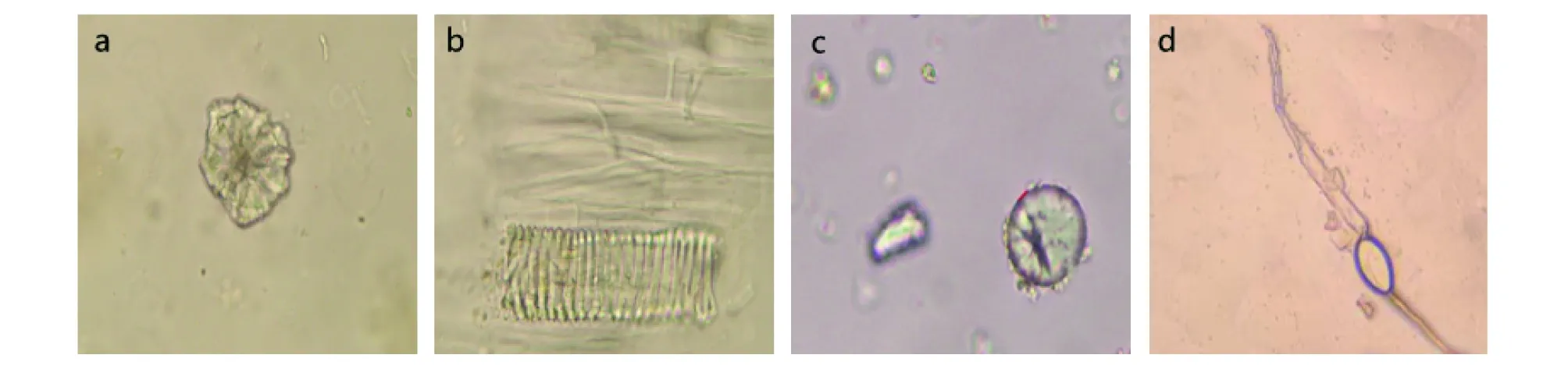
注:a.草酸钙簇晶;b.螺纹导管;c.淀粉粒;d.升华结晶 Note:a.Calcium oxalate clusters;b.Threaded conduits;c.Starch grains;d.Sublimation crystals图2 掌叶大黄S10样品的显微鉴别Fig.2 Microscopic identification of S10 sample of Rheum palmatum
从图3可以看出,土大黄苷有非常清晰的蓝紫色荧光,药用大黄S4和掌叶大黄S5~S10供试品在相应位置无斑点和吸收峰,表明这7个样品未含有土大黄苷,符合大黄鉴别的要求,为正品大黄。而土大黄S1S3供试品在相应位置有明显的斑点和吸收峰,为伪品大黄。该方法可操作性强,能够达到快速检识的目的。

图3 S1~S10样品的聚酰胺薄层色谱检查Fig.3 Polyamide thin layer chromatography detection of S1-S10 samples
线性关系考察。按“...”方法操作,以进样浓度(,μg/mL)为横坐标、峰面积()为纵坐标绘制标准曲线,结果见表2。

表2 5种化合物的线性关系Table 2 Linear relationship of five compounds
精密度试验。按“...”方法操作,结果发现,芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的峰面积RSD分别为0.2%、0.4%、0.5%、0.2%、0.3%,说明该仪器的精密度良好。
稳定性试验。按“...”方法操作,结果发现,芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的峰面积RSD分别为0.2%、0.3%、0.5%、0.2%、0.5%,表明供试品溶液在室温下放置12 h内稳定性良好。
重复性试验。按“...”方法操作,结果发现,芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的峰面积RSD分别为3.8%、2.6%、3.7%、3.7%、3.7%,说明该试验的重复性良好。
以上结果表明各色谱峰的相对保留时间和峰面积基本一致,相似度均大于0.95,符合指纹图谱的要求。
含量测定。2020版《中国药典》以5种蒽醌类成分作为含量测定指标成分,规定大黄素、大黄酚、大黄素甲醚、大黄酸和芦荟大黄素的总量不得低于0.2%。该研究对5种游离蒽醌类含量进行了测定,结果见表3。从表3可以看出,10个大黄样品游离蒽醌的总量均符合2020版《中国药典》限量要求,伪品华北大黄S1~S3这3个批次样品中游离蒽醌总量为1.49%~2.02%,药用大黄S4批次样品中游离蒽醌总量为1.21%,掌叶大黄S5~S10这6个批次样品中游离蒽醌总量为1.21%~2.63%。各批次大黄中,含量比较高的成分是大黄素甲醚和大黄素,含量较少的是大黄酚和芦荟大黄素,但大黄酸10个样品各有不同。3个土大黄药材(S1~S3)中大黄酸含量极低,不及掌叶大黄(S5~S10)与药用大黄(S4)的含量的1/10;药用大黄中大黄酸含量较高,而6个掌叶大黄药材中大黄酸含量视产地有较大的差异。
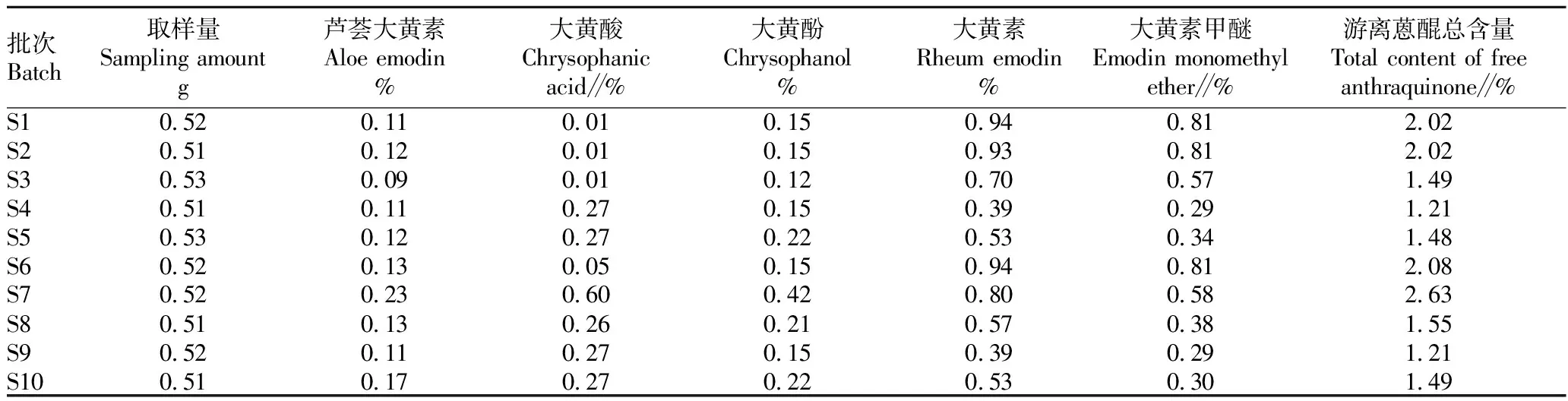
表3 不同批次大黄中5种蒽醌类化合物的含量Table 3 HPLC content determination statistics for 5 components of rhubarb
从图4可以看出,在相同的检测方法下,S1~S3土大黄供试品,相对于药用大黄S4和掌叶大黄S5~S10,在50 min前有明显的区别,含有大量的活性物质。而药用大黄和掌叶大黄的指纹图谱相似性高,50~75 min 的色谱峰峰形及相对比例较稳定,且有5个共有色谱峰,分别为芦荟大黄素、大黄素、大黄酸、大黄酚、大黄素甲醚,体现了正品大黄的共同特征。HPLC法简便、时间短、重现性好,专属性、耐用性强,得到的图谱质量高,可为大黄鉴别标准提供科学依据。
3 结论与讨论

注:1.芦荟大黄素;2.大黄酸;3.大黄素;4.大黄酚;5.大黄素甲醚 Note:1.Aloe emodin;2.Chrysophanic acid;3.Rheum emodin;4.Chrysophanol;5.Emodin monomethyl ether图4 10批次大黄HPLC指纹测定色谱图Fig.4 HPLC fingerprint chromatogram of 10 batches of rhubarb samples
大黄为常用的普通中药,掺杂及市场上的大黄种类繁多。该研究从不同产地收集、测定了10份来自不同药厂或中药店铺饮片,分别为常见的掌叶大黄、药用大黄和土大黄,通过RP-HPLC含量检测及指纹图谱建立,反映了大黄药材的内含物质间存在差异。《中国药典》收录的掌叶大黄与药用大黄的相似性高,而与土大黄的相似性不佳,网上销售的大黄普遍存在使用不符合国家《中国药典》规范的中药进行销售,应该加强对网上的药材管理,有利于中药市场的把控与发展。同时对控制土大黄药材的质量、保证临床用药、建立其质量标准提供了一定依据。
