移动床煤化学链燃烧耦合制氢系统的热力学特性研究
2022-09-01王旭东金保昇董月红安风霞
王旭东,金保昇,董月红,安风霞
(1. 东南大学能源与环境学院,江苏 南京 210096;2.南京工业大学机械与动力工程学院,江苏 南京 211816; 3. 国家能源集团科学技术研究院有限公司,江苏 南京 210031)
1 引言
作为能源密集型工业,我国电力生产中,燃煤电站仍占据着主要市场份额[1]。在双碳目标下,发展低碳燃烧及碳捕集技术是燃煤电站的必由之路。煤化学链燃烧(Chemical Looping Combustion,CLC)作为一种在燃烧过程中近零能耗实现CO2高效分离的燃烧技术,近年来得到了广泛关注[2-5]。我国富煤贫油少气的资源现状决定了煤炭在能源消耗中的主导地位[6-7]。将煤化学链燃烧技术用于电力生产,既可实现煤的清洁利用,降低碳捕集成本,又为我国能源安全及碳中和目标的实现提供可靠保障。
煤化学链燃烧利用载氧体在氧化和还原气氛下循环储氧-释氧的特性,将传统煤燃烧分离在两个相对独立的反应器中进行,即燃料反应器(Fuel Reactor, FR)和空气反应器。在燃料反应器中,燃料在气化介质作用下发生气化反应,与此同时,气化产物与载氧体发生氧化还原反应,从而实现燃料的无焰燃烧;被还原的载氧体循环至空气反应器中,与空气中的氧气发生反应,实现载氧体的氧化再生[8]。将化学链燃烧燃料反应器出口烟气冷凝,即可得到高浓度的CO2。常见的载氧体有CaSO4、NiO、CuO、Mn2O3、Co3O4、Fe2O3及多元金属氧化物等[5, 8-13]。由于铁基载氧体兼具储量丰富、无污染、廉价及反应性适中等优势,被认为是一种适宜工业化应用的载氧体。
氢能是一种高能量密度的清洁能源,燃烧产物为水,不会产生任何污染物。近年来,制氢成为新能源发展的一个重要方向。然而,制氢成本通常较高,这极大限制了氢能的发展[14]。借鉴化学链燃烧原理所提出的化学链制氢是一种无需额外氢气净化的制氢过程[15]。在化学链制氢过程,燃料反应器中的合成气与高价金属氧化物反应,生成CO2和H2O,在制氢反应器中还原态氧化物与H2O反应生成H2。Gupta等对多种金属氧化物的化学热力学分析表明,Fe2O3具有较高的制氢效率[16]。俄亥俄州立大学Hsieh等人设计了热功率为250kW的三床反应器系统,其中燃料反应器和制氢反应器均为逆流移动床[17]。分别采用高压合成气和Fe2O3作为燃料和载氧体,Hsieh等人实现了该化学链制氢系统的连续自热运行。Xue等设计了一种采用多级流化床的化学链制氢系统,在实现甲烷完全转化的同时,Fe2O3可以被还原为FeO[18]。尽管也有较多学者在实验室小型反应器中研究了不同载氧体的化学链制氢性能,但是,在铁基载氧体的还原过程均采用了CO和(或)CH4等可燃气[19-23]。
鉴于我国能源现状,开展以煤为燃料的化学链燃烧耦合制氢循环的研究具有重要意义。采用煤作为燃料,可实现煤清洁燃烧及制氢的双重收益。采用煤作为燃料的化学链燃烧过程较为复杂,燃料反应器内有热解、气化、载氧体还原等多个反应,这将必然导致气体燃料化学链制氢循环运行经验及规律无法适用。目前,仅有极少文献探究了以煤为燃料的化学链制氢可行性[24,25]。鉴于此,本文拟探究以煤为燃料的化学链燃烧耦合制氢循环系统的性能,采用热力学分析方法,探究了采用移动床作为反应器时该循环中反应器运行参数对燃烧和制氢性能的影响。结果表明,以煤为燃料的化学链燃烧耦合制氢循环具有良好的反应特性,并具有较高的产氢能力。
2 研究方法
2.1 研究对象
本文拟采用煤作为燃料开展煤化学链燃烧耦合制氢循环的研究,该循环基本原理如图1所示。采用煤作为燃料,可使该循环具有如下优势:

图1 煤化学链燃烧耦合制氢循环原理Fig.1 Principle diagram of coal-fueled chemical looping combustion coupling with hydrogen generation
(1)实现煤炭资源的低碳燃烧,获得高浓度CO2以便捕集,为煤电产业技术革新提供新的发展方向;
(2)低能耗制取氢气,在煤炭清洁利用的同时获得清洁能源。
(3)兼具化学链燃烧的低氮、高效燃烧等特点。与现有化学链制氢技术相比,该循环中采用煤作为燃料,可实现煤清洁燃烧及制氢的双重收益。
2.2 流程模拟模型构建
基于图1所构建的煤化学链燃烧耦合制氢循环,本文采用热力学方法对该循环的特性进行模拟。基于反应过程所建立的流程模拟对象如图2所示。燃料煤进入燃料反应器后首先发生快速热解反应,挥发分析出,固相产物为煤焦。产物与气化介质发生气化反应,反应产物为富含H2、CO、CH4等的可燃气。
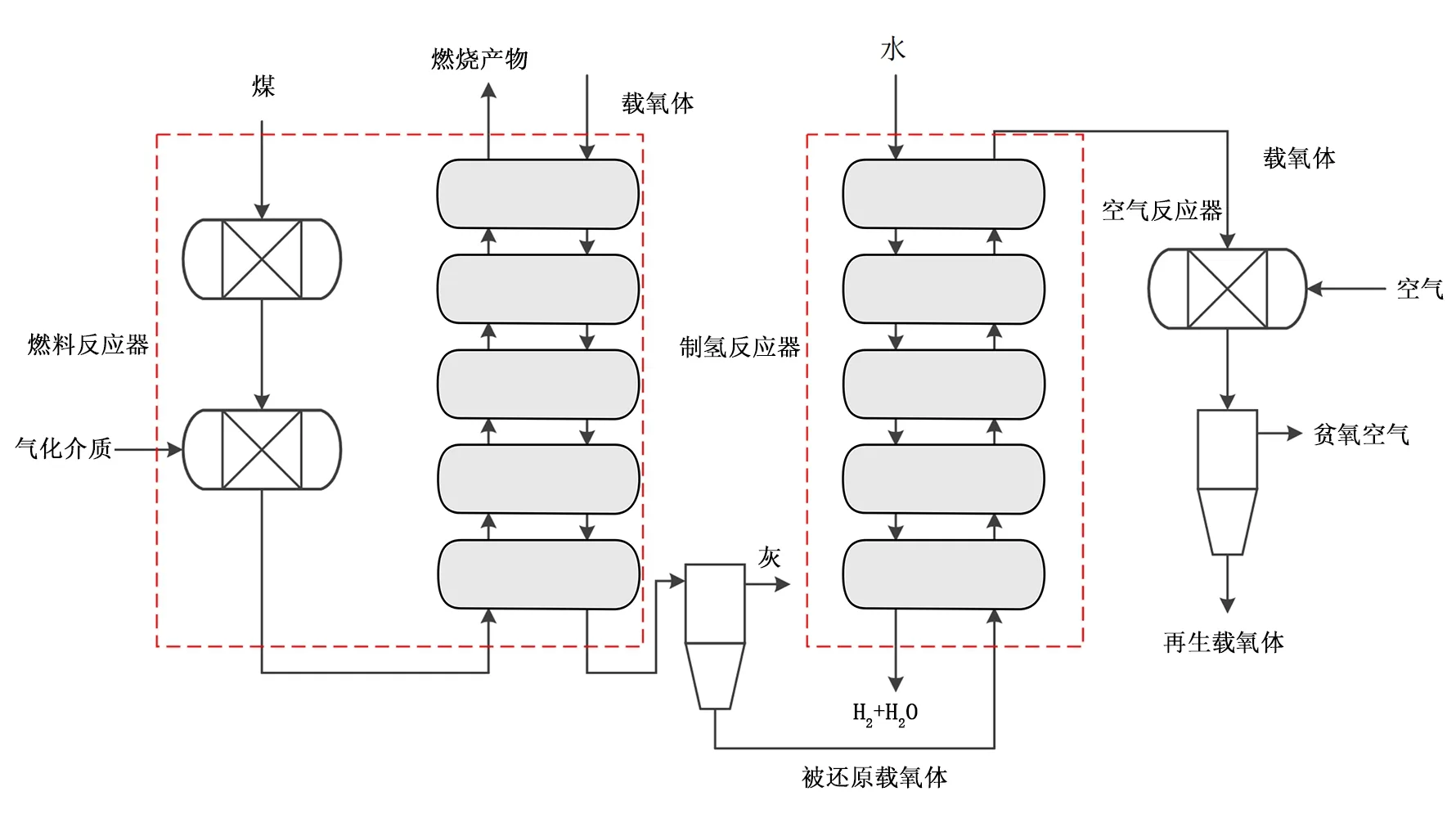
图2 煤化学链燃烧耦合制氢循环模拟流程Fig.2 Simulation flowsheet of coal-fueled chemical looping combustion coupling with hydrogen generation
在模拟中,气化介质采用CO2和水蒸气的混合气。在气化反应器内,气化介质与煤焦发生气化反应,反应如下式所列:
C+CO2→2CO
(1)
C+H2O→CO+H2
(2)
与此同时,水汽变换反应、甲烷重整反应以及其它反应同时发生,相关反应有:
CO+H2O↔CO2+H2
(3)
CO+3H2↔CH4+H2O
(4)
CO2+4H2↔CH4+2H2O
(5)
CH4↔2H2+C
(6)
CH4+CO2↔2CO+2H2
(7)
CH4+H2O↔2CO+3H2
(8)
然后,气相产物与载氧体在逆流移动床内发生反应,此过程中,载氧体被还原至低价态。载氧体还原过程中的物相变化如式(9)所示:
Fe2O3→Fe3O4→FeO→Fe
(9)
被还原的载氧体与灰分分离后,进入制氢反应器与水蒸气逆流反应,生成H2,载氧体被初步氧化后进入空气反应器与空气反应,实现载氧体的再生。
在所构建的反应流程模拟模型中,热解反应器中的反应由各组分的产率决定,产率根据煤的工业分析和元素分析获得。其它反应器中的反应均是基于标准吉布斯自由能计算反应器内的化学平衡与相平衡,从而确定反应产物。为了能够延长气化产物与载氧体的接触时间,并为燃料燃烧提供充足的氧环境,本文所采用的燃料反应器为逆流移动床反应器。同理,制氢反应器亦采用逆流移动床反应器。流程模拟过程,为了能够较为准确地描述逆流反应器内的反应结果,将5组以吉布斯自由能最小为原则的反应过程串联以接近实际逆流反应器内的准稳态过程。
2.3 参数设置
本文采用神华烟煤作为燃料,其工业分析和元素分析如表1所示。

表1 神华烟煤的工业分析和元素分析Tab.1 Proximate and ultimate analyses of shenhua bituminous coal
在流程模拟中,假定燃料煤的流率为1500kg/h,气化介质为水蒸气和CO2的混合物,总流量为45kmol/h,其中H2O与CO2的摩尔比为1∶1。采用的铁基载氧体中,活性组分为铁的氧化物,模拟过程进入燃料反应器的氧化态载氧体中Fe2O3的循环通量与煤中碳的摩尔比设定为2∶1,进入制氢反应器的水蒸气流量为100kmol/h。空气反应器中的过量空气系数为1.2。各反应器均在常压下运行,基准工况下,燃料反应器、制氢反应器和空气反应器的运行温度分别为850℃、550℃和950℃。
3 结果与讨论
3.1 载氧体循环通量的影响
载氧体的循环通量决定了燃料反应器内晶格氧的量,从而对燃料的燃烧过程产生重要影响。当Fe2O3/C比在1.0~3.0之间变化时,其它运行参数保持不变,研究了载氧体循环通量的对燃料反应器及制氢反应器产物的影响。Fe2O3/C比变化对燃料反应器出口产物的影响结果如图3和图4所示。

图3 Fe2O3/C比对FR烟气组分的影响Fig.3 Effect of Fe2O3/C ratio on gas compositions at FR outlet
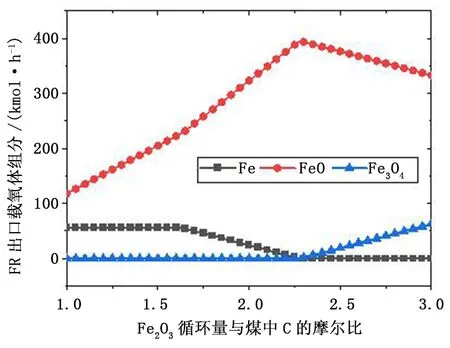
图4 Fe2O3/C比对FR出口载氧体组分的影响Fig.4 Effect of Fe2O3/C ratio on oxygen carrier compositions at FR outlet
图3展示了燃料反应器出口烟气组分随载氧体循环通量变化的情况。当Fe2O3/C比为1时,燃料反应器内载氧体提供的晶格氧无法满足燃料完全燃烧所需的氧,反应器出口烟气中的CH4含量为0。反应器内的CH4除与水蒸气、CO2等发生甲烷重整反应外,还与铁基载氧体发生氧化还原反应,实现CH4的完全转化。CH4与Fe2O3的反应产物为水和CO2,通常情况下,较高的水蒸气和CO2浓度有利于甲烷的重整反应。此时,反应器出口CO2、CO、H2和H2O的流量分别为73.88kmol/h、35.50kmol/h、19.24kmol/h和43.28kmol/h。随着载氧体循环通量的增加,Fe2O3/C比增大,燃料反应器内的可燃气体CO和H2与铁基载氧体发生氧化还原反应,有利于燃烧反应的充分进行,反应器出口的CO和H2均出现下降趋势,与此同时,烟气中H2O和CO2含量增加。当Fe2O3/C比增大至1.65时,反应器出口烟气中各气体组分不再随载氧体循环通量的变化而变化。此时,出口烟气中CO和H2的流量分别为0.003kmol/h和0.002kmol/h,尽管载氧体中晶格氧的含量此时处于过量状态,然而,受反应器运行工况下的热力学限制,CO和H2将无法再与载氧体发生反应,从而导致了可燃气的非完全转化。
从图4所示的载氧体中Fe的相态可以看出,在Fe2O3/C比为1时,载氧体中的Fe2O3已被还原至Fe和FeO态,其流量分别为55.65kmol/h和118.13kmol/h,无Fe3O4。这表明反应器内晶格氧量过低,燃料转化过程将载氧体还原至低价态。载氧体循环通量增大时,反应器内晶格氧量提升,促进了燃料的转化,低价态的FeO含量也随之增大。这表明较多的载氧体被还原至FeO态,而Fe相组分流量未发生变化。当Fe2O3/C比达1.65时,Fe相流量开始下降,表明此时反应器内的载氧体所提供的晶格氧量较多,仅需将较少的载氧体还原至Fe即可实现燃料的充分转化。尽管在Fe2O3/C比大于1.65时,反应器出口的烟气组分不再变化,但是载氧体中铁的相态随着Fe2O3/C比的变化发生转变。Fe相逐渐减少,FeO增多。当Fe2O3/C比达到2.25时,燃料反应器出口载氧体中无Fe相,Fe3O4相开始出现。FeO和Fe3O4均为铁基载氧体的还原态,尽管在常规化学链燃烧中,Fe3O4被认为是最佳的还原态。但是,由于Fe2O3还原至Fe3O4时所释放的晶格氧仅占3.33%,燃料燃烧需要较高的载氧体循环通量,这会增加系统的能耗。同时,由于Fe3O4无法与水蒸气反应生成H2,因此,在煤化学链燃烧耦合制氢循环中,铁基载氧体中的铁需被还原至更低的价态,即Fe或FeO。随着Fe2O3/C比增加,载氧体中FeO相减少,Fe3O4增加。当Fe2O3/C比为3时,燃料反应器出口载氧体中FeO和Fe3O4的组分流量分别为333.09kmol/h和62.74kmol/h。可以看出,FeO的存在是H2和CO不能完全转化的限制因素。
图5给出了Fe2O3/C比对制氢反应器出口产物的影响规律。当Fe2O3/C比小于1.65时,进入制氢反应器的载氧体仅含Fe和FeO相,出口产物中载氧体包含FeO和Fe3O4相,无Fe相物质。随着Fe2O3/C比从1增至1.65,Fe3O4量为21.87kmo/h保持不变,FeO从108.16kmol/h增加至211.11kmol/h。在此范围内,制氢反应器出口H2流量保持77.52kmol/h不变。这主要是由于制氢反应器入口载氧体中Fe相的量未发生变化,尽管FeO亦可与水蒸气发生反应,但是在Fe与水蒸气反应更易进行。从出口产物结果可以看出,由于水蒸气过量,在将所有Fe氧化至FeO后,会进一步将FeO氧化至Fe3O4,使得系统达到热力学平衡。在Fe2O3/C比从1.65增至2.25过程中,由于入口载氧体中Fe相物质的量减少,制氢反应器的产氢量也从77.52kmol/h显著下降至29.66kmol/h。随着Fe2O3/C比的进一步增大,进入制氢反应器的载氧体含FeO和Fe3O4相,Fe3O4不能与水蒸气发生产氢反应,仅有FeO可与水蒸气反应产生H2,且受热力学限制,该过程的水蒸气无法全部与FeO反应。因此,制氢反应器出口的氢气量保持在较低水平,不再随Fe2O3/C比增大而变化。
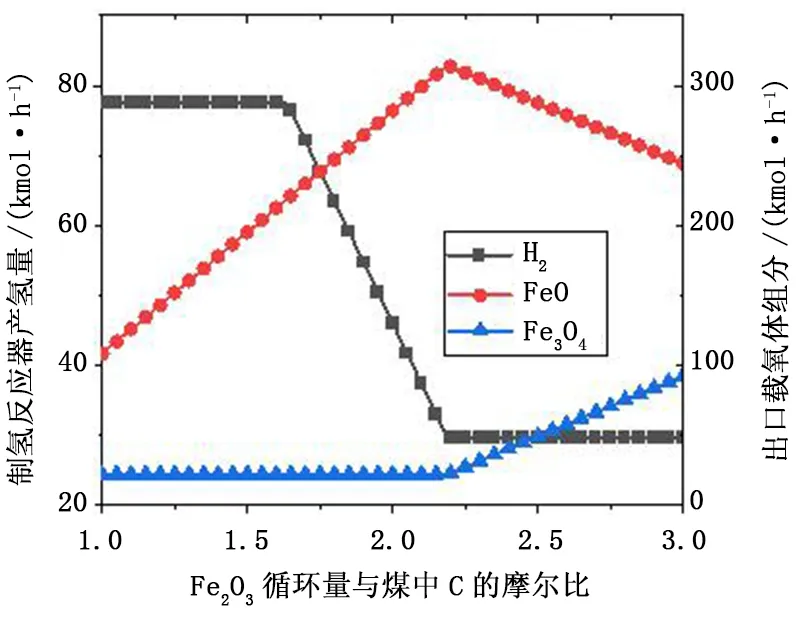
图5 Fe2O3/C比对制氢反应器产物的影响Fig.5 Effect of Fe2O3/C ratio on the products of hydrogen generation reactor
从上述分析可以看出,在煤化学链燃烧耦合制氢循环中,铁基载氧体在与燃料反应过程的还原程度直接决定了该循环的产氢量。为了能够实现较多的H2产量,燃烧过程铁基载氧体需被还原至较低的Fe和FeO价态。在燃料反应器内,需要在较大程度上实现铁基载氧体的还原,常规的流化床反应器中,燃料与载氧体流动方向一致,还原性强区域内载氧体处于较高价态,还原性较弱区域内载氧体的价态也相对较低,难以保证载氧体的深度还原。在逆流移动床反应器内,低价态载氧体处于强还原气氛内,满足载氧体深度还原的要求。这也是本文选择逆流移动床作为燃料反应器的原因。受热力学限制,当进入制氢反应器中包含FeO和Fe3O4时,仅大量增加载氧体循环通量并不能增加产氢量。
3.2 制氢反应器运行参数的影响
前文分析表明,当载氧体循环通量处于一定范围时,仅靠增大载氧体的循环通量对制氢反应器出口产氢量不会产生影响。为此,本部分在Fe2O3/C比为2时,改变制氢反应器的运行温度和入口蒸汽流量,研究其对制氢能力的影响。此时,进入制氢反应器的载氧体中Fe和FeO流量分别为24.14kmol/h和323.40kmol/h。
图6为制氢反应器运行温度从450℃升至650℃时,反应器出口氢气流量和载氧体中铁的相态变化结果。

图6 制氢反应器温度对出口产物的影响Fig.6 Effect of temperature on the products of hydrogen generation reactor
随着反应器运行温度的升高,产氢量从65.30kmol/h单调下降至37.52kmol/h。在温度较低时,温度增加对产氢量降低的影响更为显著。受热力学限制,温度升高会抑制产氢反应。从图中结果可以看出,进入制氢反应器的所有Fe相均已被转化至FeO态。在该条件下,FeO被水蒸气继续氧化至Fe3O4,温度的升高将抑制FeO与水蒸气的反应,从而使得出口载氧体中FeO相增多,产氢量下降。需要指明的是,这仅是热力学模拟结果,实际反应过程还受动力学限制。因此,在实际应用时要充分考虑热力学和动力学对反应器系统的综合影响,从而决定反应器的运行温度。
图7为水蒸气流量变化对制氢反应器出口产物的影响结果。在水蒸气流量从10kmol/h增至26kmol/h过程中,制氢反应器内发生Fe与水蒸气生成氢气和FeO的反应,在此阶段,Fe随着蒸气流量增大线性下降,产氢量呈线性增加。受热力学限制,水蒸气无法被全部转化成氢气,该阶段水蒸气制氢的产率为91.66%。当水蒸气流量从26kmol/h增至34kmol/h时,此阶段主要发生FeO与水蒸气生成Fe3O4的反应,反应器出口载氧体中FeO相流量开始降低,并伴有Fe3O4相的生成,产氢量仍呈线性增加。在水蒸气流量大于35kmol/h时,尽管产氢量仍随蒸气流量增加而增大,但是,单位蒸汽的氢气产率有所下降。因此,在实际应用时,应充分考虑蒸汽的成本和不同阶段产氢的收益,选择合适的蒸汽流量。
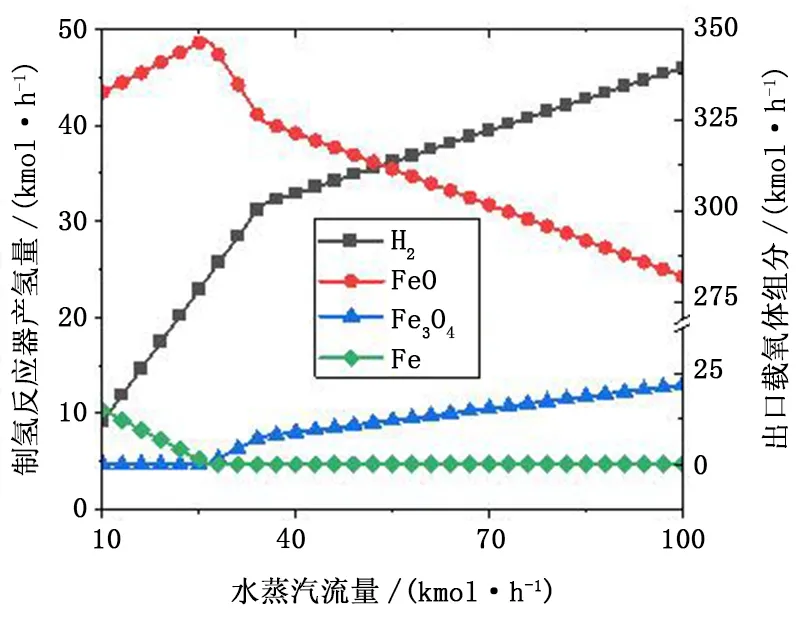
图7 水蒸气流量对制氢反应器出口产物的影响Fig.7 Effect of steam flowrate on the products of hydrogen generation reactor
4 结论
本文采用热力学方法对煤化学链燃烧耦合制氢循环进行了模拟。通过改变反应器系统的运行参数,探究了Fe2O3/C比、制氢反应器温度及水蒸气流量对该循环反应特性及产氢性能的影响。(1)热力学模拟结果表明,在Fe2O3/C比达到1.65时,燃料反应器内理论上可实现燃料的充分转化,此时载氧体仅包含Fe和FeO相,受热力学限制烟气中含极少量的CO和H2。(2)在进入制氢反应器的载氧体中,Fe相对氢气的生成具有重要作用。因此,在该循环中应将载氧体在燃料反应器中还原至较低的价态。(3)从热力学角度分析,制氢反应器温度升高不利于氢气的生成,在温度较低时,温度增加对产氢量降低的影响更为显著。(4)产氢量随水蒸气流量增大而增加,根据Fe相的量,出现了明显的分段现象。在Fe被氧化至FeO时,单位蒸汽的产氢量显著大于FeO被氧化至Fe3O4阶段。
