金丝桃苷-环糊精包合物的制备及其抗氧化活性研究
2022-09-01张馨予苏建青褚秀玲
张馨予 苏建青 褚秀玲
(聊城大学农学与农业工程学院,聊城 252000)
黄酮类物质具有很强的抗氧化和抗炎活性,作为饲料添加剂可以提高饲料的营养价值。Muqier等[1]研究发现,基础饲粮中添加11~33 mg/kg的黄酮类化合物对肉羊的生长性能和神经内分泌激素水平有显著影响,且呈时间依赖性,饲喂30 d后效果尤为明显。Yuan等[2]研究发现,杜仲叶黄酮可以缓解敌草快诱导引起的仔猪炎症和氧化应激,还可以改善肠道损伤。金丝桃苷(hyperoside,Hyp)是天然黄酮醇苷类化合物的一种,现代药理研究表明,Hyp具有抗炎、抗氧化、抗血栓、抗纤维化和镇痛等多种药理作用[3-5],对心脑缺血、肝纤维化和心力衰竭等疾病有治疗效果[6-7]。但目前并未有报道关于Hyp作为饲料添加剂用于畜禽生产及疾病预防等方面的研究。这可能是由于Hyp低水溶性、低渗透性和不稳定性等特点极大程度地影响了其应用[8]。现阶段通过包合等技术改善难溶药物的溶解度、调节药物的释放是常用的解决方法,如共晶混合物[9]、微胶囊技术[10]、纳米技术[11]等。其中,环糊精(cyclodextrins,CDs)包合是价格便宜、操作简单、技术成熟、前景良好的方法[12-13]。
环糊精的分子结构为具有疏水腔的截锥状寡糖[14],能与众多有机或无机分子通过多种非共价相互作用,如范德华力、氢键作用、疏水作用等形成水溶性的主-客体包合物;或组装成复杂的超分子体系[15],称为水溶性环糊精包合物。研究表明,黄酮是一类具有2-苯基色原酮结构的化合物,其尺寸形状与环糊精空腔大小的匹配程度以及二者间氢键形成的难易程度对于包合起着至关重要的作用[16]。因此,选用分子中带有羟基的β-环糊精(β-cyclodextrin,β-CD)或带有氨基的环糊精衍生物进行包合的效果较好[17],更有利于二者之间氢键的形成。本研究选择了3种天然或被修饰的环糊精。其中,β-CD应用范围比较广,并且毒性小,是最为常用的一种[18]。甲基-β-环糊精(methyl-β-cyclodextrin,M-β-CD)的溶解度比不加修饰的β-CD溶解度大,环糊精甲基化之后,封闭了环糊精的分子内羟基,提高了与药物包合的稳定性,对难溶性药物有很好的增溶效果[19]。羟乙基-β-环糊精(hydroxyethyl-β-cyclodextrin,HE-β-CD)在医药中可以提高药物溶解度和生物利用度,使药剂的疗效增加,还可以调整或控制药物的释放速度[20]。另外,药物包合后不仅溶解度[21]、稳定性及生物利用度[22]得到了显著提高,其药理活性也较未包合时增强[23-24]。Corina等[25]制备芦丁与β-CD和羟丙基-β-环糊精的包合物,结果显示,包合后的芦丁包合物抗氧化活性增强。Arya等[26]以β-CD包合姜黄素,姜黄素包合物的水溶性和抗氧化活性均显著提高,并发现β-CD包合物对姜黄素具有5 h的缓释特性。Hsu等[27]将大黄的乙醇提取物与2-羟丙基-β-环糊精络合,得到的包合物的水溶性和生物利用度明显增加,进而增强了对抗肝癌细胞的作用。目前,关于Hyp与环糊精包合的研究文献较少。孔晓龙等[28]将Hyp与β-CD进行包合,发现Hyp包合物的溶出速度显著提高,但未对其进行全面的表征分析及药效评价。因此,本研究对Hyp包合物进行系统的评估,以拓展其将来在畜禽养殖等方面的应用。
包合物制备方法包括饱和溶液法、溶液搅拌法、研磨法、超声波法和冷冻干燥法等。超声波法利用超声的机械效应、空化作用和热效应,提高物质的分子运动速度,增大介质分子的穿透率;并且利用超声波在液体中传播时产生的冲击波,释放能量,促进环糊精与Hyp包合过程的进行[29]。因此,本研究选用超声波法制备Hyp与3种环糊精(HE-β-CD、β-CD和M-β-CD)的包合物,并通过溶解度测定和物理化学表征,包括形貌观察、热重分析(thermogravimetric analysis,TGA)、薄层色谱及X-射线衍射(X-ray diffraction,XRD)等,综合分析不同包合物的包合效果,并从中选择增溶效果最好的包合物,通过抗氧化性试验评价包合作用对其抗氧化性能的影响。
1 材料与方法
1.1 试剂和仪器
Hyp(高效液相色谱级)购自上海源叶生物技术有限公司。β-CD、M-β-CD、HE-β-CD均购自上海麦克林生化有限公司。2,2-二苯基-1-苦基肼(DPPH)、2,2′氨基-二(3-乙基-苯并噻唑啉磺酸-6)铵盐(ABTS)均购自国药集团化学试剂有限公司。GF254硅胶板购自青岛海洋化工有限公司。RAW 264.7细胞购于中国科学院干细胞库。1640培养基、胎牛血清购自美国Gibco公司。二喹啉甲酸(BCA)蛋白浓度检测试剂盒、脂质氧化产物丙二醛(malondialdehyde,MDA)含量检测试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)活性检测试剂盒均购自上海碧云天生物技术有限公司。
主要仪器包括超显微分光光度计(F-1100型,杭州遂真生物技术有限公司)、薄层色谱仪(SB-2型,天津市天分分析仪器厂)、热重分析仪(Q-500型,美国TA公司)、差示扫描量热仪(Q-20型,美国TA公司)、X射线衍射仪(D-8 Advance型,德国布鲁克衍射荧光事业部)、扫描电子显微镜(scanning electron microscope,SEM)(JSM-840型,日本电子株式会社)。
1.2 化学计量(连续变分法)
Hyp含量测定根据Arya等[26]的方法略加调整后测定。制备浓度梯度为2.5、5.0、10.0、20.0和40.0 μg/mL的Hyp无水乙醇溶液,用紫外-可见分光光度法在360 nm波长下对制备的样品进行分析,通过Hyp溶液的吸光度值与其浓度作图建立标准曲线。
运用Job法[30]确定HyP分别与HE-β-CD、β-CD和M-β-CD形成包合物的化学计量比。维持Hyp和环糊精的总浓度不变(1 mmol/L),配制一系列浓度的Hyp和环糊精混合液,使两者的物质的量之比在0.1~0.9,在25 ℃的条件下超声包合60 min,在360 nm测定吸光度值。以有无环糊精时Hyp的吸光度差值(△ABS)为纵坐标,并以Hyp在混合液中所占比例为横坐标作图。
1.3 物理混合物和包合物的制备
每种物理混合物按主客体摩尔比1∶1混合,准确称取Hyp和3种环糊精,分别在陶瓷砂浆中充分混合均匀,室温储存备用。
根据Job曲线结果,按摩尔比1∶1制备Hyp和环糊精的复合物。取Hyp 1.0 g,加适量无水乙醇微热溶解,另取HE-β-CD 3.1 g,加水500 mL,搅拌溶解。将Hyp乙醇溶液逐滴加入搅拌中的HE-β-CD溶液中,在超声波功率300 W,超声温度50 ℃的条件下混合1 h,并振摇72 h。放冷至室温后,未溶解的固体通过0.2 μm纤维素膜过滤,滤液先在-80 ℃冰箱中冷冻,然后转入冷冻干燥机中冻干,即得到呈黄色的Hyp-HE-β-CD包合物。其他包合物的制备与Hyp-HE-β-CD相似。以下所有的表征分析都使用冻干产品。
1.4 包合物的表征分析
1.4.1 SEM观察形态差异
SEM观察是测定材料表面形貌和结构的常用手段。在SEM中,利用电子束扫描样品表面,获得三维空间信息[31]。将样品粉末均匀地黏附在导电胶上并安装至铝柱上,并喷金镀膜。在10 kV加速电压和600倍、2 000倍或5 000倍放大率下通过SEM进行成像。
1.4.2 热重分析和差示扫描量热法(differential scanning calorimetry,DSC)分析
使用热重分析仪进行热重分析,在氮气气氛下(流速为50 mL/min),按升温速率5 ℃/min从30 ℃升高到500 ℃,检测过程在铂皿中进行。
用Dai等[32]描述的方法,用差示扫描量热仪对Hyp和包合物进行了DSC分析,并进行了一些修改。将冻干样品(约5.0 mg)装入密封良好的铝锅中,然后在氮气下以10 ℃/min的速率从50 ℃加热到300 ℃。
1.4.3 薄层色谱分析
4种样液(Hyp乙醇溶液、环糊精水溶液、包合物水溶液和物理混合物水溶液)分别点于硅胶板的同侧,其下端浸入展开剂(乙酸乙酯/甲酸/水=30/3/2,体积比)中,当展开剂距板的上端1 cm时取出。晾干后,喷以5%三氯化铝乙醇溶液显影,并在紫外光灯(365 nm)下检视。
1.4.4 XRD分析
采用X射线衍射仪在铜激发α射线(Cu-Kα)辐射下,以5°/min的扫描速率获得了Hyp、Hyp-HE-β-CD及其他包合物的XRD光谱。将粉末样品安装在玻璃样品架上,扫描步长为2θ=0.02°,在5°~90°(θ~2θ)处获得了衍射图形。
1.5 溶解性研究
在25 °C、5 mL水中加入过量的Hyp(10 mg)或其包合物(250 mg),每5 min对上清中Hyp含量进行1次测定,持续到200 min做最后1次测量。每个样品重复3次,绘制Hyp及其3种包合物随时间的溶解度变化曲线。
1.6 温度对Hyp/HE-β-CD络合反应的影响
参照Liu等[33]的方法,适当调整后进行温度对溶解度影响的研究。配制体积为5 mL的一系列摩尔浓度(0、1.0、2.5、5.0、10.0、20.0、40.0 mmol/L)的HE-β-CD溶液,过量的Hyp(10 mg)加到以上溶液的离心管中。在300 W的功率下包合60 min,然后在恒温振荡器中振荡72 h。混合物的平衡温度分别为30、40和50 ℃。离心后取上清,再用0.2 μm亲水性纤维素膜过滤器过滤,去除未溶解的Hyp。用超微分光光度计测定紫外-可见吸收光谱,得到Hyp-HE-β-CD包合物的紫外-可见光谱滴定图。通过绘制Hyp溶解度随环糊精浓度的变化曲线,得到在不同温度、不同环糊精浓度下的Hyp溶解度图。根据溶解度数据计算表观稳定常数(Ks),并分析Hyp与HE-β-CD的相互作用热力学,得到Ks的对数与温度倒数的关系图。所有试验平行测定3次。Ks的公式如下:
Ks=slope/[S(1-slope)]。
式中:S指在不同温度下无环糊精条件下Hyp的溶解度;slope为相溶解度图对应的斜率。
根据Van’t Hoff方程计算包合物的吉布斯自由能(ΔG):
lnKs=-(ΔH/RT)+ΔS/R;ΔG=ΔH-TΔS。
式中:ΔH为焓变(kJ/mol);R为通用气体常数[J/(mol·K)];T为绝对温度(K);ΔS为熵变[J/(mol·K)]。
1.7 抗氧化活性
以DPPH、ABTS、羟基自由基清除率、超氧阴离子清除率和还原能力为指标,比较Hyp包合前后的抗氧化能力。DPPH清除试验参考Andrade等[34]的方法,ABTS自由基清除试验参考Aarland等[35]的方法,羟基自由基清除试验参考Dai等[36]的方法,超氧阴离子清除率采用邻苯三酚自氧化法[37]进行测定,还原能力测定参考Chen等[38]的方法。试验使用蒸馏水和维生素C分别作空白对照和阳性对照[39]。
1.8 细胞抗氧化试验
1.8.1 药物安全性评价
采用CCK-8法进行安全性评价。将对数生长期细胞密度调整为5×104个/mL,以每孔200 μL接种于96孔板,待细胞生长至80%~90%时,弃上清,并使用磷酸盐缓冲液(PBS)清洗1遍。加入200 μL含有不同浓度(75、100、125、150、175、200 μg/mL)Hyp和Hyp-HE-β-CD包合物的培养基,作用24 h后弃上清。每孔加入含有10% CCK-8溶液的1640培养基,37 ℃孵育30 min,使用酶标仪在450 nm出测吸光度值,并计算细胞存活率。
1.8.2 过氧化氢(H2O2)诱导RAW264.7细胞氧化损伤模型的建立
重复1.8.1的操作步骤,使用PBS清洗后,加入200 μL含有不同浓度H2O2(100、200、400、600、800、1 000 μmol/L)的无血清1640培养基,孵育2 h后计算细胞存活率。
1.8.3 Hyp及其包合物对H2O2-RAW264.7细胞氧化应激的保护作用
按1.8.1步骤进行操作,并设立空白组、H2O2组、维生素C对照组(100 μg/mL)、Hyp组(100 μg/mL)和Hyp-HE-β-CD包合物组(50、100、150 μg/mL)。空白组和H2O2组以无血清1640培养基代替样品。药物作用24 h后去除培养基,清洗后再加入含有400 μmol/L H2O2的无血清1640培养基作用2 h,计算细胞存活率。
1.8.4 细胞内MDA含量及SOD活性检测
将6孔板中细胞密度调整为2×105个/mL,待密度达到80%~90%时,弃上清并使用PBS清洗1遍,参照1.8.3的方法进行培养并分组。根据免疫沉淀(immunol precipitation,IP)裂解液说明书裂解细胞并收集上清液,采用BCA法检测蛋白浓度,严格按照试剂盒说明书检测细胞内MDA含量和SOD活性。
1.9 数据分析
使用OriginPro 9.1软件进行作图,使用SPSS 21.0软件对数据进行单因素方差分析(one-way ANOVA),采用LSD法进行多重比较,P<0.01为差异极显著,P<0.05为差异显著。结果用“平均值±标准差”表示。
2 结果与分析
2.1 络合化学计量的测定
Hyp含量测定的标准曲线如下:y=0.037 3x+0.047 8(R2=0.996 6)。通过Job法[30]测定3种环糊精与Hyp之间的包合比。图1为HE-β-CD、β-CD和M-β-CD与Hyp在乙醇与水的混合溶液中的Job曲线图,图中曲线的最高点在Hyp比例为0.5时出现,可以判断出HE-β-CD与Hyp的最佳包合比为1∶1。β-CD和M-β-CD与Hyp进行包合也得到类似结果,表明本研究中选择的3种环糊精类型与Hyp之间均为1∶1包合。
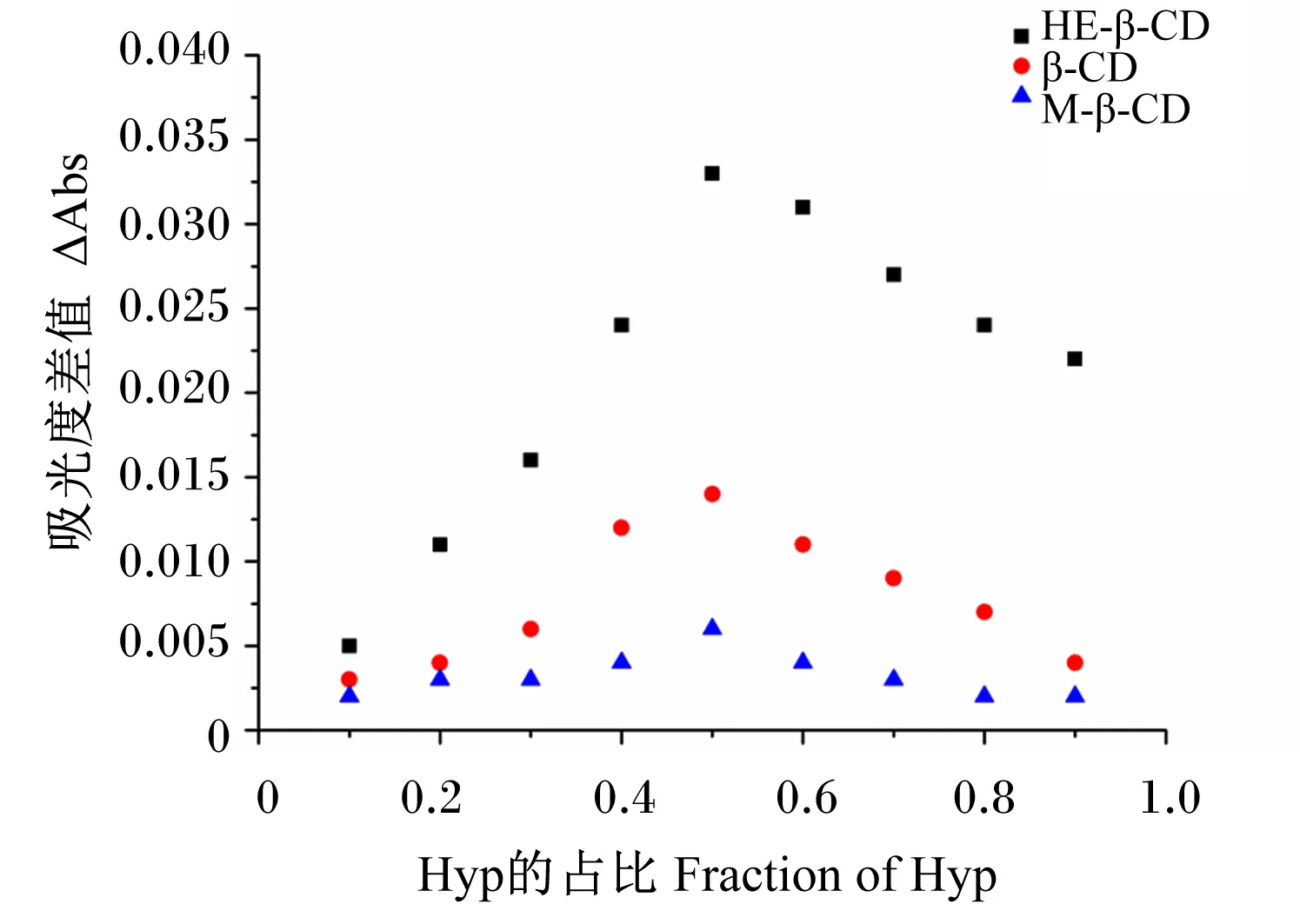
Hyp:金丝桃苷 hyperoside;HE-β-CD:羟乙基-β-环糊精 hydroxyethyl-β-cyclodextrin;β-CD:β-环糊精 β-cyclodextrin;M-β-CD:甲基-β-环糊精 methyl-β-cyclodextrin。下图同 the same as below。
2.2 表征分析结果
2.2.1 SEM分析结果
由Hyp、3种包合物及3种物理混合物的SEM图和包合物的实物图(图2)可见,Hyp呈大小不同的块状晶体,HE-β-CD为中空球状结构,β-CD为小型块状结构,M-β-CD虽结构不完整但仍能看出其自身为球形,3种包合物都是表面附着一些疏松细小颗粒的块状晶体。但不同主体环糊精的包合物又具有不同的形貌特征,其中Hyp-HE-β-CD包合物中HE-β-CD本身的球状结构已经完全消失,呈不规则块状且光滑平面上嵌入类似细小晶体的形态,并呈现明显主客体环抱形;Hyp-β-CD包合物的表面较为粗糙且有明显裂痕;Hyp-M-β-CD包合物表面只观察到少量客体嵌入且表面无裂痕。另外,各物理混合物仍保留其主客体自身的结构特征,均可观察到单独的Hyp晶体和单独的环糊精形态,因此不能将其理解为是一种新物质的合成[40]。

图2 Hyp(a)(2 000×和5 000×)、Hyp/HE-β-CD包合体系(b)Hyp/β-CD包合体系(c)Hyp/M-β-CD包合体系(d)的SEM及粉末图
2.2.2 热重分析和DSC分析结果
Hyp及其包合物的热重分析见图3-a。Hyp-HE-β-CD包合物有2个失重过程,分别对应于空腔内水分子的脱水和大环的分解。Hyp-HE-β-CD包合物在310 ℃下的降解损失了77.5%的重量[41]。Hyp在100、170、250和420 ℃分别发生了失重。
各包合物的DSC分析见图3-b。HE-β-CD、β-CD和M-β-CD包合物分别在232、219和250 ℃出现明显的峰,这些特征峰的出现可归因于聚合物中结合水的蒸发。对Hyp的DSC分析结果显示,在123和190 ℃有2个明显的吸热峰,在123 ℃时的吸热峰可能是由于Hyp中水分的去除,而在190 ℃时的吸热峰可能是由于Hyp晶体的熔化,说明Hyp以结晶状态存在[42]。
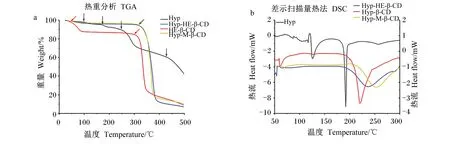
图3 Hyp和3种包合物的热重分析和DSC分析
2.2.3 薄层色谱分析结果
薄层色谱是一种用于分离混合物的色谱技术。由于对固定相的吸引力和在溶剂中的溶解度不同,样品混合物中的不同化合物以不同的移动速率移动。Hyp、HE-β-CD、β-CD、M-β-CD及它们的包合物和物理混合物的薄层色谱结果在紫外光下的可视化如图4所示。因为环糊精没有荧光部分,在紫外光照射下均没有观察到斑点,而3种包合物和物理混合物均显示了来自Hyp的荧光点。其中,Hyp和Hyp-HE-β-CD物理混合物与Hyp-HE-β-CD包合物相比有较快的速度移动(图4-a),类似现象也出现在Hyp-β-CD包合体系中(图4-b)。Hyp-HE-β-CD物理混合物和Hyp-β-CD包合物的移动速度略慢于Hyp,而Hyp-M-β-CD包合物与Hyp的移动速度相近(图4-c)。

图4 在紫外光下Hyp、环糊精及其包合物和物理混合物的薄层色谱图
2.2.4 XRD分析结果
特征峰在光谱中出现、特征峰的升高或降低都是包合物形成的证据[43]。Hyp及Hyp-HE-β-CD、Hyp-β-CD和Hyp-M-β-CD包合物的XRD分析结果如图5所示。Hyp在10°~40°具有特征性的高能衍射峰,说明药物具有典型的晶体结构特征。Hyp-HE-β-CD包合物的衍射图可以看到Hyp的某些衍射峰减弱,并在30°~45°处出现了一些宽的衍射峰,这些峰的变化说明Hyp被包合到环糊精中[40,44]。Hyp-β-CD和Hyp-M-β-CD包合物的衍射图仍具有Hyp客体结晶型的特征衍生峰,但强度和数目明显减少。

图5 Hyp及Hyp-HE-β-CD、Hyp-β-CD和Hyp-M-β-CD包合物的XRD分析
2.3 溶解度试验
药物与环糊精络合后,包合物的水溶性较包合前普遍有不同程度的提高,尤其对自身难溶于水甚至不溶于水的物质[45]。如图6所示,Hyp在水中的溶解速率极为缓慢,溶解60 min后速溶解率趋于平缓;3种包合物均表现出良好的水溶性,其中Hyp-HE-β-CD包合物在前15 min内迅速溶解,随后溶解速率降低趋于稳定,15 min时其溶解度约占饱和状态下总溶解度的84.51%,而Hyp-β-CD和Hyp-M-β-CD包合物的溶解度分别约占饱和状态下总溶解度的70.70%和84.06%,故Hyp-HE-β-CD包合物比其他2种包合物具有更快的溶解速率。HE-β-CD、β-CD和M-β-CD包合物的增溶作用使Hyp的水溶性分别提高到1 255.62、1 138.01和1 040.42 μg/mL,显著高于Hyp单体(约153.09 μg/mL)。其中Hyp-HE-β-CD包合物的增溶效果最佳,可达8.2倍。
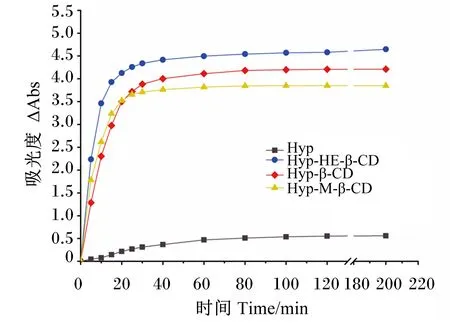
图6 Hyp及Hyp-HE-β-CD、Hyp-β-CD和Hyp-M-β-CD包合物在水中的溶解度特性
2.4 温度对Hyp与Hyp-HE-β-CD络合反应的影响
如图7所示,随着主体HE-β-CD浓度不断增加,Hyp的吸光值不断增大,肉眼可见形成的包合物颜色逐渐加深。此外,随着HE-β-CD浓度的增加,Hyp的溶解度呈线性增加,再次验证了Hyp与HE-β-CD在溶液中形成了包合物且两者摩尔比为1∶1。

a~g:HE-β-CD浓度分别为0、1.0、2.5、5.0、10.0、20.0、40.0 mmol/L。
表1为不同温度下Hyp和HE-β-CD溶解度直线图的截距、斜率和Ks。温度越高,线性曲线的截距越大,表明Hyp溶解度随温度的升高而增大。另外Ks随温度升高而显著降低,意味着Hyp加入HE-β-CD后伴随着放热。

表1 从Hyp和HE-β-CD溶解度图中得到的不同温度下的截距、斜率和Ks
通过对不同温度下溶解度的研究,可以计算出焓值和熵值的变化。Hyp-HE-β-CD包合物形成的Van’t Hoff图如图8所示,Ks与绝对温度的倒数(1/T)呈线性关系(R2=0.992)。根据这条线性曲线的斜率和截距可以计算出热力学参数:焓变=-67.55 kJ/mol和熵变=-172.52 J/(mol·K)。进一步计算出络合相互作用的不同温度下的ΔG的变化,ΔG30 ℃=-15.28 kJ/mol,ΔG40 ℃=-13.55 kJ/mol,ΔG50 ℃=-11.83 kJ/mol。
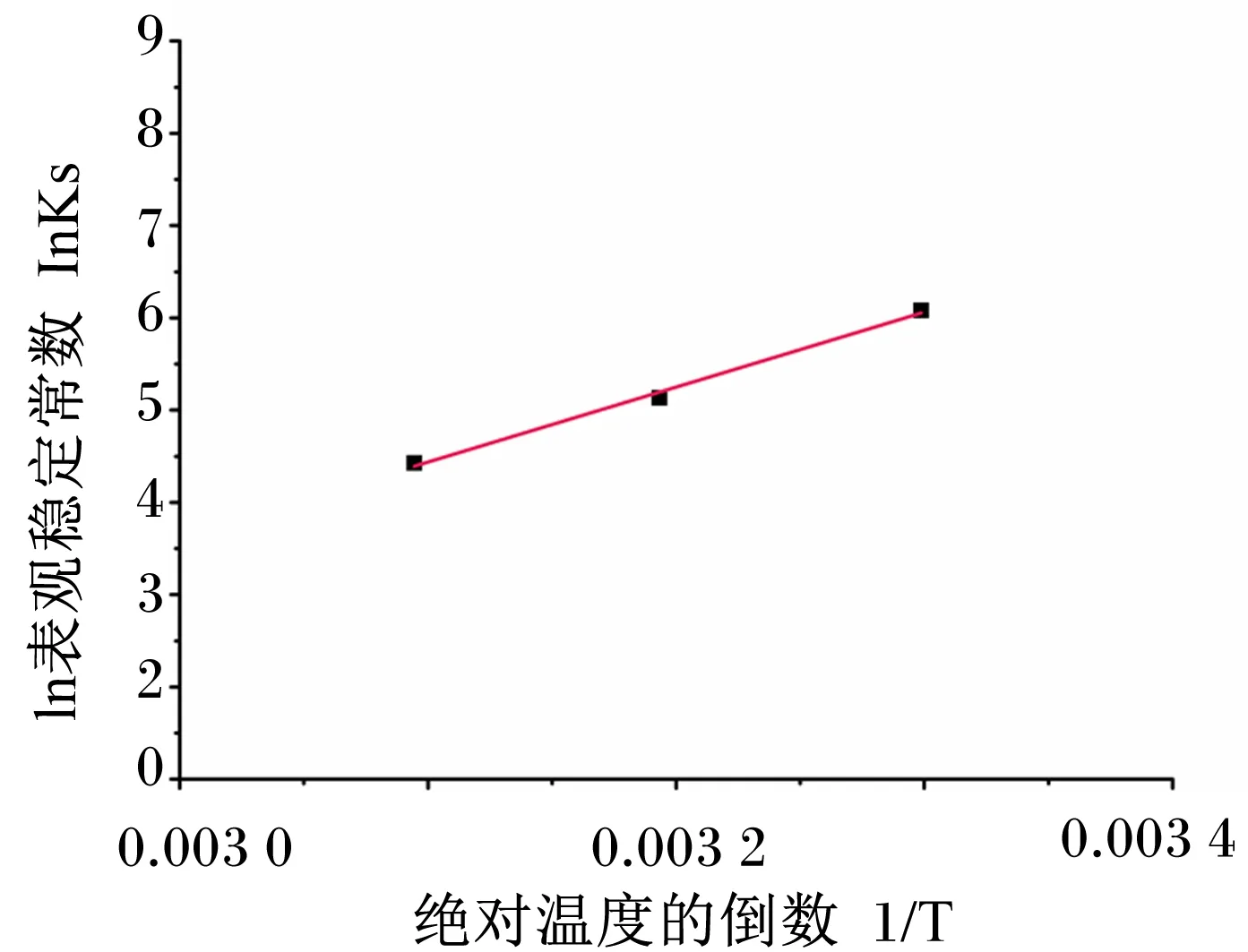
图8 Hyp-HE-β-CD包合物的Van’t Hoff图
2.5 抗氧化活性的测定结果
目前基于化学氧化还原反应已经开发出多种检测方法用于评估中药中黄酮类成分的抗氧化活性,这些检测方法按照机理大致可以分为2类:通过单电子转移或氢原子转移达到抗氧化的目的[46]。本研究中采用的5种检测方法的反应原理有差异,基于氢原子转移的DPPH方法是通过检测抗氧化剂提供1个氢原子淬灭自由基的能力[47],ABTS、还原力、羟基自由基和超氧阴离子清除试验则是通过检测抗氧化剂转移1个电子以减少自由基或金属离子的氧化性[48]。另外,本试验既检测疏水化合物的清除能力(DPPH法),又检测亲水化合物的清除能力(ABTS法),多种测定方法相辅相成,可以充分评价包合前后Hyp的抗氧化能力。
DPPH试验结果表明(图9-a),在2.5~15.0 μg/mL的样品浓度范围内,DPPH自由基清除率随着Hyp、Hyp-HE-β-CD包合物和维生素C浓度的增加均增加,并表现出浓度依赖性。当样品浓度增加到20 μg/mL时,DPPH自由基清除率分别达到91.14%、92.05%和94.05%;然而随样品浓度继续增加,DPPH自由基清除率均趋于平缓。Hyp、Hyp-HE-β-CD包合物和维生素C的半抑制浓度(IC50)分别为7.136、6.500和8.194 μg/mL。总的来说,Hyp-HE-β-CD包合物的DPPH清除能力强于未被包合的Hyp,这可能是由于Hyp-HE-β-CD包合物在水中能释放出更多与DPPH自由基结合的氢原子,导致DPPH自由基的还原激进[49]。
在ABTS清除试验中(图9-b),Hyp、Hyp-HE-β-CD包合物和维生素C的IC50分别为8.251、6.362和7.495 μg/mL。随着样本浓度增大,Hyp-HE-β-CD包合物和Hyp对ABTS自由基清除能力随之提高,并且前者始终优于后者。当浓度为25 μg/mL时,Hyp和Hyp-HE-β-CD包合物对ABTS自由基的最大清除率分别达到82.68%和88.67%。
考虑到羟基自由基作为生物体内最活跃的氧物质容易与其他如脂质或蛋白质等分子反应进而引起病变[50],因此评价药物对羟基自由基清除能力至关重要。由于Hyp在水中的溶解度仅能达到50 μg/mL,因此本研究仅对此浓度范围内的Hyp和Hyp-HE-β-CD包合物的羟基自由基清除能力进行比较,结果如图9-c所示。虽然在最高样本浓度下,Hyp-HE-β-CD包合物和Hyp的羟基自由基清除率仅为28.01%和19.41%,但Hyp-HE-β-CD包合物对羟基自由基清除率明显强于未包合的Hyp。
从图9-d可以看出,3种样品对超氧阴离子均具有一定的清除作用,且作用效果均与样品浓度呈正相关。在最大浓度500 μg/mL时,Hyp-HE-β-CD包合物的超氧阴离子清除率虽不及维生素C,但明显高于Hyp;Hyp-HE-β-CD包合物、维生素C和Hyp对超氧阴离子清除率清除率分别为57.27%、98.47%和41.46%。
另外,通过检测铁氰化钾中三价铁离子(Fe3+)被还原为二价铁离子(Fe2+)的含量来评估药物的另一个衡量抗氧化能力的潜在指标——还原能力[51],结果表示吸光值越高其还原能力越强。从图9-e可以看出,Hyp-HE-β-CD包合物和Hyp的还原能力均略低于维生素C,虽然Hyp-HE-β-CD包合物比未包合的Hyp表现出更强的还原能力,但包合前后对该指标的影响不大。

图9 Hyp和Hyp-HE-β-CD包合物的抗氧化试验结果
2.6 Hyp-HE-β-CD包合物对H2O2诱导RAW264.7细胞氧化应激的保护作用
Hyp和Hyp-HE-β-CD包合物对RAW264.7细胞存活率的影响见图10-a,两者分别在50~125 μg/mL和50~150 Μg/mL区间内对细胞的增殖具有促进作用,且随浓度升高促增殖效果呈先增大后减小的趋势;当Hyp浓度达到150 μg/mL,细胞存活率显著低于空白组(P<0.05);而Hyp-HE-β-CD包合物浓度达175 μg/mL,细胞存活率才显著低于空白组(P<0.05)。因此,选择Hyp-HE-β-CD包合物的低、中、高浓度(50、100、150 μg/mL)进行后续试验,并与促增殖效果最强的100 μg/mL Hyp做对比。
H2O2刺激对RAW264.7细胞存活率的影响见图10-b,随着H2O2浓度的增加,细胞存活率逐渐下降,当H2O2浓度达到1 000 μmol/L时,细胞存活率仅为15.61%,获得IC50为493.21 μmol/L。
Hyp和Hyp-HE-β-CD包合物对H2O2诱导的RAW264.7细胞氧化应激的保护作用见图10-c,50 μg/mL Hyp-HE-β-CD包合物组的细胞存活率极显著高于100 μg/mL Hyp组(P<0.01),意味着Hyp被HE-β-CD包和后对H2O2刺激RAW264.7细胞具有更高的保护效果。另外,100 μg/mL Hyp-HE-β-CD包合物组的存活率极显著高于空白组(P<0.01),进一步肯定了包合作用的重要意义。
MDA由多不饱和脂肪酸被氧代谢产生的活性自由基降解而形成,是细胞中氧化应激的指标[52]。SOD可催化有毒的超氧阴离子(·O2-)分解为氧气(O2)和H2O2,防止超氧阴离子的毒性作用对细胞造成损伤[53],是氧化应激防御系统中一种重要的抗氧化酶。由图10-d可知,空白组细胞MDA含量与模型组有极显著差异(P<0.01),表明模型组细胞受到刺激后出现严重脂质过氧化;维生素C组细胞MDA含量极显著低于模型组(P<0.01),而与Hyp组和Hyp-HE-β-CD包合物组无显著差异(P>0.05),说明Hyp与维生素C具有类似的治疗效果;与Hyp组相比,中浓度Hyp-HE-β-CD包合物组细胞MDA含量极显著降低(P<0.01)。另外,由图10-e可知,模型组细胞SOD活性极显著低于其他各组(P<0.01),中浓度Hyp-HE-β-CD包合物组细胞SOD活性显著高于Hyp组(P<0.05),且低浓度Hyp-HE-β-CD包合物组细胞SOD活性显著高于空白组(P<0.05)。
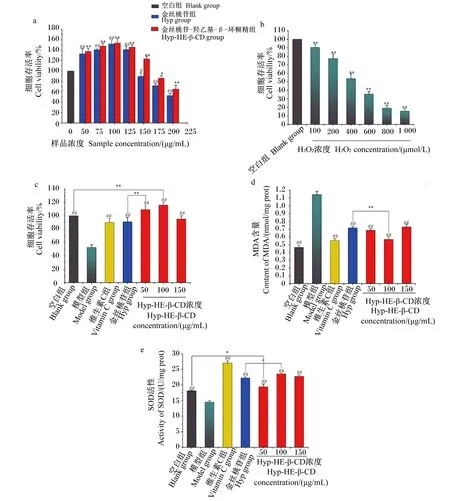
图a、b中,与空白组相比,*表示差异显著(P<0.05),**表示差异极显著(P<0.01),#表示差异显著(P<0.05),##表示差异极显著(P<0.01)。图c、d、e中,2组间比较,*表示差异显著(P<0.05),**表示差异极显著(P<0.01);与模型组比较,##表示差异极显著(P<0.01)。
3 讨 论
将Hyp和HE-β-CD、β-CD、M-β-CD均按最佳包合比1∶1包合后干燥,得到淡黄色粉末。在各包合物SEM图中可以看出新物质体积明显大于包合前的单体,且其中Hyp的特殊形态特征已不存在,这些明显的变化说明了Hyp和HE-β-CD、β-CD和M-β-CD均有效形成了包合物,并且形成包合物后,其表面晶形结构都发生了变化,而物理混合物不具备以上特征。根据热重分析结果,各包合物均比Hyp发生失重的温度更晚,因此包合物的热稳定性更高。DSC分析结果中Hyp-HE-β-CD、Hyp-M-β-CD和Hyp-β-CD包合物的吸热峰消失,表明包合的Hyp以无定型存在于环糊精中,与晶体分子不同,无定型分子的溶解不需要任何能量来打破晶体,因此它们能够作为聚合物基质的易扩散体,从而使封装的Hyp有可能持续释放。薄层色谱结果中,Hyp与包合物(Hyp-HE-β-CD和Hyp-β-CD包合物)和物理混合物的移动速度差异表明,Hyp被包封在环糊精腔内,包合物中的Hyp与固定相和展开溶剂的相互作用与未被包合的Hyp不同,而物理混合物中Hyp没有很好的被环糊精包封,并且Hyp-M-β-CD包合物中Hyp和M-β-CD的包合作用相对较弱。XRD结果的差异均是因为包合物的制备过程使Hyp进入环糊精中,表现出非晶型或以无定型的形式存在[54]。Zheng等[55]在对α-硫辛酸与2-羟丙基-β-CD形成的包合物研究中得出了相似的结论。
Hyp-HE-β-CD包合物的增溶效果优于其他2种包合物,其水溶性是Hyp的8.2倍,这可能与HE-β-CD的自身性质有关,其内疏水、外亲水的特性能使难溶性药物分子进入其内腔而形成包合物,从而极大地提高Hyp在水中的溶解度,有研究也证实了该环糊精是一种极具应用潜力的难溶性药物的增溶剂[56]。为实现在临床医药领域的广泛价值,故选择增溶效果最佳的Hyp-HE-β-CD包合物进行后续试验,并探究了温度对两者包合作用的影响。随着温度升高,Hyp-HE-β-CD包合物的溶解度直线的截距增大且Ks降低,说明该络合过程伴随放热。其他络合物也表现出类似的性质,Mazzobre等[57]采用共同沉淀法制备了α-松油醇与β-CD的包合物,Mourtzinos等[58]将百里香酚和香叶醇分别与β-CD包合,溶解度研究结果均显示以上络合过程均是自发放热的。由于焓变为负值,也说明Hyp与HE-β-CD络合为放热过程,并且该络合作用为低能型。Liu等[33]研究发现,这些络合作用的发生主要取决于黄酮的空间效应和疏水性,可能为络合时疏水性更强的黄酮分子将环糊精空腔中的水分子替代,同时与腔内的侧基形成氢键,从而进一步稳定包合结构。另外,熵变为负值表明由于络合分子的平动和转动自由度比自由分子的低,使系统变得更加稳定[58]。ΔG均为负值表示Hyp与HE-β-CD的络合作用是自发进行的。
通过检测抗氧化试验中5项抗氧化指标可以得到结论,三者的抗氧化能力顺序为维生素C>Hyp-HE-β-CD包合物>Hyp。因此,被HE-β-CD包和后的Hyp比包合前的Hyp具有更好的抗氧化性能,为其在细胞水平上的抗氧化活性探究奠定基础。另外,在应对H2O2诱导RAW264.7细胞产生的氧化应激中,中浓度Hyp-HE-β-CD包合物组表现出良好的保护作用,在降低MDA含量和提高SOD活性方面的作用效果显著强于Hyp。由此再次说明Hyp被HE-β-CD包合后,其抗氧化性能有较大程度地提高,可以更好地提高RAW264.7细胞中抗氧化酶的活性,从而抑制H2O2累积造成的脂质过氧化,减轻细胞的氧化应激,更有利于维持和改善细胞生理活性。这可能是由于环糊精具有特殊的分子结构、良好的稳定性和易于化学修饰等特性,在药物递送中表现出极大的优势,HE-β-CD与Hyp形成的主-客体复合结构对内部的Hyp起一定保护作用,保证其溶于水后可以更好地进入细胞内发挥作用。该试验结果对制备Hyp的环糊精包合物具有肯定和推动作用。
4 结 论
Hyp具有一系列的药理活性,但由于其水溶性差、生物利用度低而限制了其应用。本文采用1∶1的化学计量学方法成功制备了Hyp和环糊精的包合物。与Hyp-β-CD和Hyp-M-β-CD包合物相比,Hyp-HE-β-CD包合物具有更高的水溶性。热力学研究表明,3种包合物的热稳定性均明显强于Hyp,并且Hyp分子进入HE-β-CD内部是一个自发放热过程。根据SEM图像,Hyp分子被插入到HE-β-CD空腔中形成络合物结构,该结构能保护内部Hyp分子更好地发挥抗氧化作用。本研究对于扩大Hyp在医药产品、饲料添加剂等领域中的应用具有重大意义。
