难治性Graves病患者外周血免疫学特征分析
2022-09-01胡诗倩何明倩陈子怡王悦
胡诗倩 何明倩 陈子怡 王悦
Graves病(Graves'disease,GD)是常见的器官特异性自身免疫性疾病,在遗传、环境和表观遗传等多种因素作用下,机体产生促甲状腺素受体自身抗体(thyrotropin receptor antibody,TRAb),CD4+T细胞在此过程中发挥了关键作用。GD主要表现为甲状腺毒症,可引起全身各系统的损害。目前抗甲状腺药物是GD患者的一线治疗方案。但是正规药物治疗后,仅有40%~50%的患者可获得长期缓解[1-2],部分难治性GD患者尽管规律治疗5年以上,但TRAb持续阳性或甲状腺功能指标持续异常。目前,难治性GD的确切发病机制尚未完全阐明。因此,本研究通过比较难治性及缓解期GD患者外周血单个核细胞(peripheral blood mononuclear cell,PBMC)基因表达的差异,外周血CD4+T细胞亚群[Th17和调节性T细胞(regulatory T cell,Treg)]比例,以及下游相关细胞因子水平,探讨难治性GD可能的免疫学发病机制,为难治性GD的治疗提供新靶点,现报道如下。
1 对象和方法
1.1 对象 选择2018年12月至2021年2月于西安交通大学第一附属医院内分泌科门诊就诊的难治性GD患者27例(难治性GD组),其中男4例,女23例,年龄20~52(37.7±9.1)岁;TRAb水平(33.1±8.6)U/L;甲状腺功能亢进1例(3.7%),亚临床甲状腺功能亢进26例(96.3%)。选择同期年龄、性别相匹配的缓解期GD患者25例(缓解期GD组),其中男2例,女23例,年龄20~65(38.6±12.0)岁;TRAb水平(4.7±1.5)U/L;甲状腺功能均正常。两组患者性别、年龄比较差异均无统计学意义(均P>0.05),TRAb水平及甲状腺功能比较差异均有统计学意义(均P<0.05)。纳入标准:(1)难治性GD患者[3-5]:根据临床表现及相关辅助检查确诊为GD,抗甲状腺药物治疗5年以上,TRAb持续阳性,或甲状腺功能指标持续异常的患者;(2)缓解期GD患者:根据临床表现及相关辅助检查确诊为GD,抗甲状腺药物停药1年以上,甲状腺功能正常且TRAb阴性的GD患者。排除标准:(1)有其他自身免疫性疾病,感染性疾病,严重心、肝、肾疾病,或恶性肿瘤的患者;(2)正在使用免疫调节剂的患者。本研究已通过西安交通大学第一附属医院医学伦理委员会审批(批准文号:XJTU1AF2016LSK-35),所有研究对象均签署知情同意书。
1.2 方法
1.2.1 标本采集及主要试剂、仪器 所有患者抽取空腹静脉血,用无菌EDTA抗凝管收集,部分血样用于转录组测序及流式细胞分析,其余血样离心取血浆分装后-80℃储存备用。淋巴细胞分离液为美国Sigma-Aldrich公司产品,Trizol RNA分离试剂、SuperScript dscDNA合成试剂盒均为美国Invitrogen公司产品,Cell stimulation cocktail为美国eBioscienc公司产品,FITC小鼠抗人CD3抗体、FITC小鼠抗人CD4抗体、APC小鼠抗人CD8抗体、Fixation/Permeabilization试剂盒、Stain‐ing Buffer均为美国BD Pharmingen公司产品,APC小鼠抗人CD25抗体、PE小鼠抗人Foxp3抗体、PE小鼠抗人IL-17A抗体、PE小鼠IgG1均为美国eBioscience公司产品;人TRAb放射受体分析试剂盒为天津市协和医药科技有限公司产品;Luminex液相悬浮芯片为上海华盈生物医药科技有限公司产品;人TGF-β1 ELISA试剂盒为美国Raybiotech公司产品;FACS Calibur流式细胞仪为美国BD公司产品;Luminex 200检测仪为美国Luminex Corporation公司产品;Illumina HiSeq 3000测序仪为美国Illumina公司产品。
1.2.2 TRAb检测 采用放射受体分析法。根据人TRAb放射受体分析试剂盒说明书步骤进行,检测范围为0~405 U/L,正常参考范围为<9 U/L。
1.2.3 转录组测序及数据分析 采用密度梯度离心法提取外周血PBMC,加入Trizol溶解后抽提mRNA。mRNA扩增后用片段缓冲液将其裂解为300 bp的片段。然后,将这些片段作为模板,根据说明书步骤使用SuperScript dscDNA合成试剂盒合成dscDNA。制备的dscDNA文库经纯化、富集、评估后,用Illumina HiSeq 3000测序仪进行测序。原始测序数据去除低质量碱基和适配器序列,用每千个碱基的转录每百万映射读取的碎片(FPKM)值计算基因表达量。采用DE‐Seq2包鉴定文库之间的差异表达基因,差异倍数(fold change,FC)≥2,即|log2FC|≥1和错误发现率(false dis‐covery rate,FDR)<0.05的基因被认为具有显著性。使用ggplot2包绘制火山图。使用“clusterProfiler”R包进行基因本体论(gene ontology,GO)和京都基因与基因组百科全书(Kyoto encyclopedia of genes and ge‐nomes,KEGG)富集分析,判定其主要影响的生物学功能及信号通路,设定P<0.05为阈值。
1.2.4 Th17细胞比例检测 采用流式细胞术。调节PBMC 浓度至 2×106/ml,取 500 μl置于 EP管中;加入2 μl cell stimulation cocktail,37 ℃、5% CO2培养箱培养6 h;用staining buffer洗涤2次;重悬后取100 μl,加入10 μl CD3 FITC 和 10 μl CD8 APC,室温避光孵育30 min;洗涤2次后加入1 ml 1×Fix/Perm液,4℃避光孵育 45 min;洗涤 2次、用 100 μl 1×Perm/wash buffer重悬后加入5 μl IL-17A PE,室温避光孵育45 min;洗涤、重悬、上机检测。结果以CD3+CD8-IL-17A+的T细胞数占CD4+T细胞数的百分比表示。
1.2.5 Treg细胞比例检测 采用流式细胞术,密度梯度离心法提取PBMC,重悬后计数,调节细胞浓度至1×106/ml,取 100 μl置于 EP 管中,加入 10 μl CD4 FITC 和 5 μl CD25 APC,室温避光孵育 30 min;用staining buffer洗涤2次;加入1 ml 1×Fix/Perm破膜固定液,4℃避光孵育45 min;用1×Perm/wash buffer洗涤2次;重悬加入5 μl Foxp3 PE,室温避光孵育45 min;再次洗涤、重悬、上机检测。结果以CD4+CD25+Foxp3+的T细胞数占CD4+T细胞数的百分比表示。Th17/Treg比值为CD3+CD8-IL-17A+的T细胞数和CD4+CD25+Foxp3+的T细胞数的比值。
1.2.6 细胞因子检测 采用Luminex液相悬浮芯片技术。按说明书要求准备好血浆样品、Serum Matrix、标准品、参照品,按照既定顺序上样;96孔板中每孔加入25 μl微珠、25 μl样品和 25 μl Assay Buffer;取 50 μl准备好的稀释标曲、Blank和参照品Control加入对应孔中,将96孔板贴上封口膜,850 r/min振荡、4℃避光过夜孵育;弃去每孔中的样品,洗涤3次;每孔中加入50 μl Detection Antibody,贴上封口膜,850 r/min振荡、室温避光孵育1 h;每孔加入50 μl Streptavidin-PE,贴上封口膜,850 r/min振荡、室温避光孵育30 min;洗涤3次;每孔中加入150 μl Sheath Fluid重悬微珠,贴上封口膜,850 r/min室温避光振荡5 min;将96孔板放入校正好的Luminex 200检测仪中读值。
1.3 统计学处理 采用SPSS 21.0统计软件、FlowJo软件和GraphPad Prism 8软件。符合正态分布的计量资料以表示,组间比较采用两独立样本t检验;不符合正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-WhitneyU检验。计数资料以百分比表示,组间比较采用χ2检验或Fisher确切概率法。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者PBMC转录组测序分析 相较于缓解期GD组患者,难治性组GD患者PBMC中共筛选出265个显著性差异表达基因,其中45个基因表达下调,211个基因表达上调,见图1a(插页)。KEGG富集分析显示,难治性GD组患者PBMC中上调的差异基因主要在cytokine-cytokine receptor interaction、IL-17 signaling、NF-κB signaling、MAPK signaling、Th17 cell differentiation等与Th17细胞分化及下游效应细胞因子作用相关的信号通路富集,见图1b(插页)。GO分析显示,上调的差异基因参与了cell chemotaxis、positive regulation of acute inflammatory response、leukocyte che‐motaxis等与炎症和趋化相关的生物学过程,主要影响cytokine activity、cytokine receptor binding、receptor li‐gand activity、chemokine activity、chemokine receptor binding等分子功能,见图1c、d(插页)。
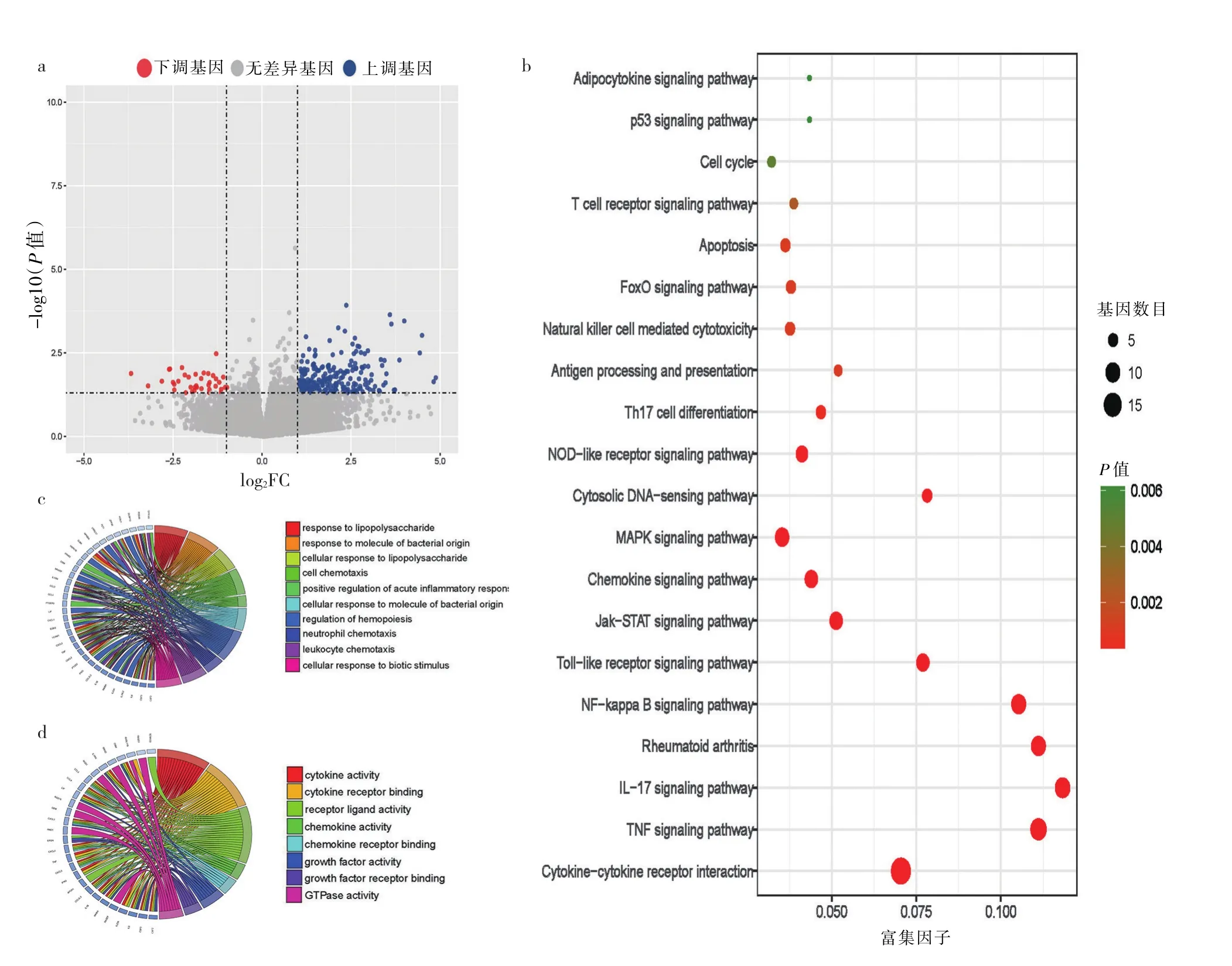
图1 两组患者PBMC转录组测序分析
2.2 两组患者外周血Th17、Treg细胞比例分析 难治性GD组外周血中Th17细胞比例高于缓解期GD组,而Treg细胞比例低于缓解期GD组,Th17/Treg比值也高于缓解期GD组,差异均有统计学意义(均P<0.05),见图2-4。
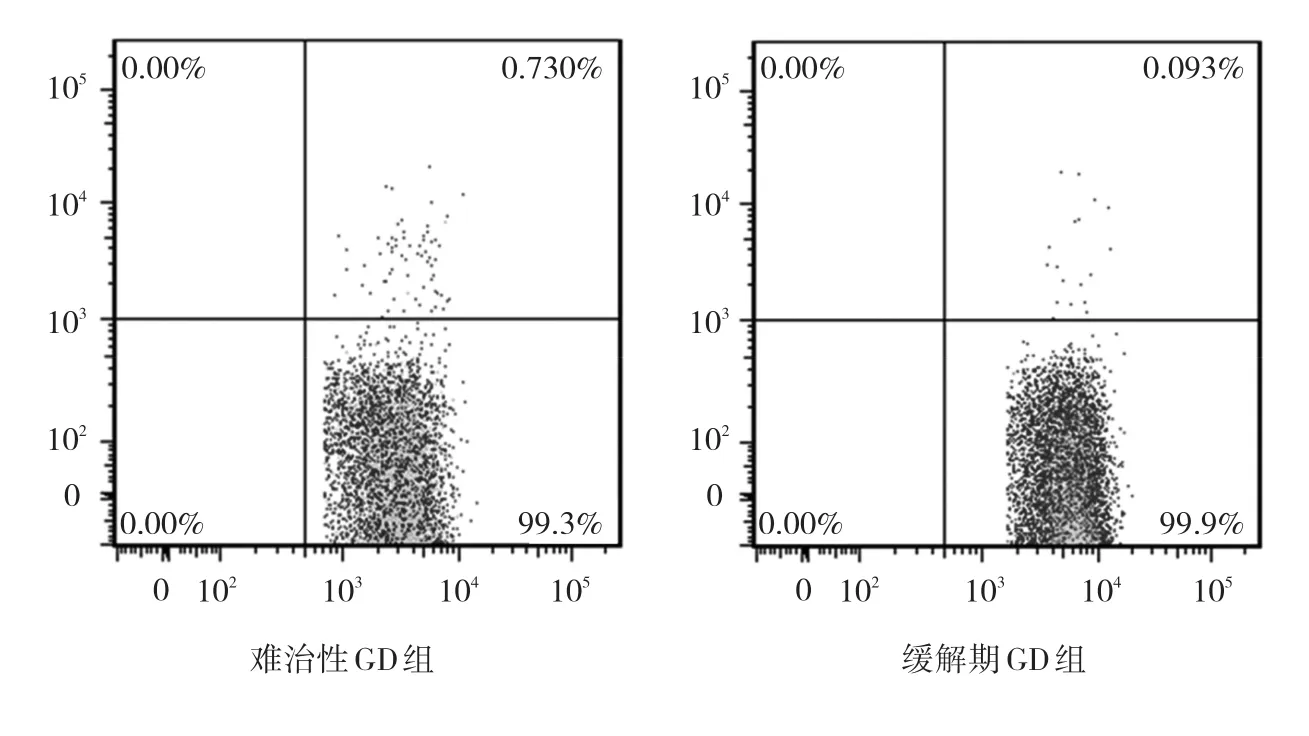
图2 两组患者外周血Th17细胞流式分析图比较

图3 两组患者外周血Treg细胞流式分析图比较
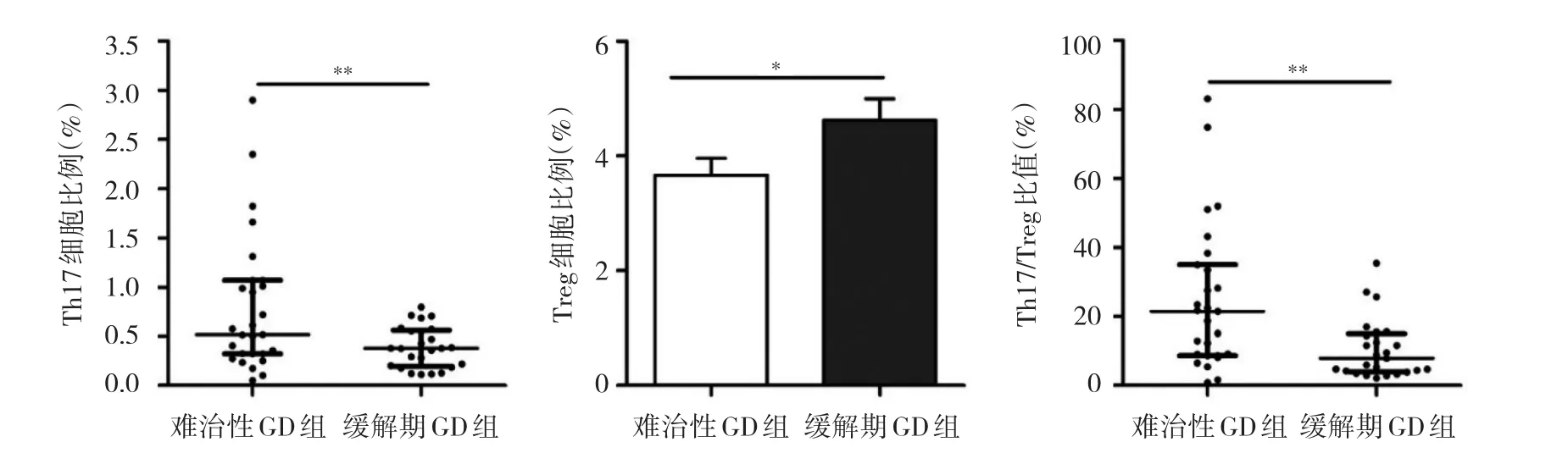
图4 两组患者外周血Th17、Treg细胞比例及Th17/Treg比值比较
2.3 两组GD患者血浆相关细胞因子水平比较 相较于缓解期GD组患者,难治性GD组患者外周血中IL-17A、IL-6、TGF-β1、IL-1β 及 IL-10的表达水平均增高,差异均有统计学意义(均P<0.05);但IL-23和TNF-α表达差异均无统计学意义(均P>0.05),见表1。

表1 两组GD患者血浆相关细胞因子水平比较(pg/ml)
3 讨论
目前难治性GD的确切发病机制尚未完全阐明。本研究通过转录组测序技术筛选了难治性和缓解期GD患者PBMC中显著性变化的差异表达基因。通过KEGG富集分析发现,难治性GD患者PBMC中表达显著上调的基因,主要在与Th17细胞分化及其效应细胞因子IL-17作用相关的信号通路富集。GO分析显示,难治性GD患者表达上调的基因主要通过影响细胞因子、趋化因子的分子功能,参与了炎症和趋化相关的生物学过程。以上结果提示,Th17细胞的过度分化及其下游效应因子的功能紊乱可能与GD的难治性密切相关。
既往研究表明,T淋巴细胞是自身免疫性甲状腺疾病发病的重要参与因素[1]。Th17是CD4+T细胞的一种,其主要效应因子IL-17与受体结合后可以激活下游MAPK和NF-κB等炎症信号转导通路,促进炎症因子、趋化因子以及黏附分子的大量分泌,参与多种炎症反应和自身免疫疾病的发生、发展。相反,Treg细胞是维持外周免疫耐受和机体免疫平衡的关键性CD4+T细胞亚群[6]。事实上,Th17细胞和Treg细胞分化都需要TGF-β介导的信号通路来起始,在IL-6或IL-21同时存在的条件下,原始CD4+T细胞分化为Th17细胞;而在缺乏促炎细胞因子的情况下,TGF-β则促使其分化成Treg细胞[7]。现在越来越多的证据表明Th17、Treg细胞失衡在类风湿性关节炎、银屑病、多发性硬化和炎症性肠病等多种自身免疫性疾病中起着至关重要的作用[8-10]。但是,目前Th17、Treg细胞平衡与难治性GD关系的研究甚少。因此,本研究进一步检测了难治性和缓解期GD患者外周血中Th17和Treg细胞比例。结果显示,相较于缓解期GD组,难治性GD组患者外周血中Th17细胞比例升高,而Treg细胞比例降低,Th17/Treg比值也增高,说明Th17、Treg的平衡失调与GD的难治性密切相关。
本研究进一步检测了难治性和缓解期GD患者血浆中相关下游效应细胞因子的表达水平。结果显示,难治性GD组血浆中IL-17A、IL-6、TGF-β1、IL-1β及IL-10的表达水平高于缓解期GD组。IL-17A是Th17细胞最主要的效应因子,之前的细胞实验发现,甲状腺组织中存在功能性IL-17受体的表达,IL-17A与其结合可以促进甲状腺细胞合成和分泌IL-6以及其他趋化因子、细胞间黏附因子[5]。此外,IL-17A还可以促进前体树突状细胞的分化和成熟,从而持续刺激T细胞活化增殖,产生IL-4、IL-10等细胞因子促进B细胞成熟并分泌自身抗体。同时在对类风湿性关节炎等慢性炎症疾病的研究中发现,IL-17A可以促进炎性细胞的活化,并诱导IL-1β等炎性细胞因子的释放。IL-6具有刺激B细胞活化产生自身抗体、促进T细胞增殖以及细胞毒性T淋巴细胞活化等多重免疫调节功能。之前的研究发现,IL-17和TRAb均可促进甲状腺细胞合成分泌IL-6,而IL-6可以进一步刺激B细胞分化成熟,增加甲状腺自身抗体的产生[5,11]。此外,IL-6还能与TGF-β一起诱导Th17细胞的分化,从而形成正反馈调节,加剧甲状腺局部的自身免疫炎症反应。早期有研究发现,难治性GD患者血清中IL-10的表达水平显著增高[12]。IL-10可以刺激IgG向IgG3亚型的转换[13],而多因素logistic回归分析显示,血清IgG3/IgG比值是难治性GD的独立影响因素[14]。基因研究发现,难治性GD患者IL-1β基因-31位点的T等位基因携带频率显著高于缓解期GD患者,该等位基因携带者IL-1β合成增加[15],而IL-1β又可以促进Th17细胞的分化和增殖,形成正反馈调节。
综上所述,增高的IL-17A可以促进IL-6、IL-1β以及IL-10等细胞因子的表达,笔者推测这些因子之间可能通过相互作用,形成一个多效性的功能网络,或通过刺激B细胞分化成熟,进一步增加甲状腺内自身抗体的产生;或增强其他炎性细胞因子的功能,诱导持续的自身免疫反应;或能反过来促进Th17细胞的分化和增殖,形成正反馈调节,诱导甲状腺局部持续的自身免疫炎性反应,从而导致难治性GD的发生。因此,Th17、Treg平衡失调以及下游相关效应细胞因子的免疫紊乱与GD的难治性密切相关,Th17、Treg细胞平衡可能是难治性GD免疫治疗的新型有效靶点。
