颈部淋巴结转移的局部早期下咽鳞状细胞癌(T1/2N+)治疗模式及预后分析:来源于SEER数据库的结果*
2022-09-01迪力纳尔吾斯曼黄泽浩张溪微李正江刘绍严安常明
迪力纳尔·吾斯曼,黄泽浩,张溪微,李正江,刘绍严,安常明
100021北京,国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院 头颈外科
头颈部鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)起源于上皮细胞,是全球第八大常见癌症[1]。下咽鳞状细胞癌(hypopharyngeal squamous cell carcinoma,HPSCC)是较少见的HNSCC,发病率仅占HNSCC的3%[2]。下咽的解剖包含梨状窝、下咽后壁和环后区3个主要结构,其中梨状窝部位的肿瘤患者比例最高(72%),其次是环后区(18%)和下咽后壁(10%)[3]。由于该部位的解剖位置与气道、声门及食管关系密切,常影响到吞咽及发音功能,患者生活质量极差。近年来下咽癌发病率有所提高,2020年全球下咽癌新发病例有84 254例,死亡病例约有38 599例[4],且HPSCC的总体5年生存率仅为25.1%[5]。既往研究结果提示年龄、T分期、N分期、下咽后壁部位下咽癌、未对原发肿瘤进行手术治疗、更多转移部位等因素与各分期下咽癌患者的预后相关[6],早期和晚期下咽癌的瘤内异质性使不经分组的所有分期患者预后分析的准确性降低[7],而早期HPSCC预后预测相关研究较少。SEER数据库是目前最大的公开可用癌症数据库,约覆盖美国人口的28%,包含人口统计和癌症特征的数据。具有多中心、大样本的SEER数据库对局部早期下咽癌患者的治疗模式分析及预后预测具有重要价值。本研究基于SEER数据库回顾性分析颈部淋巴结转移的局部早期(T1/2)HPSCC不同治疗模式的生存率及相关预后因素,并建立列线图模型为其个体化治疗提供参考,以期提高生存率。
1 资料和方法
1.1 数据来源
使用SEER*Stat软件(V8.3.9.2)(https://seer.cancer.gov/),从SEER数据库中搜索并下载2004年至2015年HPSCC患者的数据资料,检索代码为:“Primary Site:C12.9-13.2,C13.8-C13.9;ICDO-3:8052,8070-8076,8078,8083,8084,8086,8094”。纳入标准:1)肿瘤原发部位为下咽部;2)组织病理类型为鳞状细胞癌;3)依据美国癌症联合委员会(American Joint Committee on Cancer,AJCC)第6版分期指南标准,具有TNM分期,且AJCC分期为T1或T2,N+,M0;4)具有完整的随访数据。排除标准:1)排除非第一原发癌;2)临床病理信息不完整,包括肿瘤部位,治疗模式等;3)排除死亡原因未知,失访或随访时间为0个月的病例。纳入临床病理因素包括:年龄、性别、T分期、N分期、肿瘤部位、是否手术、是否放疗、是否化疗、生存状态和生存时间。研究主要终点为总生存率(overall survival,OS)和肿瘤特异性生存率(cancer-specific survival,CSS)。OS定义为诊断至随访截止或任何病因死亡的时长(月),CSS定义为诊断至随访截止或因肿瘤死亡的时长(月)。非肿瘤相关死亡和失访患者数据作为删失数据。
1.2 统计学方法
采用单因素和多因素Cox回归分析筛选影响疾病预后的独立危险因素,基于多因素Cox回归模型,使用R软件构建患者OS和CSS的预后列线图。采用一致性指数(C-index)、校准曲线分别对OS和CSS的列线图的预测能力进行验证;采用受试者工作特征(receiver operating characteristic,ROC)曲线校准曲线指数作为模型评价指标评价列线图。采用Kaplan-Meier绘制生存曲线,Log-rank法比较组间差异。数据分析由R 4.1.0软件rms,glmnet,survival,timeROC等软件包分析完成。P<0.05差异有统计学意义。
2 结 果
2.1 HPSCC患者临床病理特征
本研究筛选数据的流程见图1。从SEER数据库中提取诊断为HPSCC患者的临床病理信息和随访资料,根据纳入和排除标准,严格筛选后共纳入局部早期下咽鳞状细胞癌(T1/2N+)患者1 168例。男女比例为4.46∶1,年龄23~94岁,中位年龄为62岁。中位OS为39个月,中位CSS为73个月,最常见的肿瘤部位是梨状窝(58.1%)。手术治疗的患者有187例(16.0%),其中全喉手术仅有27例(2.3%),接受化疗的患者有917例(78.5%),接受放疗的患者有1 043例(89.3%)。基本临床信息见表1。
图1 数据筛选流程图Figure 1.Flow of the Screening and Selection Process

表1 局部早期HPSCC(T1/2N+)患者临床病理特征Table 1. Clinicopathological Characteristics of Patients with Early-stage HPSCC and Lymph Node Metastasis(T1/2N+)
2.2 单因素及多因素Cox回归分析
单因素Cox回归分析显示,HPSCC患者的年龄、T分期、N分期、是否手术、是否放疗、是否化疗以及治疗模式与OS相关(P<0.05),这些变量被纳入构建多因素Cox比例风险回归模型,多因素Cox回归分析显示,年龄、T分期、N分期、是否手术、是否放疗以及是否化疗是影响HPSCC患者OS的独立危险因素,且年龄大、T2期、N3期、未手术、未放疗及未化疗与更差的预后相关。采用单因素Cox回归分析显示,HPSCC患者的年龄、肿瘤部位、T分期、N分期、是否手术、是否放疗、是否化疗以及治疗模式与CSS相关(P<0.05),多因素Cox回归分析显示,年龄、肿瘤部位、T分期、N分期、是否手术、是否放疗以及是否化疗是影响HPSCC患者CSS的独立危险因素,且年龄大、环后区、T2期、N3期、未手术、未放疗及未化疗与更差的预后相关(表2)。

表2 OS及CSS的单因素及多因素Cox回归分析Table 2. Univariate and Multivariate Cox hazard Analyses of Factors Affecting OS and CSS
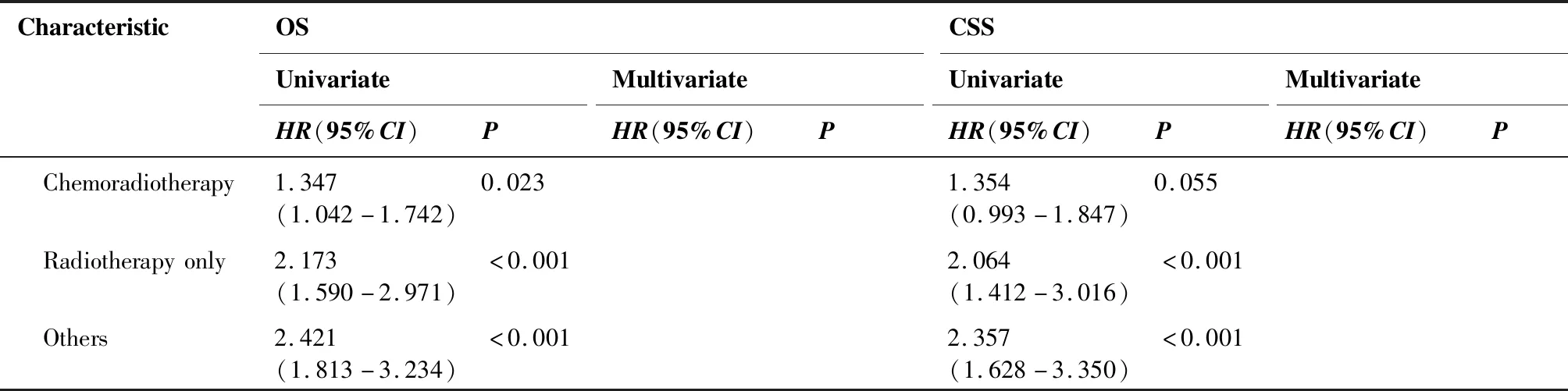
CharacteristicOSCSSUnivariateMultivariateUnivariateMultivariateHR(95%CI)PHR(95%CI)PHR(95%CI)PHR(95%CI)P Chemoradiotherapy1.347(1.042-1.742)0.0231.354(0.993-1.847)0.055 Radiotherapyonly2.173(1.590-2.971)<0.0012.064(1.412-3.016)<0.001 Others2.421(1.813-3.234)<0.0012.357(1.628-3.350)<0.001
2.3 列线图模型的构建
将上述与HPSCC相关的独立危险因素,包括患者的年龄、T分期、N分期、是否手术、是否放疗以及是否化疗,用于构建OS的列线图。构建CSS的列线图则使用患者的年龄、肿瘤部位、T分期、N分期、是否手术、是否放疗以及是否化疗。结果显示N分期和是否放疗是患者OS的主要影响因素,肿瘤部位和N分期是患者CSS的主要影响因素,列线图是根据回归模型中各个影响因素对结局变量的贡献程度,对每个影响因素的每个取值水平进行赋值,然后再将各个评分相加得到总评分,对应下方可以预测到疾病的2年、3年及5年生存率(图2)。

图2 HPSCC患者OS及CSS的列线图预测模型Figure 2.Nomograms of OS and CSS of Local Early-stage HPSCC Patients (T1/2N+)A.Nomogram of OS;B.Nomogram of CSSOS:Overall survival;CSS:Cancer-specific survival;HPSCC:Hypopharyngeal Squamous Cell Carcinoma.
2.4 列线图模型评价
使用R软件计算得出OS和CSS的C-index分别为0.618和0.629,表明预测模型具有一定准确度,预测结果可信。ROC曲线显示,OS的2、3、5年的AUC分别为0.656、0.639、0.615,CSS的2、3、5年的AUC分别为0.657、0.635、0.623,表明预测模型具有敏感性和特异性(图3A、B)。进一步绘制校准图评估建立的模型预测HPSCC发生发展的准确性,列线图预测HPSCC患者的2年、3年以及5年生存率与实际的2年、3年以及5年生存率具有一定的一致性,校准曲线横坐标0~1表示发生可能性是0%~100%,纵坐标表示实际概率,即患者实际疾病发生率,图3C、D表明该预测模型准确可信。

图3 HPSCC患者的ROC曲线及校准曲线Figure 3.ROC and Calibration Curves for Local Early-stage HPSCC Patients (T1/2N+)A.ROC curves of OS;B.ROC curves of CSS;C.Calibration plot of OS;D.Calibration plot of CSSHPSCC:Hypopharyngeal Squamous Cell Carcinoma;ROC:Receiver Operating Characteristic;OS:Overall survival;CSS:Cancer-specific survival.
2.5 生存分析
患者3年和5年OS率分别为51.4%、41.5%,3年和5年CSS率分别为60.3%、53.8%。Kaplan-Meier生存分析结果显示,手术联合放化疗患者的OS和CSS均较单纯放疗患者高(P<0.001,图4A、B)。全喉手术患者与其他治疗模式患者的总生存率相比差异无统计学意义,分析比较非全喉手术与其他治疗方案的生存率时,发现差异有统计学意义(P=0.012),非全喉手术OS率更高。根据是否应用手术或者化疗进行亚组分析,发现手术能明显改善T1分期肿瘤患者的OS(P=0.046,图4C),N1及N2分期的患者使用化疗与更好的OS及CSS相关(P<0.01,图4D、E)。

图4 HPSCC患者的Kaplan-Meier分析及亚组分析Figure 4.Kaplan-Meier Analysis and Subgroup Analysis for Local Early HPSCC Patients (T1/2N+)A.Kaplan-Meier Analysis of OS;B.Kaplan-Meier Analysis of CSS;C.Kaplan-Meier analysis of OS by surgery;D.Kaplan-Meier analysis of OS by chemotherapy;E.Kaplan-Meier analysis of CSS by chemotherapyAbbreviations as indicated in Figure 3.
3 讨 论
下咽癌的治疗方法包括手术、放疗、化疗、靶向及免疫治疗等[8]。对于晚期下咽癌,各指南就如何选择手术、诱导化疗或者同步放化疗存在分歧,相关研究较多[9-10]。根据2021年中国临床肿瘤学会指南,早期下咽癌应采用手术或单纯放疗的单一治疗模式,二者总体疗效相近,然而对于局部早期(T1/2)伴淋巴结转移的患者,因无论首选手术或放疗一般都可保留喉功能,因此分歧较大。
本研究中,我们首先分析了局部早期HPSCC患者的预后影响因素。与之前的报道一致[11],环后区肿瘤是影响患者预后的独立危险因素。环后区肿瘤较少见,由于其症状不明确,位置特殊,发现时多出现在晚期,淋巴结转移率较高,因此预后更差[12]。曹轶倓等[13]发现,不同解剖亚区的肿瘤患者预后有差异(P<0.001),其中梨状窝部位肿瘤患者5年OS率为50.6%,环后区部位肿瘤患者5年OS率最低为27.4%。另外本研究发现年龄是重要的预后影响因素,年龄≥60岁与预后不良相关,可能原因是老年患者往往合并症更多,且倾向于接受更保守的治疗,因此生存率可能更低。
保喉治疗是国外下咽癌治疗的热点,因此本研究中绝大部分患者(84.0%)未接受手术治疗。虽然仅有187例(16.0%)患者进行手术治疗,但是手术患者较非手术患者有较高的总体生存率(HR:0.801,95%CI:0.663-0.969,P=0.022),该结果与基于美国国家癌症数据库的研究结果一致[14],该研究表明手术联合辅助治疗(辅助放疗或化疗)相比联合放化疗预后更好(HR:0.72,95%CI:0.64~0.80,P<0.001),手术的综合治疗使患者收益。另外一项包含6 647例下咽癌患者的回顾性综述研究发现,联合手术及放疗的患者有最高的总生存率(48.5%)[15],也有研究表明局部晚期下咽癌手术治疗可提高患者的生存质量[16]。以上结果提示,对于可切除而能保喉的下咽癌患者,手术仍然是更好的选择。
早期下咽癌可采用保留喉功能的手术治疗,有研究表明保喉手术不缩短生存时间,采取适当的切除范围,选择合适的修复方式有利于患者获得良好的喉及下咽功能,提高生存质量[17]。徐伟等[18]的研究发现喉功能保留与不保留组相比生存率更高(P=0.021),本研究中全喉手术比例较低,仅有27例(2.3%),这和原发肿瘤较小及非手术治疗患者比例高有关,绝大部分患者可以保留喉功能,而且全喉手术患者与其他治疗模式患者的总生存率相比差异无统计学意义,因此应当谨慎对待这类患者的器官切除。而分析比较非全喉手术与其他治疗方案的生存率时,发现差异有统计学意义(P=0.012),非全喉手术OS率更高。亚组分析发现手术能明显改善T1分期肿瘤患者的OS(P=0.046),而不能明显改善T2分期肿瘤患者的OS,进一步分析发现原因可能是T2分期肿瘤患者中有24例为全喉手术。也就是说针对伴淋巴结转移的T1或T2期HPSCC患者,保留喉咽功能的手术模式更有利于改善生存。总之保喉手术治疗应进行完整的术前评估,制定个体化的综合治疗方案[19]。
本研究发现,在美国放化疗为最常见的治疗方式(65.0%),其次是单纯放疗(10.2%)以及手术联合放化疗(9.7%),其中化疗的患者较未化疗的患者生存率更高,差异有统计学意义(78.5%vs21.5%,P<0.001),这可能和肿瘤转移性强有关,局部早期病变即可出现颈部淋巴结转移,化疗后可能降低其转移风险。一项Meta分析表明与单纯放疗相比,同步放化疗可实现更高的局部控制率并提高生存率[20]。而另一项研究在同步放化疗前加用诱导化疗,较单纯同步放化疗提高晚期下咽癌的生存率[21]。陶磊等[22]分析2003~2007年与2010~2014年2个5年间收治的下咽癌患者生存预后改变时发现,后5年组诱导化疗的应用率显著增高,这在提高喉功能保留率的同时,提高了局部晚期患者的生存率。对于本研究入组的患者,特别是N1、N2患者加用化疗明显改善预后,同时应考虑诱导化疗在这部分患者可能获得的效益。
本研究表明,各治疗模式比较中,手术联合放化疗的生存率相较于其他治疗模式更高,尤其是与单纯放疗相比差异有统计学意义,程翠等[23]的研究发现手术联合放化疗组与放化疗组的晚期下咽癌患者OS率相比差异有统计学意义,与Garneau等[24]的研究结果一致,说明手术联合放化疗可在一定程度上改善患者的生存。由于下咽癌发病率低,大多数研究和临床试验同时纳入喉部和下咽部原发性肿瘤患者,然而喉癌和下咽癌之间可能存在治疗方式选择及治疗效果的差异,缺乏仅针对下咽癌患者的临床试验数据。
本研究通过SEER数据库得到HPSCC的独立危险因素后,基于肿瘤患者年龄、T分期、N分期、是否手术、是否放疗及是否化疗,首次构建了一个针对局部早期HPSCC(T1/2N+)的列线图预测模型。本研究建立的列线图预测模型能够通过整合不同临床特征对应的评分,进而得到终点事件的概率,该列线图将帮助临床医生做出更好的临床决策并为患者提供后续监测。
本研究有一定的局限性,首先SEER数据库中一些重要信息不完整,如颈淋巴结清扫状况、病理切除边缘、生物标志物检测结果等病史;其次无法获取放疗的具体信息,如每日剂量、辐射场参数、总剂量及是否术后同步放化疗等;无法获取关于化疗方式、化疗药物类型或剂量的详细信息,例如是否诱导化疗、同步化疗或辅助化疗,这可能导致信息偏差并可能影响变量的HR值;未能获得肿瘤组织HPV状态来分析HPV感染对治疗方式及生存的影响;最后,本研究排除了一些随访缺失的病例,可能导致预测结果的偏差。
综上所述,本研究利用SEER数据库进行回顾性分析,发现年龄、T分期、N分期、各治疗方式是影响HPSCC患者生存率的独立危险因素,手术联合放化疗治疗局部早期下咽鳞状细胞癌(T1/2N+)可改善患者OS率及CSS率。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
doi:10.3322/caac.21731.
