镉胁迫对小麦光合特性和根际土壤酶活性的影响
2022-09-01郭晖
郭 晖
(新乡学院生命科学与基础医学学院,河南 新乡 453003)
镉(Cd)是一种具有迁移性差、富集性高、毒性强且不易被分解等特点的重金属污染物,具有很强致癌性,被列为Ⅰ类致癌物。2014年4月发布的《全国土壤污染状况调查公报》显示,我国Cd的点位超标率达到7.0%,Cd污染耕地面积超过20万hm2,是我国分布范围最广的土壤重金属污染物。Cd流入土壤之后对土壤微生物代谢和养分供应能力造成严重损害[1]。据统计,我国每年受到重金属污染的粮食达1200万t,粮食产量减少达100万t,导致直接经济损失至少200亿元[2]。此外,Cd的环境承载容量较小,易被植物吸收,在植物中积累的浓度越高,对植物的伤害就越大。一些主要农作物,尤其是小麦、水稻等对Cd的积累能力很强,从而通过食物链进入人体,损害人体健康。
小麦不仅是全世界最受重视的粮食农作物之一,同时也是我国第2大粮食农作物,其品质和产量直接关系着世界粮食安全和国民生活水平。但是部分地区农田面临严重的Cd污染,频繁出现小麦Cd超标现象,造成小麦产量下滑,严重影响了小麦产量和粮食安全[3]。有研究表明,Cd能显著降低小麦种子发芽率,且随着镉含量的增加,小麦的发芽率呈下降趋势[4]。另外,Cd对小麦的生长有一定的抑制作用,且随着镉浓度的增大,其抑制作用越强[5]。
植物生长所需有机物主要来源于光合作用产物,另外土壤质量和土壤肥力也是影响植物生长的重要因素。因此,本试验通过研究不同浓度Cd胁迫对小麦光合特性和根际土壤酶活性的影响,探讨Cd污染对小麦生产的影响机制,为进一步采取措施减轻Cd污染对小麦生产的影响提供依据。
1 材料和方法
1.1 试验材料
供试小麦品种为“矮抗58”,由西北农林科技大学农学院提供。
1.2 试验设计
采用土培法试验,所用土壤经自然风干后磨碎,于高压灭菌锅中经蒸汽灭菌后装入盆栽容器,每盆装10kg。制备Cd2+浓度梯度为0mg·L-1、50mg·L-1、100mg·L-1、200mg·L-1的CdCl2溶液,取1L溶液加入各盆,模拟Cd含量为0mg·kg-1、5mg·kg-1、10mg·kg-1、20mg·kg-1的污染土壤,平衡3个月后备用,分别记作Cd0、Cd5、Cd10、Cd20,每个处理5个重复。
选取籽粒饱满的小麦种子于5% H2O2中消毒20min,用蒸馏水洗净后播种到每个盆中,出苗后控制每盆9株幼苗,所有盆钵随机放置。待小麦长出3枚真叶后,定期补充1/4 Hoagland营养液以保证营养供应充足,采用称重-浇水法维持土壤水分,同时防治病虫害。种子于10月上旬播种,于旗叶完全抽出后进行各类指标的测定。
1.3 光合指标测定
主要测定比叶重、叶绿素含量和净光合速率Pn。叶绿素含量采用95%乙醇提取,使用分光光度计测定。Pn使用Li-6400XT便携式光合作用测定系统测定,测定时间为晴天9∶00—11∶00。
1.4 根际土壤酶活性测定
主要测定土壤蔗糖酶(S-SC)、过氧化氢酶(S-CAT)和脲酶(S-UE)、脱氢酶(S-DHA)活性。其中,S-SC活性采用3,5-二硝基水杨酸法测定,S-CAT活性采用H2O2还原法测定,S-UE活性采用靛酚蓝比色法测定,S-DHA活性采用2,3,5-氯化三苯基四氮唑还原法测定。以上所有土壤酶均使用试剂盒(Solarbio)测定。
1.5 数据分析
试验数据均采用软件Excel进行简单计算、数据整理和绘图,采用R软件来进行方差分析和多重比较。
2 结果与分析
2.1 Cd胁迫对小麦比叶重的影响
由结果可知,Cd胁迫可显著降低小麦比叶重,且随着Cd浓度增大,比叶重降低越明显,见图1。比叶重在Cd0处理下最大,为4.18±0.12mg·cm-2,在Cd5处理下略微下降,为4.04±0.22mg·cm-2,但在这2个处理水平下差异不显著,说明Cd5的胁迫水平未对比叶重造成显著影响。比叶重从Cd10开始显著下降,Cd10处理下比叶重为3.45±0.13mg·cm-2,比Cd0降低了17.56%。Cd20处理下比叶重最小,为3.16±0.08mg·cm-2,显著低于其他处理,比Cd0、Cd5、Cd10分别降低了24.45%、21.79%、8.36%。
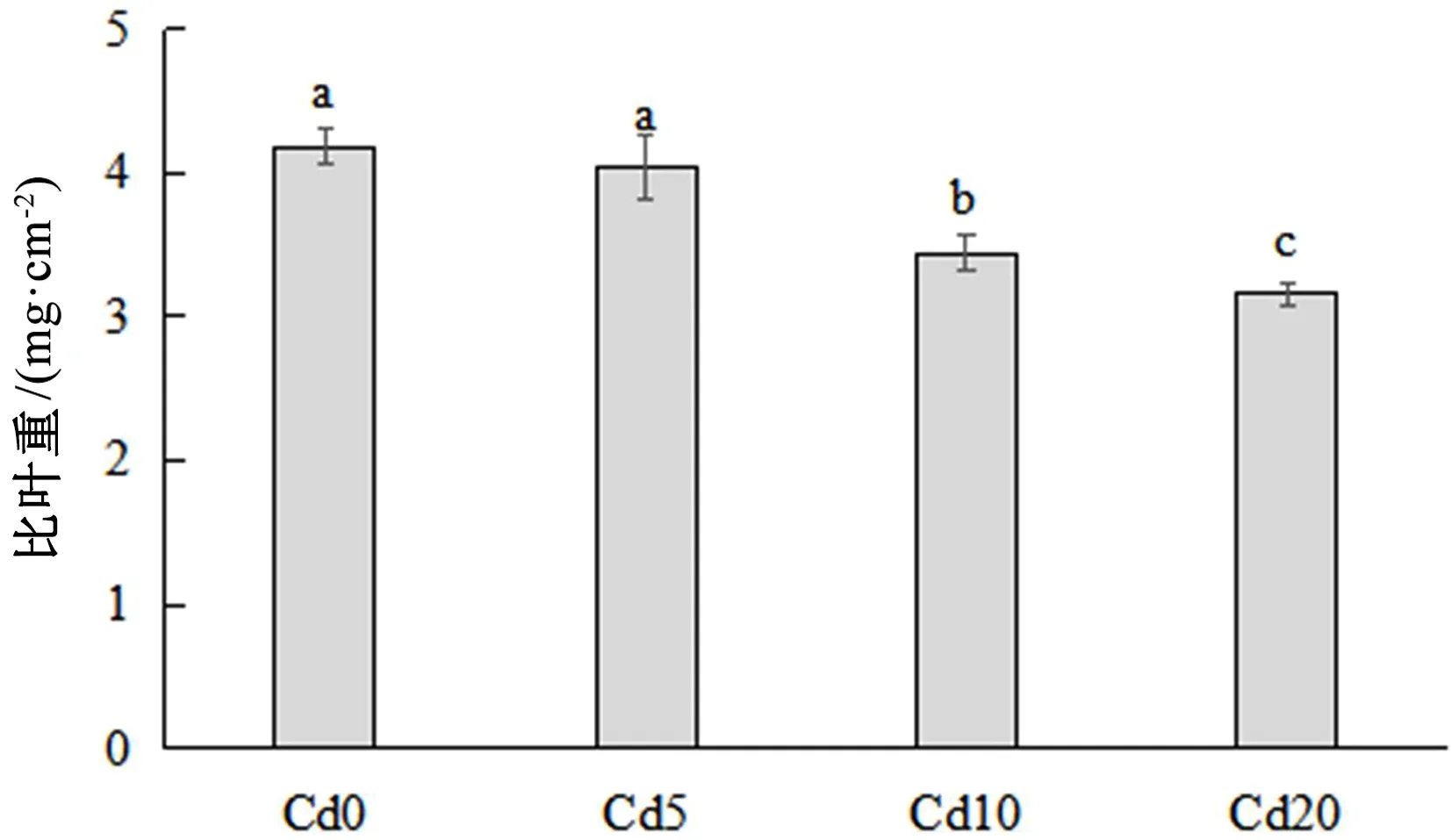
图1 Cd胁迫下小麦比叶重注:相同小写字母表示在0.05水平上差异不显著,不同小写字母表示差异显著;下同。
2.2 Cd胁迫对小麦叶绿素含量的影响
Cd胁迫下小麦叶绿素含量见表1。叶绿素a含量随Cd浓度增加而呈降低趋势。Cd0处理下叶绿素a含量最大,但与Cd5差异不显著。Cd20处理下叶绿素a含量最小,但与Cd10差异不显著。Cd10和Cd20处理下叶绿素a含量显著低于Cd0和Cd5,其中Cd10处理下比Cd0、Cd5分别降低了18.49%、14.17%,Cd20处理下比Cd0、Cd5分别降低了23.16%、19.08%。叶绿素b含量同样随Cd浓度增大而减小,但是不同处理间差异显著性与叶绿素a不同。Cd0下叶绿素b含量最高,显著高于其他处理。Cd5和Cd10处理下叶绿素含量差异不显著,二者显著低于Cd0,比Cd0分别降低了9.28%、21.60%。Cd20处理下叶绿素含量显著低于Cd0和Cd5,但与Cd10差异不显著,比Cd0、Cd5分别降低了24.32%、16.58%。

表1 Cd胁迫下小麦叶绿素含量
2.3 Cd胁迫对小麦净光合速率的影响
Cd胁迫下小麦净光合速率随着Cd浓度增大而减小,且变化规律与叶绿素a相同,见图2。净光合速率在Cd0处理下最大,达到27.48±2.15μmol·m-2·s-1,在Cd5处理下略微下降,为26.49±2.31μmol·m-2·s-1,但二者之间差异未达到显著水平。净光合速率在Cd10处理下降至22.76±2.52μmol·m-2·s-1,显著低于Cd0和Cd5,比Cd0、Cd5分别降低了17.17%、14.08%。Cd20处理下净光合速率最小,仅20.04±2.17μmol·m-2·s-1,与Cd10差异不显著,但显著低于Cd0和Cd5,比Cd0、Cd5分别降低了27.07%、24.35%。

图2 Cd胁迫下小麦净光合速率
2.4 Cd胁迫对小麦根际土壤酶活性的影响
Cd胁迫下小麦根际土壤酶活性均随Cd浓度增大而减小,见表2。S-SC活性和S-CAT活性变化趋势相同,均在Cd0处理下最大,在Cd5、Cd10处理下有所下降,但3个处理间差异不显著。在Cd20处理下最小,显著低于Cd0和Cd5。Cd20处理下,S-SC活性比Cd0、Cd5分别下降了57.29%、50.36%,S-CAT活性比Cd0、Cd5分别下降了48.66%、45.30%。

表2 Cd胁迫下小麦根际土壤酶活性
S-UE活性在Cd0处理下最大,显著高于其他处理。Cd5和Cd10处理下S-UE活性开始显著下降,分别比Cd0下降了27.48%、44.49%,但这2个处理之间差异不显著。S-UE活性在Cd20处理下最小,显著低于Cd0和Cd5,比Cd0和Cd5分别下降了57.74%、41.73%。
S-DHA活性在Cd0处理下最大,在Cd5处理下有所下降,但未达到显著水平。在Cd10处理下,S-DHA活性显著低于Cd0,比Cd0下降了41.67%,略低于Cd5,但二者之间的差异未达到显著水平。在Cd20处理下最小,显著低于Cd0和Cd5,比Cd0、Cd5别降低了54.63%、43.02%,但与Cd10的差异未达到显著水平。
3 讨论
Cd作为毒性最大的重金属之一,其在植物体内积累的含量超标会引起不同组织和器官的毒害症状,抑制植物生长和发育。研究表明,植物受到Cd毒害后会造成植物根系活力的减弱、植物体内氧化还原失衡、植物光合能力降低,从而使植物根系生长受阻以及减弱对矿物质元素的吸收,致使植物出现生长不良的形态特征,严重者可导致植物死亡[6]。
3.1 Cd胁迫对植物光合作用的影响
植物进行光合作用是一个高度自我调节的过程。比叶重指植物叶片所积累的有机物的量,其一定程度上可反映植物光合作用合成同化物的能力。已有研究显示,植物光合作用的能力与其叶片比叶重之间存在一定的联系,在一定范围内随着比叶重的增加,植物光合能力也增加[7]。叶绿体是植物叶片进行光的吸收、传递和转化的场所,且叶绿素在一定程度上可以作为在某种环境胁迫下植物光合能力强弱的重要指标。较高浓度的Cd污染会造成叶绿素含量降低、叶绿体膨胀和变形,从而影响光合作用[8]。本研究显示,在不同土壤Cd含量下,小麦叶片比叶重和叶绿素含量有不同程度的增加或降低,低含量Cd对小麦叶片比叶重和叶绿素合成影响程度较弱,高含量Cd则影响较为显著。这与于永昂等[9]的研究结果相类似,其研究显示,在不同浓度的Cd胁迫下,小麦叶片叶绿素含量出现不同程度的减少,尤其是高浓度Cd胁迫下,小麦的光合能力受到严重影响,抑制了小麦的生长发育。导致此结果的原因可能是小麦处于Cd胁迫的环境中,吸收了较多的Cd2+,间接引起叶绿体形态及结构发生改变[8],从而导致叶绿体功能紊乱,最终叶绿素含量下降。除了比叶重和叶绿素含量,植物光合速率还受到其他多种因素的影响。Cd通过影响植物对与其光合作用有关的元素的吸收和转运、植物叶片气孔开闭程度、电子传递等来削弱植物的光合能力[8]。本研究发现,在不同土壤Cd含量下,小麦叶片净光合速率呈现出不同程度的降低趋势,尤其是在高浓度Cd胁迫下,净光合速率下降较为显著,表明高含量Cd对小麦的光合作用的抑制更为强烈。在Cd浓度较高的环境下,植物叶片气孔导度、蒸腾速率和净光合速率均显著下降[10],进一步证明了Cd可通过影响植物气孔的开闭程度进而影响光合作用。本研究中Cd胁迫下小麦净光合作用速率降低可能是由Cd胁迫下叶片组织改变、叶绿体功能失常、叶绿素含量下降、气孔张开程度减小等原因共同导致。
3.2 Cd胁迫对土壤酶活性的影响
土壤酶对土壤中的生化反应起催化作用,是土壤中具备生理活性的酶类总称。土壤酶是土壤生态系统的核心,主要为土壤中微生物、动物和植物根系的分泌物,参与有机质分解、土壤微生物能量和营养获取、污染物降解等重要生态过程。其中土壤蔗糖酶活性能反映土壤熟化程度与肥力水平,土壤过氧化氢酶可用来表征土壤的生化活性,土壤脲酶直接参与土壤有机态氮的转化状态,土壤脱氢酶参与有机物的降解。土壤酶活性可以快速反映土壤质量的演变,促进土壤代谢过程,从而促进植物的生长发育,是评价土壤质量和肥力的重要辅助指标[11]。土壤酶活性易受到植被类型、施肥系统和根系分泌物等环境因素的影响,对生态环境的变化非常敏感。本研究发现,4种土壤酶活性总体随Cd浓度的增加呈降低趋势,在Cd20时降幅最大,S-SC、S-CAT、S-UE、S-DHA活性比Cd0分别下降了57.29%、48.66%、57.74%、54.63%,可能是由于Cd污染对土壤微生物、植物根系的产生了毒害,导致分泌物减少,降低了土壤酶活性。
3.3 缓解Cd毒害可采取的措施
本研究发现,小麦光合能力和根际土壤酶活性随着Cd浓度增高呈减低趋势,表明Cd胁迫严重影响了小麦光合作用、土壤质量和肥力,因此在修复Cd污染土壤时,可通过采取措施提高作物光合能力、土壤酶活性。丛枝菌根真菌arbuscular mycorrhizal fungi,AMF)能够与陆地上绝大多数植物根系形成AM共生体,进而对宿主植物产生多种积极效应,其中最基本的效应就是缓解逆境胁迫,增强植物的抗逆能力,包括重金属、盐碱、干旱、病害、涝害和寒害等[12]。研究表明,接种AMF可显著增加作物的株高、叶长和生物量,接种根内球囊霉菌(Glomus intraradices)和摩西球囊霉菌(Glomus mosseae)使得植物的净光合速率分别提高51.01%、54.36%[13]。AMF还能提高土壤酶活性,罗方舟等研究发现,接种摩西球囊霉菌使旱稻根际土壤脲酶及蔗糖酶活性显著提高,提高幅度为9.6%~44.5%,从而促进根际土壤碳素和氮素循环,并显著提高旱稻根系、地上部和籽粒的生物量[14]。此外,施用生物炭可以改善地下根系和地上茎叶形态,改善叶片光合和根系对水分和矿质元素的吸收能力,土壤中添加量为50g·kg-1生物炭可使叶片叶绿素含量和净光合速率分别提高21.01%和167%,从而促进作物生物量的积累,为后期产量的形成奠定基础[15]。另有研究表明,生物炭在制备过程中,植物生物质原料蜂窝状结构构成的大孔以及热解过程中碳的损失及碳架断裂收缩形成的微孔共同构成了疏松多孔的结构,不仅使其具有强的吸附和固定重金属能力,而且为土壤微生物提供了良好的栖息环境,有利于微生物活动,提高微生物生物量和土壤酶活性[16]。因此,在生产中可采用接种AMF、施用生物炭等方法修复Cd污染土壤,减少Cd对农作物的毒害。
