基于碳点分子印迹纸芯片法测定金银花绿原酸含量
2022-09-01孔京华刘诗诗段凤琪
乐 薇,孔京华,刘诗诗,段凤琪
(武汉工商学院环境与生物工程学院,湖北 武汉 430065)
金银花为忍冬科(Caprifoliaceae)植物忍冬(Thunb.)的花蕾,是一种药食同源的中药材,广泛应用于中药制剂和食品行业。绿原酸是金银花的主要活性成分,具有抗菌、抗氧化和抗肿瘤等显著生物活性,其含量是金银花质量控制的常用指标之一。绿原酸含量测定方法主要为高效液相色谱法,但该法需要大型精密仪器,在一些条件简陋的地方并不适用。因此,开发一种简便快速适合现场分析的绿原酸含量测定方法很有必要。
微流控纸芯片具有成本低廉、便携、操作简单和无需复杂外部仪器等优点,被广泛认为是快速检测装置发展的主流方向。此方法利用纸张为基底,通过喷蜡打印和丝网印刷等加工技术,在纸基材料上加工具有一定结构的亲/疏水通道,将被测溶液限定在预设的亲水区域内进行检测。目前已应用于食品安全和环境检测等领域。
自其被偶然发现以来,荧光碳点(carbon dots,CDs)已经成为一种应用广泛的碳纳米材料,具有生物相容性好、光稳定性好和制备过程简单等优点,在分析检测领域具有良好的应用前景。然而,荧光CDs存在抗干扰能力弱及选择性差等问题。研究表明,将分子印迹技术与CDs结合后,可显著提高荧光CDs的选择性。因此,本研究利用数码成像技术,结合荧光CDs的高灵敏度和分子印迹的高选择性制备纸芯片,并对其进行优化,以实现金银花中绿原酸含量高效、低廉和简便测定。
1 材料与方法
1.1 材料与试剂
金银花 湖北罗田县绿野尚品农业发展有限公司;绿原酸标准品(纯度≥98%) 国药集团化学试剂有限公司;木犀草素、芦丁(纯度≥98%) 南京春秋生物工程有限公司;牛血清白蛋白标准品 上海源叶生物科技有限公司;中速滤纸 通用电气生物科技(杭州)有限公司。
3-氨丙基三乙氨基硅烷(3-aminopropyltriethoxysilane,APTES) 阿拉丁试剂(上海)有限公司;正硅酸乙酯(tetraethyl orthosilicate,TEOS) 福晨(天津)化学试剂厂;-半胱氨酸、酪氨酸、甘氨酸 上海山浦化工有限公司;乙醇、柠檬酸铵、氯化钙、氯化钠、氯化钾天津市凯通化学试剂有限公司;氨水 天津百世化工有限公司;葡萄糖 天津市河北区海晶精细化工厂;以上试剂均为分析纯。
1.2 仪器与设备
KQ-50E型超声波清洗器 昆山市超声仪器有限公司;JYO2S型紫外分析仪 北京君意东方电泳设备有限公司;M-700微波炉 广东美的微波炉制造有限公司;9 SE智能手机 北京小米科技有限责任公司;HP LaserJet 1020plus激光打印机 惠普科技(北京)有限公司;LC-201A高效液相色谱仪 美国英特矽尔公司。
1.3 方法
1.3.1 滤纸亲疏水区的制备
由绘图软件Auto CAD 2014设计直径6 mm圆形阵列式微流控图案,用激光打印机将其打印在A4大小的滤纸上,置于170 ℃烘箱加热固化1.5 h。滤纸上墨粉中的无色聚合物可形成疏水墙,获得白色区域的亲水区(检测区)和黑色区域的疏水区,如图1所示。

图1 滤纸亲疏水区微流控图案示意图(A)及处理后实物图(B)Fig. 1 Schematic diagram of hydrophilic and hydrophobic microfluidic patterns (A) and actual image after treatment (B)
1.3.2 CDs制备及功能化
参考李慧玉方法,以柠檬酸铵和-半胱氨酸为碳源,采用微波法制备APTES修饰的CDs。将2 g(9.6 mmol)柠檬酸铵与1 g(8.3 mmol)-半胱氨酸溶于10 mL超纯水,超声处理2 min后,置于700 W家用微波炉中加热3 min,得到褐色粉末。加水溶解后,10 000 r/min离心20 min,取上清液。经真空干燥得到CDs并称质量。用水溶解并配制成40 mL 10 mg/mL CDs溶液。加2 mL APTES,60 ℃搅拌24 h,得到氨基修饰的CDs。
1.3.3 CDs分子印迹纸芯片制备
将绿原酸标准品溶于一定体积的无水乙醇中,超声溶解后加入一定体积的功能单体(APTES)及1.3.2节中氨基修饰的CDs溶液,搅拌10 min。加入一定体积的交联剂(TEOS)及50 μL氨水,25 ℃下反应10 min,再经氮气脱气15 min,得到预聚液。在超声功率150 W、超声温度30 ℃下,超声辅助聚合反应一定时间。移取10 μL超声后的预聚液到滤纸检测区中,自然晾干。用无水乙醇漂洗滤纸条,洗去未反应的多余试剂;用70%乙醇溶液(/)洗去绿原酸,干燥后即得CDs分子印迹纸芯片。
同时制备非印迹纸芯片用作对照,除不加绿原酸标准品外,其余操作相同。
1.3.4 CDs分子印迹纸芯片法的可行性分析
绿原酸溶液制备:准确称取50 mg绿原酸标准品,加70%乙醇溶液(/)溶解并定容至50 mL,得到1.0 mg/mL绿原酸溶液。将1.0 mg/mL绿原酸溶液用70%乙醇溶液稀释1 倍后得到0.5 mg/mL绿原酸溶液。
按1.3.3节制备CDs分子印迹纸芯片和非印迹纸芯片。绿原酸0.017 5g,无水乙醇6 mL,APTES 71 μL,TEOS 68 μL,CDs溶液1.0 mL,超声聚合时间30 min。在纸芯片检测区分别加入0、0.5、1.0 mg/mL绿原酸溶液4 μL(0 mg/mL绿原酸溶液为70%乙醇溶液)。显色20 min后拍摄365 nm波长处的荧光图片。
1.3.5 单因素优化试验
为提高CDs分子印迹纸芯片测定绿原酸的灵敏度,以显色斑点的红()、绿()、蓝()值为评价指标进行单因素优化试验。优化试验中使用的0.15 mg/mL绿原酸溶液以70%乙醇溶液为溶剂。空白组绿原酸点样体积为0 μL,其余操作与试验组相同。
1.3.5.1 超声辅助聚合时间优化
按照1.3.3节制备CDs分子印迹纸芯片。绿原酸0.017 5 g,无水乙醇6 mL,APTES 71 μL,TEOS 68 μL,CDs溶液1.0 mL。在此条件下,考察超声辅助聚合时间(5、10、15、20、25、30、35、40 min)对纸芯片制备的影响。在纸芯片检测区加入4 μL 0.15 mg/mL绿原酸溶液,显色20 min后拍摄365 nm波长处的荧光图片并分析显色斑点的、、值。
1.3.5.2 无水乙醇添加体积优化
按照1.3.3节制备CDs分子印迹纸芯片。绿原酸0.017 5 g,APTES 71 μL,TEOS 68 μL,CDs溶液1.0 mL,超声辅助聚合时间35 min。在此条件下,考察无水乙醇添加体积(3、4、5、6、8、10 mL)对纸芯片制备的影响。在纸芯片检测区加入4 μL 0.15 mg/mL绿原酸溶液,显色20 min后拍摄365 nm波长处的荧光图片并分析显色斑点的、、值。
1.3.5.3 模板分子-功能单体-交联剂的物质的量比优化
按照1.3.3节制备CDs分子印迹纸芯片。绿原酸0.017 5 g,无水乙醇5 mL,CDs溶液1.0 mL,超声辅助聚合时间35 min,APTES用量分别为47、71、94、118、140 μL,TEOS用量分别为45、68、90、113、134 μL。在此条件下,考察模板分子-功能单体-交联剂的物质的量比(1∶4∶4、1∶6∶6、1∶8∶8、1∶10∶10、1∶12∶12)对纸芯片制备的影响。在纸芯片检测区加入4 μL 0.15 mg/mL绿原酸溶液,显色20 min后拍摄365 nm波长处的荧光图片并分析显色斑点的、、值。
1.3.5.4 CDs溶液添加体积优化
按照1.3.3节制备CDs分子印迹纸芯片。绿原酸0.017 5 g,无水乙醇体积5 mL,APTES 94 μL,TEOS 90 μL,超声辅助聚合时间35 min。在此条件下,考察CDs溶液添加体积(0.8、1.0、1.2、1.5、1.8 mL)对纸芯片制备的影响。在纸芯片检测区加入4 μL 0.15 mg/mL绿原酸溶液,显色20 min后拍摄365 nm波长处的荧光图片并分析显色斑点的、、值。
1.3.5.5 点样体积优化
在最优制备条件下,按照1.3.3节制备CDs分子印迹纸芯片。分别在纸芯片检测区准确滴加不同体积(0、1、2、3、4、5 μL)质量浓度0.15 mg/mL绿原酸溶液,显色20 min后拍摄365 nm波长处的荧光图片并分析显色斑点的、、值。
1.3.5.6 显色时间优化
在最优制备条件下,按照1.3.3节制备CDs分子印迹纸芯片。在纸芯片检测区准确滴加4 μL 0.15 mg/mL绿原酸溶液,在不同显色时间(5、10、15、20、25、30、35、40、60、120 min)下拍摄365 nm波长处的荧光图片并分析显色斑点的、、值。
1.3.6 CDs分子印迹纸芯片测定金银花中绿原酸含量
1.3.6.1 制备绿原酸标准溶液及金银花待测液
准确称取25 mg绿原酸标准品,加70%乙醇溶液溶解并定容至50 mL,得到0.5 mg/mL绿原酸母液。准确移取不同体积的绿原酸母液,用70%乙醇溶液稀释分别得到0.025、0.050、0.075、0.10、0.125、0.15 mg/mL的绿原酸标准溶液,用于CDs分子印迹纸芯片法标准曲线的建立。
准确称取5.00 g金银花,以70 mL 70%乙醇溶液为溶剂,90 ℃下索氏提取120 min,得到金银花粗提取液。取1.0 mL粗提取液,用70%乙醇溶液定容至25 mL,得到金银花待测液。另取12.5 mL金银花待测液,加70%乙醇溶液定容至25 mL,用于加标回收实验。
1.3.6.2 荧光图片获取及处理
在最佳的CDs分子印迹纸芯片制备条件和显色条件下,在纸芯片的检测区,分别滴加不同质量浓度的绿原酸标准溶液和金银花待测液,室温下反应一定时间(最佳显色时间)。将待测纸芯片水平置于紫外分析仪的暗箱中,在365 nm波长处将智能手机镜头置于紫外分析仪的相机拍照口,每次拍摄均采用2 倍焦距拍照模式拍照。空白组绿原酸点样体积为0 μL,其余操作与实验组相同。
用Adobe Photoshop CS5.1软件处理荧光图片,得到整个圆形检测区、、值的平均值并代入最优的浓度拟合方程中,得到金银花待测液中绿原酸质量浓度,并计算金银花样品中绿原酸相对含量:
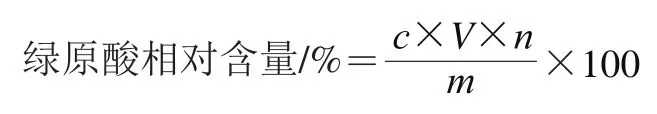
式中:为金银花待测液体积/mL;为稀释倍数;为金银花样品质量/mg;为金银花待测液中绿原酸质量浓度/(mg/mL)。
1.3.7 高效液相色谱测定金银花中绿原酸含量
1.3.7.1 绿原酸标准溶液及金银花待测液配制
准确称取10 mg绿原酸标准品,加75%甲醇溶液(/)定容至100 mL,得到0.1 mg/mL绿原酸标准品母液。量取不同体积绿原酸标准品母液,分别用75%甲醇溶液配制成0.02、0.04、0.06、0.08 mg/mL系列标准溶液,用于标准曲线的建立。
取1.3.6.1节中金银花粗提取液1.0 mL于100 mL棕色容量瓶中,加75%甲醇溶液定容。经0.45 μm滤膜过滤后,进样供高效液相色谱检测。
1.3.7.2 高效液相色谱条件
色谱柱:Inertsil ODS-SP(4.6 mm×250 mm,5 μm);流动相:A乙腈+B 0.1%磷酸溶液(/);梯度洗脱程序:0~8 min,14%~19% A、86%~81%B;11~22 min,19% A、81% B;23~35 min,19%~31% A、81%~69% B。检测波长327 nm;柱温25 ℃;流速1 mL/min;进样体积10 μL。
1.4 数据处理
2 结果与分析
2.1 CDs分子印迹纸芯片测定绿原酸含量的可行性分析

图2 CDs分子印迹纸芯片(a)和非印迹纸芯片(b)对绿原酸的荧光响应Fig. 2 Fluorescence response of molecularly imprinted (a) and nonmolecularly imprinted paper chip (b) to chlorogenic acid
由图2可知,滴加绿原酸后,CDs分子印迹纸芯片上荧光斑点颜色为蓝色,并且随着绿原酸质量浓度的增加逐渐变浅;而在非印迹纸芯片上荧光斑点为明亮的白色且无明显变化。这表明CDs印迹纸芯片可以用于检测绿原酸的含量。其检测原理推测为在绿原酸分子印迹物的存在下,CDs在365 nm波长的紫外光下显蓝色荧光,绿原酸分子能被纸芯片上的印迹孔穴特异性识别,吸附的绿原酸与CDs反应发生作用导致荧光斑点颜色发生变化。
2.2 CDs分子印迹纸芯片制备条件的优化
2.2.1 超声辅助聚合时间对显色斑点、、值的影响
由图3A可知,随着超声辅助聚合时间的延长,空白组显色斑点的、值基本保持不变,值总体呈缓慢上升的趋势。对比空白及绿原酸点样后的、、值的差值(Δ、Δ、Δ),由图3B可知,超声辅助聚合30 min内Δ、Δ值波动不大,但Δ变化明显,超声辅助聚合35 min时Δ、Δ、Δ最大,之后略微下降并趋于平缓。这是因为印迹聚合物的聚合程度与聚合时间有关,时间过短,聚合度不高,对绿原酸的选择性不高。时间延长后由于预聚液中的CDs分子印迹聚合物充分聚合,对绿原酸吸附性增强,从而与CDs发生反应的绿原酸增多,造成荧光斑点变化明显。因此,CDs分子印迹纸芯片制备的超声辅助聚合时间确定为35 min。
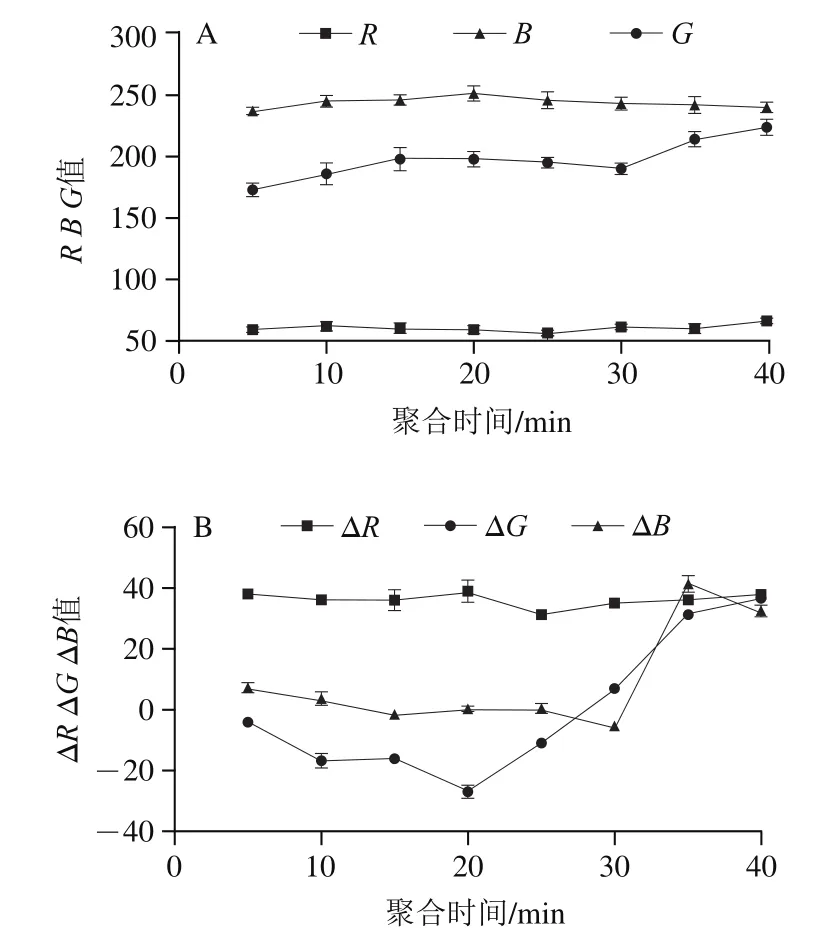
图3 不同超声辅助聚合时间下空白组显色斑点的R、G、B值(A)和绿原酸点样组显色斑点的ΔR、ΔG、ΔB值(B)Fig. 3 R, G and B values of blank samples (A) and ΔR, ΔG and ΔB values of chlorogenic acid samples (B) with different ultrasonic-assisted polymerization times
2.2.2 无水乙醇添加量对显色斑点、、值的影响
由图4可知,随着无水乙醇体积的增加,空白组显色斑点的值先上升后下降、值变化较小、值缓慢上升;而经绿原酸点样的显色斑点的Δ、Δ基本出现先增加后下降的趋势,Δ则呈现先增加后下降再增加的趋势,在无水乙醇添加量为5 mL时,Δ、Δ、Δ最大。这是因为溶剂过少时交联剂浓度大使印迹膜的孔隙小,不利于绿原酸的选择性吸附,而溶剂量过大又使印迹膜难以形成。因此,制备CDs分子印迹纸芯片,无水乙醇的最佳添加量是5 mL,即每0.01 mmol绿原酸添加1 mL无水乙醇。
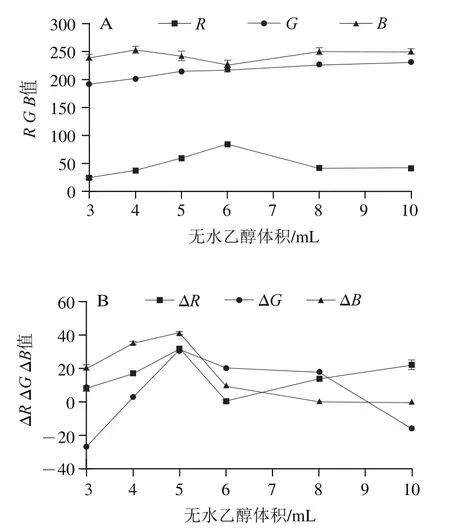
图4 不同无水乙醇体积下空白组显色斑点的R、G、B值(A)和绿原酸点样组显色斑点的ΔR、ΔG、ΔB值(B)Fig. 4 R, G and B values of blank samples (A) and ΔR, ΔG and ΔB values of chlorogenic acid samples (B) with different anhydrous ethanol volumes
2.2.3 模板分子-功能单体-交联剂物质的量比对显色斑点、、值的影响
由图5B可知,在聚合体系中,当模板分子(绿原酸)、功能单体(APTES)和交联剂(TEOS)的物质的量比为1∶8∶8时,绿原酸点样组显色斑点的ΔRGB值最大。这是因为当交联剂用量过大时,聚合度过高,模板不易洗脱,吸附位点被占据,吸附量下降;而功能单体量过大时会发生自身分子聚合,选择性吸附能力下降。因此,制备CDs分子印迹纸芯片,模板分子、功能单体和交联剂的最优物质的量比为1∶8∶8。
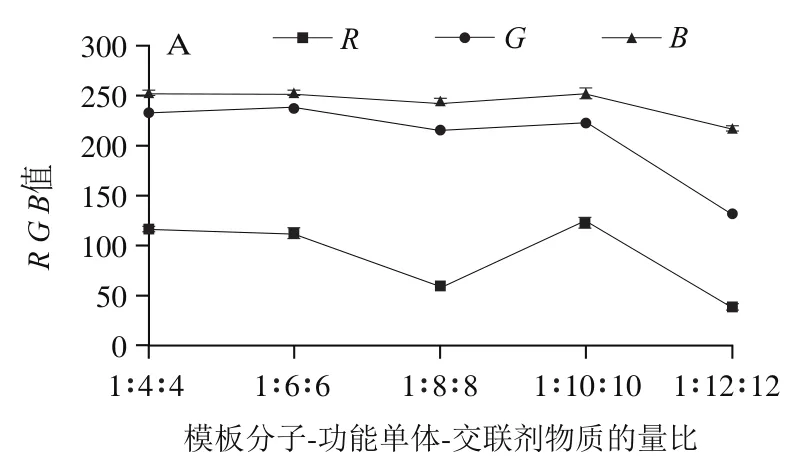
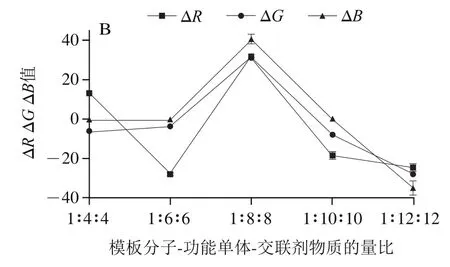
图5 不同模板分子-功能单体-交联剂物质的量比下空白组显色斑点的R、G、B值(A)及绿原酸点样组显色斑点的ΔR、ΔG、ΔB值(B)Fig. 5 R, G and B values of blank samples (A) and ΔR, ΔG and ΔB values of chlorogenic acid samples (B) with different molar ratios of template molecule to functional monomer to crosslinking agent
2.2.4 CDs添加量对显色斑点、、值的影响
由图6A可知,随着CDs添加量的增加,空白组显色斑点的值基本保持不变,和值呈现下降趋势。由图6B可知,经绿原酸点样的显色斑点的ΔRGB值呈现先增加后下降的趋势;CDs溶液添加体积为1 mL时,ΔRGB值最大。这是因为当CDs添加量过大时,背景荧光强度过大,造成绿原酸点样后荧光强度变化不明显。因此,CDs的最优添加量为1 mL,即每0.01 mmol绿原酸添加0.2 mL CDs溶液。
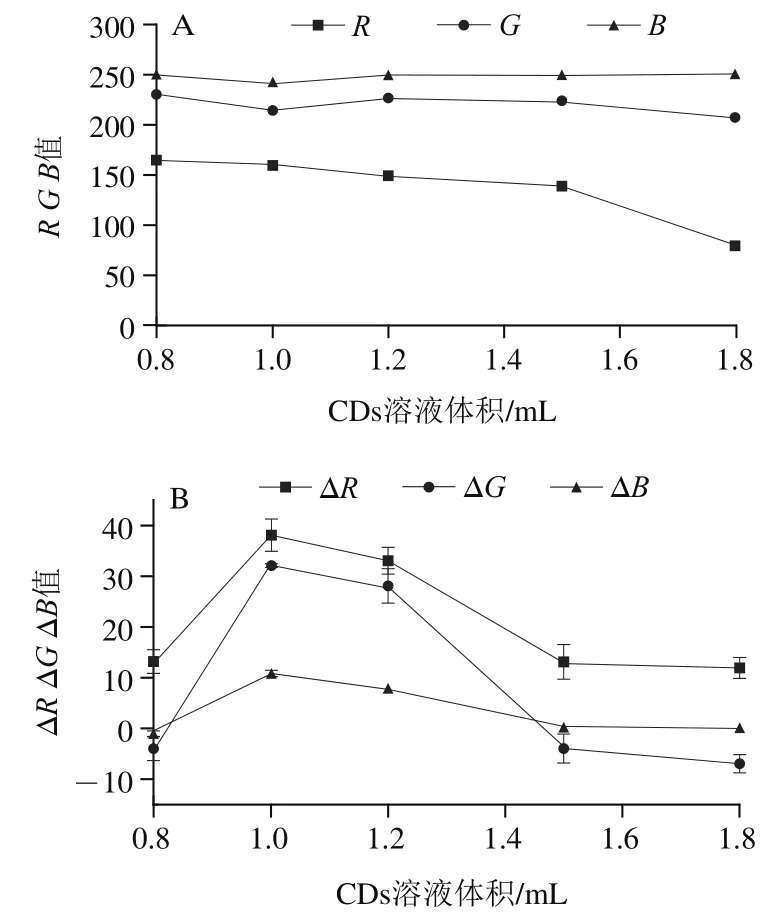
图6 不同CDs添加量下空白组显色斑点的R、G、B值(A)及绿原酸点样组显色斑点的ΔR、ΔG、ΔB值(B)Fig. 6 R, G and B values of blank samples (A) and ΔR, ΔG and ΔB values of chlorogenic acid samples (B) with different volumes of CDs solution
2.3 CDs分子印迹纸芯片显色条件的优化
2.3.1 绿原酸点样体积对显色斑点、、值的影响
由图7可以看出,点样体积≤2 μL时RGB值标准偏差较大,这是由于点样体积过小,溶液未完全覆盖亲水区,造成显色不均匀,使、、值重现性下降;点样体积>2 μL时,RGB值基本趋于稳定;点样体积为4 μL时,RGB值标准偏差最小。因此,绿原酸最佳点样体积为4 μL。
图7 不同点样体积下绿原酸显色斑点的R、G、B值Fig. 7 R, G and B values of chlorogenic acid samples with different sample volumes
2.3.2 显色时间对显色斑点、、值的影响
由图8可知,在显色40 min内,随着显色时间的增加,、值变化不明显;值先上升并在显色时间15~25 min时较为稳定,之后呈现缓慢上升趋势。在显色时间40、60、120 min处拍照获取的、、值变化不明显,可以推断该体系荧光能够较长时间稳定存在,长时间放置结果变化较小。综合考虑显色稳定性和检测时长,选择最优显色时间为15 min。
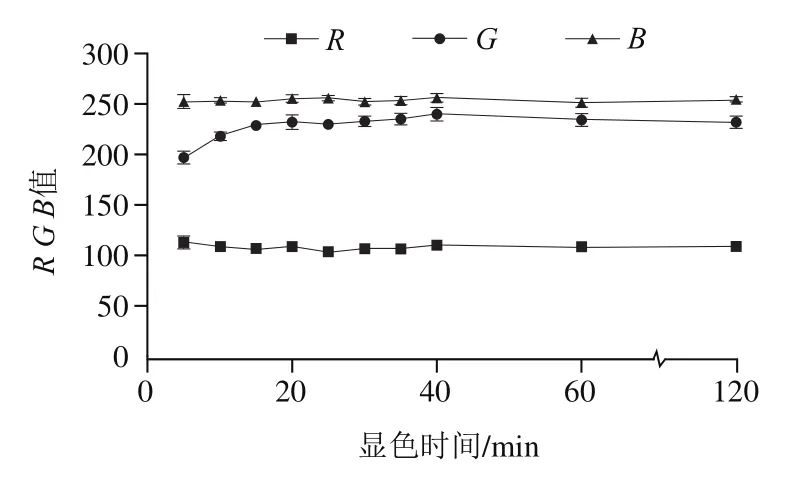
图8 不同显色时间下绿原酸显色斑点的R、G、B值Fig. 8 R, G and B values of chlorogenic acid samples with different color development times
2.4 CDs分子印迹纸芯片法绿原酸标准曲线的建立
在最佳的CDs分子印迹纸芯片制备条件和显色条件下,滴加不同质量浓度绿原酸标准溶液进行拍照(图9),并读取显色斑点的、、值,代入不同的数学模型中进行线性拟合,结果如表1所示。通过比较数学模型的决定系数(),得到最适合的数学模型为=594.28+154.64,>0.99,绿原酸质量浓度与值呈正相关。因此,本实验建立的标准曲线方程为=594.28+154.64。继续呈梯度增加绿原酸标准溶液质量浓度,观察绿原酸质量浓度与值的关系,发现当绿原酸质量浓度为0.025~0.15 mg/mL,荧光斑点的值与绿原酸质量浓度依旧呈线性关系。对空白溶液进行11 次重复实验,按照检出限=空白测定值标准差的3 倍/标准曲线斜率,得到检出限为0.020 6 mg/mL。

图9 不同质量浓度绿原酸标准溶液的荧光显色照片Fig. 9 Fluorescent color images of chlorogenic acid standard solutions at different mass concentrations

表1 不同数学模型的拟合情况Table 1 Fitting of R, G and B values to different mathematical models
2.5 共存物质对显色斑点R、G、B值的影响
在绿原酸质量浓度为0.05 mg/mL下,测定了常见金属离子、葡萄糖、蛋白质、氨基酸和黄酮类化合物对绿原酸荧光显色斑点、、值的影响。因为标准曲线的纵坐标为值,故以值的变化量为考察目标,结果如表2所示。
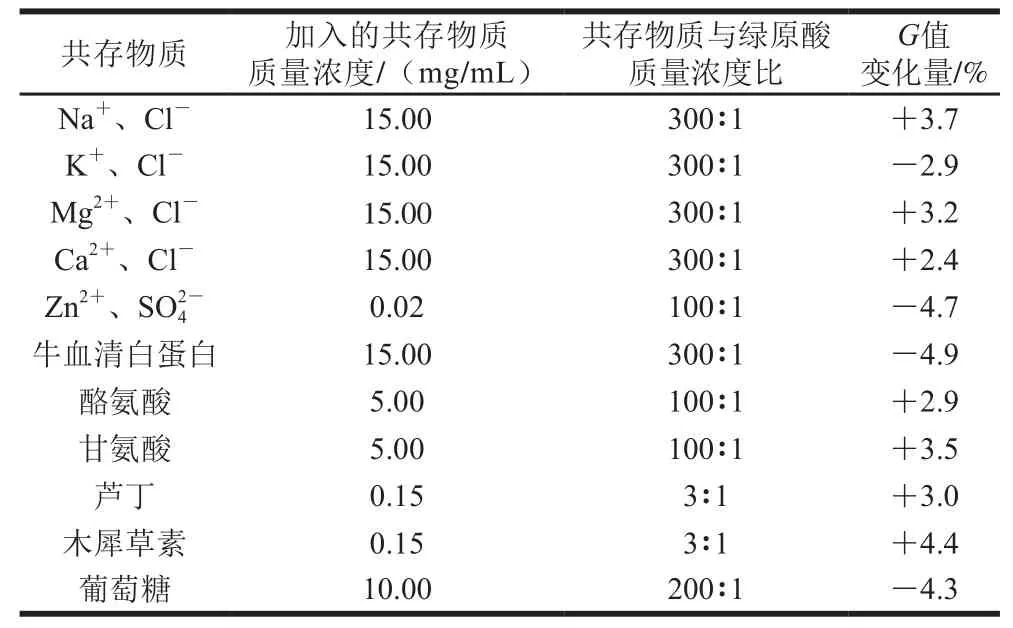
表2 共存物质的显色斑点G值Table 2 G values of colored spots in the presence of coexisting substances
由表2可知,常见金属离子(Na、K、Mg、Ca和Zn)、蛋白质(牛血清白蛋白)、氨基酸(酪氨酸和甘氨酸)和葡萄糖等对检测体系影响小;芦丁和木犀草素等黄酮类物质的质量浓度是绿原酸质量浓度的3 倍及以下时,这些黄酮类物质对绿原酸含量检测的影响也可忽略。由于实际测定中,金银花待测液的黄酮类物质含量很低,因此该检测体系对金银花中绿原酸含量测定具有较高的选择性。
2.6 两种方法测定金银花中绿原酸含量对比分析
由表3可知,CDs分子印迹纸芯片法测定绿原酸的相对含量平均值为4.01%,相对标准偏差为6.60%,具有良好的重复性。CDs分子印迹纸芯片法测定的绿原酸含量与HPLC法测定结果相近。
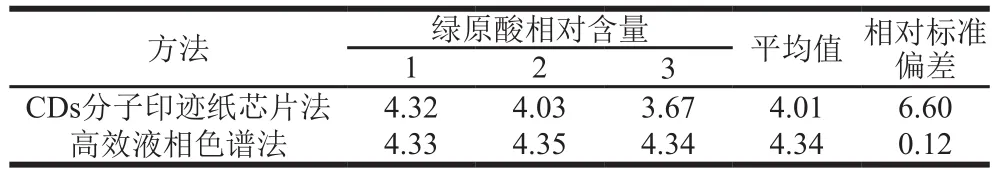
表3 CDs分子印迹纸芯片法和高效液相色谱法测定金银花中绿原酸含量Table 3 Comparison of results of determination of chlorogenic acid content in honeysuckle by CDs-molecularly imprinted paper chip and high performance liquid chromatography%
2.7 CDs分子印迹纸芯片法测定绿原酸加标回收分析
保证绿原酸质量浓度在纸芯片法的线性范围内,进行加标回收分析。由表4可知,CDs分子印迹纸芯片法的样品回收率在90.77%~102.10%之间,相对标准偏差为4.10%。
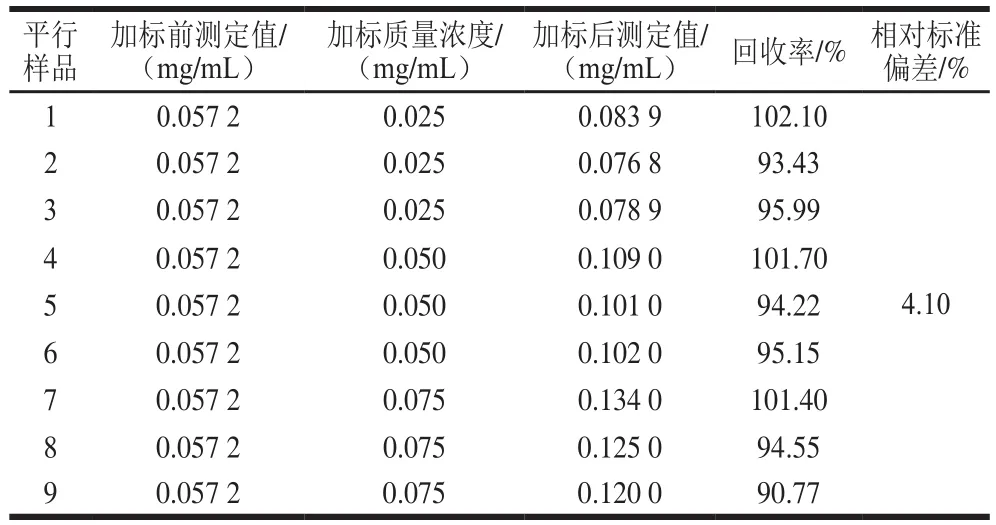
表4 CDs分子印迹纸芯片法测定绿原酸的加标回收实验结果Table 4 Recoveries of CDs-molecularly imprinted paper chip for spiked chlorogenic acid
3 结 论
结合CDs的荧光特性和分子印迹技术的高选择性,开发出一种利用纸芯片快速测定金银花中绿原酸含量的方法。单因素优化试验得到CDs分子印迹纸芯片的最佳制备条件:绿原酸、功能单体和交联剂物质的量比1∶8∶8,每0.01 mmol绿原酸添加1 mL无水乙醇、0.2 mL氨基修饰的CDs溶液,预聚液超声辅助聚合时间35 min。最佳显色条件:点样量4 μL,显色时间15 min。在上述最优条件下,绿原酸质量浓度在0.025~0.15 mg/mL时与其荧光显色斑点的值呈良好的线性关系,为0.991 8,测得的金银花中绿原酸含量与高效液相色谱法测定结果较接近。CDs分子印迹纸芯片法仅需制备好的纸芯片、紫外灯和智能手机,直接点样,即可进行检测。所需试剂量极少、成本低廉且简便快速,能满足现场快速测定分析。后续研究可对此方法灵敏度进行提高。
