高效液相色谱-示差折光检测法检测无刺蜂蜂蜜中海藻酮糖含量
2022-09-01薛晓锋汪正威吴黎明赵亚周彭文君
郑 星,王 凯,*,薛晓锋,汪正威,潘 鹏,吴黎明,赵亚周,彭文君,*
(1.中国农业科学院蜜蜂研究所,北京 100093;2.中国科学院西双版纳热带植物园,云南 西双版纳 650223;3.西双版纳云蜂古山生物科技有限公司,云南 西双版纳 666200)
无刺蜂属于膜翅目(Hymenoptera)、蜜蜂科(Apidae)、麦蜂族(Meliponini)昆虫,由于尾部蛰针退化,故被名为无刺蜂。其主要生活在热带和亚热带地区,在我国主要分布于中国台湾、云南和海南等热带地区。无刺蜂身型较小,是热带植物的重要授粉者,它可采集巢穴周围开花的汁液、植物或昆虫分泌物,并储存于用蜂胶和蜂蜡的混合物制成的球型罐中,即为无刺蜂蜂蜜。研究发现无刺蜂蜂蜜中含有丰富的营养成分,如多酚类化合物等,具有显著的药理活性和药用价值,例如抗氧化、消炎、抑菌、促进伤口愈合、抗糖尿病、治疗眼部疾病、调节机体代谢、调节肠道菌群等,因此会被认为是一种重要的保健食品,越来越受消费者的喜爱。无刺蜂蜂蜜的口感酸甜,水分含量较高,主要由糖类组成,约占其干质量碳水化合物的95%~97%。
海藻酮糖是一种还原性二糖,目前仅在天然无刺蜂蜂蜜中发现,难以用化学合成,研究表明目前只有某些微生物可以通过蔗糖异构酶转化蔗糖生成异麦芽酮糖和海藻酮糖。这些蔗糖异构体比蔗糖具有更高的酸稳定性,在某种程度上可以增加物种的竞争优势。高蔗糖饮食除了会引起人体的肥胖、高血压、高血脂、高血糖等代谢疾病,还会引起全身和脑部炎症,以及增加结肠直肠癌等风险。考虑到蔗糖异构体还没有副作用的报道,这些物质可能是理想的蔗糖替代品。异麦芽酮糖的甜度约为蔗糖的30%;但海藻酮糖甜度是蔗糖的60%,具有高度水溶性,可作为填充剂、保湿剂和质地增强剂,适合用于果冻和果酱等高甜食品加工。海藻酮糖的消化吸收慢于蔗糖,会降低单糖和胰岛素释放到血液中的速率,可用于糖尿病患者的食品和饮料;并且海藻酮糖不作为能引起龋齿的变形链球菌的葡萄糖基转移酶的底物,显著降低龋齿病,防止蛀牙。除了作为食品成分的优点外,海藻酮糖的还原性使其成为良好的化学修饰前体,并且还被用于制作糖醇,作为低热量的甜味剂和生物相容性聚合物。海藻酮糖具有优秀的生物学功能,然而目前鲜见针对我国无刺蜂蜂蜜中海藻酮糖的研究报道。
无刺蜂蜂蜜含有多种功效成分,消费者对无刺蜂蜂蜜衍生产品的需求迅速增长,无刺蜂蜂蜜的鉴别、质量控制和标准对于无刺蜂蜂蜜的应用具有重要的支撑意义。但我国无刺蜂蜂产品相关研究刚起步,对其化学组分及营养成分的研究才刚刚开始。本实验以我国无刺蜂蜂蜜为研究对象,通过建立无刺蜂蜂蜜中海藻酮糖的检测方法,对我国无刺蜂蜂蜜样品中的海藻酮糖进行分析。通过样品的采集地点、时间、蜂种差异,分析海藻酮糖在无刺蜂蜂蜜中的含量及稳定性,旨在为相关食品标准的建立提供一定参考依据。
1 材料与方法
1.1 材料与试剂
无刺蜂蜂蜜样品主要是2019—2021年从我国海南、云南和马来西亚采集,具体样品编号、所属的蜂种、采集日期和地点详见表1。
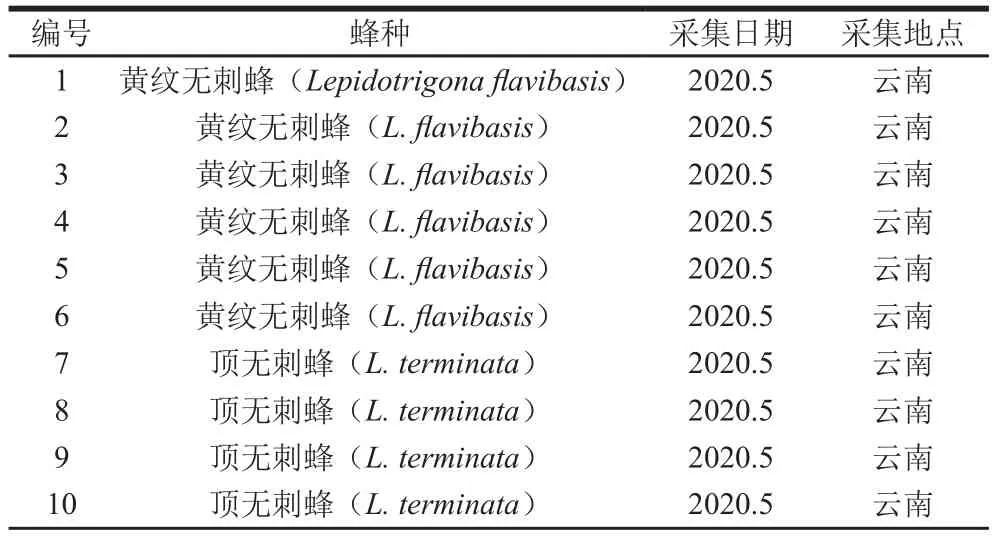
表1 无刺蜂蜂蜜样品Table 1 Details of stingless bee honey samples tested
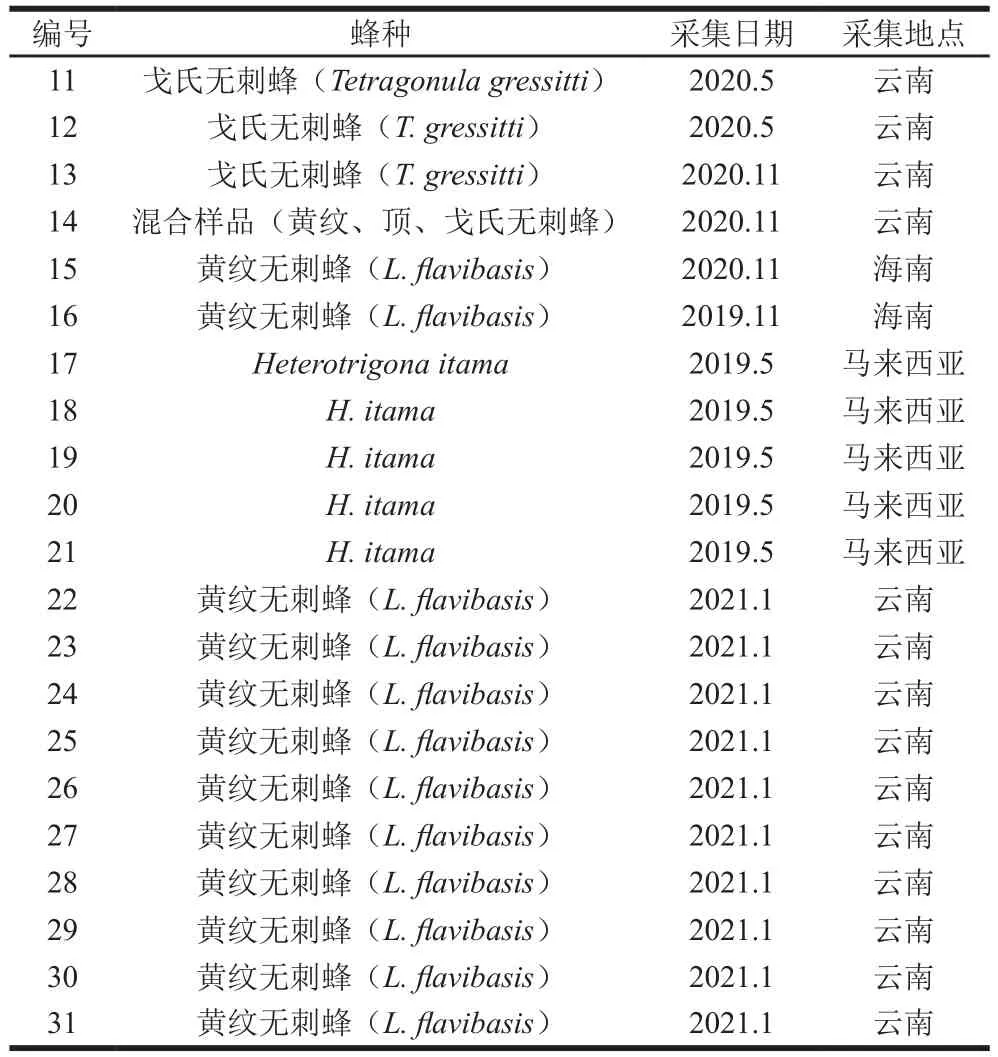
续表1
洋槐蜂蜜、枣花蜂蜜、荆条蜂蜜(中国农业科学院蜜蜂研究所实验蜂场,由意大利蜂采集);麦卢卡蜜 康维他食品(中国)有限公司;果葡糖浆(食品级) 安徽源森生物科技有限公司;海藻酮糖标准品(HPLC≥90%,CAS:51411-23-5) 英国Biosynth Carbosynth公司;-无水葡萄糖(HPLC≥99.5%,CAS:50-99-7)、-果糖(HPLC≥99.5%,CAS:57-48-7;)、蔗糖(HPLC≥98%,CAS:57-50-1)、麦芽糖(HPLC≥98%,CAS:6363-53-7)、海藻糖(HPLC≥98%,CAS:99-20-7)标准品 上海源叶生物科技有限公司;超纯水 中国华润怡宝饮料有限公司。
1.2 仪器与设备
ME104E型电子分析天平 上海Mettler-Toledo仪器有限公司;KQ-500DE数控超声波清洗器 昆山市超声仪器有限公司;高效液相色谱(high performance liquid chromatography,HPLC)仪(配示RID-10A示差检测器) 日本岛津有限公司;1290高效液相色谱-6545电喷雾离子源四极杆飞行时间串联质谱仪安捷伦科技有限公司。
1.3 方法
1.3.1 糖标准品及蜂蜜样品溶液制备
海藻酮糖标准溶液:将1 g/mL的海藻酮糖母液,依次稀释为300、150、50、25、10、5、2.5、1、0.5 mg/mL。
其他糖单标准品溶液:分别配制质量浓度为150 mg/mL的葡萄糖、果糖、蔗糖、麦芽糖和海藻糖标准品溶液,后稀释为50 mg/mL的单标准品溶液。
混合标准品溶液:分别取150 mg/mL各标准溶液20 μL,配成25 mg/mL的混合标准品溶液。
样品溶液:准确称取0.5 g样品于烧杯中,加入5 mL水溶解,转移至10 mL的容量瓶中,用3 mL水清洗烧杯,并转移至相同的容量瓶中,纯水定容。用一次性注射器取1 mL样品溶液过0.22 μm尼龙滤膜到进样小瓶中,准备进样。
1.3.2 色谱条件
Hi-Plex Pb色谱柱(300 mm×7.7 mm,8 μm);流动相:纯水;柱温50 ℃;压力0.6 kPa;RID-10A示差检测器温度50 ℃;进样量10 μL;流速0.5 mL/min;单梯度洗脱时间27.5 min。
1.3.3 高效液相色谱-电喷雾离子源四极杆飞行时间串联质谱分析
50 mg/mL无刺蜂蜂蜜水用高效液相色谱仪按照1.3.2节条件下进行分离,当保留时间为18.61 min的目标化合物峰值出现时,用离心管收集洗脱液。将收集的单体物质用冷冻干燥的方法出去溶剂水,然后配制成50 mg/mL单体物质。
高效液相色谱条件:ACQUITY UPLCBEH Amide(2.1 mm×100 mm,1.7 μm)分离柱;柱温45 ℃,流速0.15 mL/min,分别对制备单体和海藻酮糖、蔗糖、麦芽糖标准品进样5 μL,流动相为50% A相(0.2%氨水)和50% B相(乙腈)进行等度分离。
质谱条件:在负离子Auto MS/MS模式下对母离子341.108 9([M-H])进行撞击,获得二级碎片。干燥气温度320 ℃,干燥气流速8 L/min,鞘气温度320 ℃,鞘气流速11 L/min,喷嘴电压1 000 V,去簇电压130 V。
1.3.4 方法学考察
干扰性实验:将50 mg/mL海藻酮糖、葡萄糖、果糖、蔗糖、麦芽糖和海藻糖混合标准品溶液,在1.3.2节色谱条件下进样10 μL,记录各标准品糖的出峰时间及峰面积,观察此方法中其他糖类物质对海藻酮糖的干扰。
标准曲线绘制:分别将50、25、10、5、2.5、1、0.5 mg/mL的海藻酮糖标准溶液在1.3.2节和1.3.3节条件下进样测定,以不同质量浓度海藻酮糖标准溶液(,mg/mL)为横坐标,以不同质量浓度海藻酮糖标准溶液的出峰面积()为纵坐标绘制标准曲线。检出限(limit of detection,LOD)为3 倍的信噪比,定量限(limit of quantitation,LOQ)为10 倍的信噪比。
重复性实验:按照1.3.1节方法平行制备6 份50 mg/mL海藻酮糖标准品溶液,按照1.3.2节色谱条件进样10 μL,记录6 份平行制备的标准品溶液的出峰时间,并计算其相对标准偏差(relative standard deviation,RSD)。
精密度实验:按照1.3.1节方法制备50 mg/mL海藻酮糖标准品溶液,按照1.3.2节色谱条件连续进样6 次,记录标准品溶液的出峰时间,并计算其峰面积的RSD。
稳定性实验:按照1.3.1节方法平行制备3 份50 mg/mL海藻酮糖标准品溶液,按照1.3.2节色谱条件分别在第1、2、3、4、5天进样10 µL,观察日间稳定性,记录标准品溶液的出峰时间,并计算其峰面积的RSD。
回收率实验:用果葡糖浆作为样品添加不同量海藻酮糖标准品进行回收,精确称取0.500 g果葡糖浆4 份,分别添加100 mg/mL海藻酮糖标准品5、2.5、1、0.5 mL,用水定容至10 mL,所得最终海藻酮糖溶液质量浓度分别为50、25、10、5 mg/mL,样品溶液过0.22 μm尼龙滤膜到进样小瓶中。再按1.3.2节色谱条件进样10 µL,计算海藻酮糖的加标回收率。
1.4 数据处理与统计
实验数据为重复3 次测定的平均值,采用SPSS 22.0软件进行差异显著性分析(<0.05,差异显著),并使用GraphPad Prism 8.3.0和Excel 2019进行图表绘制。
2 结果与分析
2.1 糖标准品和蜂蜜样品色谱检测
蜂蜜样品前处理直接用纯水进行提取,方法简单易行。Hi-Plex Pb色谱柱有更好的保留性,提高了对乳糖、蔗糖和其他一些单糖的分辨能力,经常用于甜乳制品的分析。本实验发现用Hi-Plex Pb可以将无刺蜂蜂蜜中的葡萄糖、果糖和海藻酮糖有效分离,峰形和保留时间稳定(图1)。用纯水作为流动相,只需等度洗脱,在27.5 min内无刺蜂蜂蜜中的葡萄糖、海藻酮糖和果糖就可以得到良好分离。
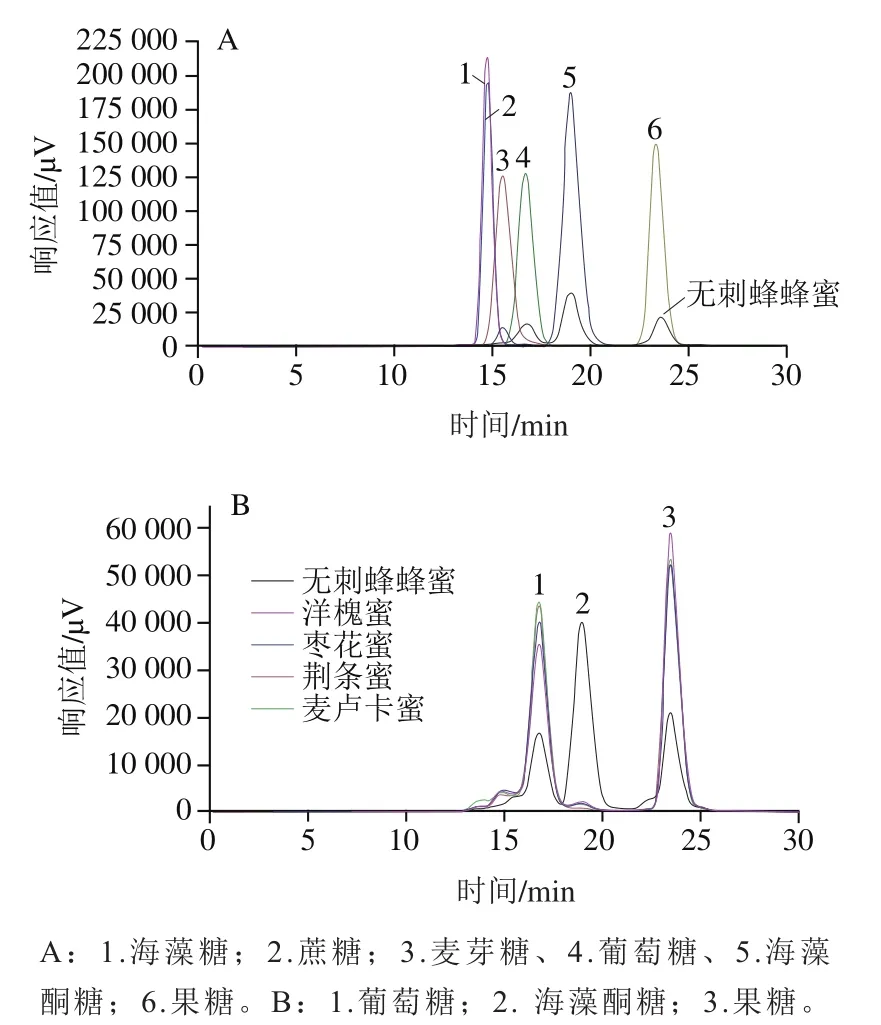
图1 糖标准品(A)和蜂蜜样品(B)色谱图Fig. 1 Chromatograms of sugar standards (A) and honey samples (B)
如图1A所示,6 个单标准品溶液的色谱图表明,海藻糖同蔗糖出峰时间完全一致,但其同海藻酮糖可实现明显分离。图1B无刺蜂蜂蜜样品溶液色谱图中3 个主要高响应峰分别为葡萄糖(1号峰,保留时间16.59 min)、海藻酮糖(2号峰,保留时间18.61 min)和果糖(3号峰,保留时间23.02 min)。以洋槐蜜、枣花蜜、荆条蜜、麦卢卡蜜作为常见蜂蜜对照,从图1B可以看出,无刺蜂蜂蜜的葡萄糖和果糖含量低于普通蜂蜜,但含有较高的海藻酮糖。由于海藻酮糖具有丰富的功能和生物利用度,检测出无刺蜂蜂蜜中海藻酮糖的含量有极大的研究价值。
海藻糖是一种低甜度的非还原性二糖,由2 个葡萄糖残基组成,于细菌、真菌、昆虫、无脊椎动物以及低等植物中天然存在。海藻糖在生物细胞中,能够与蛋白质或脂质间形成氢键,在炎热、寒冷、干燥、缺氧等不利条件下具有稳定细胞膜和蛋白质结构的特性。文献报道蜂蜜中含有少量的海藻糖和异麦芽酮糖,且海藻糖质量分数低于0.3%。但是国内没有研究者报道蜂蜜中含有海藻酮糖,这是首次在我国蜂蜜,特别是我国无刺蜂蜂蜜中发现海藻酮糖的证据。
蜂蜜中糖含量检测,目前主要采用的方法主要包括高效液相色谱-蒸发光散射检测法、稳定碳同位素比值测定法、高性能薄层色谱法、核磁共振碳水化合物谱图以及近红外光谱法等。参照GB 5009.8—2016《食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定》中提出的检测方法,用高效液相色谱-示差折光检测法/蒸发光散射检测法,使用氨基色谱柱,以乙腈-水(70∶30,/)为流动相,检测蜂蜜中果糖、葡萄糖、蔗糖、麦芽糖和乳糖的含量,但课题组前期实验表明,通过此方法,蔗糖和海藻酮糖的保留时间完全相同,不能实现二者的完全分离。因此在国标的基础上,探索出一种简单、快速和准确的方法检测无刺蜂蜂蜜中的海藻酮糖,此方法亦可对其他食物中海藻酮糖的检测提供重要参考。
2.2 高效液相色谱-电喷雾离子源四极杆飞行时间串联质谱分析海藻酮糖
通过高效液相色谱法对样品与标准品的对比可推测,保留时间为18.61 min的目标化合物为海藻酮糖。海藻酮糖与蔗糖、麦芽糖具有相同的分子式CHO,互为同分异构体,它们在负离子模式下([M-H])/341.108 9。因此通过电喷雾离子源四极杆飞行时间串联质谱对制备的单体物质和海藻酮糖、蔗糖、麦芽糖标准品进行二级分离,以检查制备单体物质与单体糖标准品的二级碎片([M-H])/341.108 9差异性。
由图2可以看出,从无刺蜂蜂蜜中分离制备的单体物质与海藻酮糖标准品的二级谱图一致,母离子([M-H])/341.108 9的主要二级碎片为/113、119、179和221。蔗糖在母离子([M-H])/341.108 9的主要二级碎片为/113、119和179,没有海藻酮糖中的221。麦芽糖在母离子([M-H])/341.108 9的主要二级碎片为/113、119、161和221,与海藻酮糖的二级离子也有显著差异。这与Fletcher等用UPLC-MS/MS分析的结果一致,海藻酮糖与蔗糖、麦芽糖在母离子([M-H])/341.108 9的主要二级碎片具有明显的差异性,3 种糖互为同分异构体。因此,通过高效液相色谱-电喷雾离子源四极杆飞行时间串联质谱可进一步确定保留时间18.61 min的目标化合物为海藻酮糖。
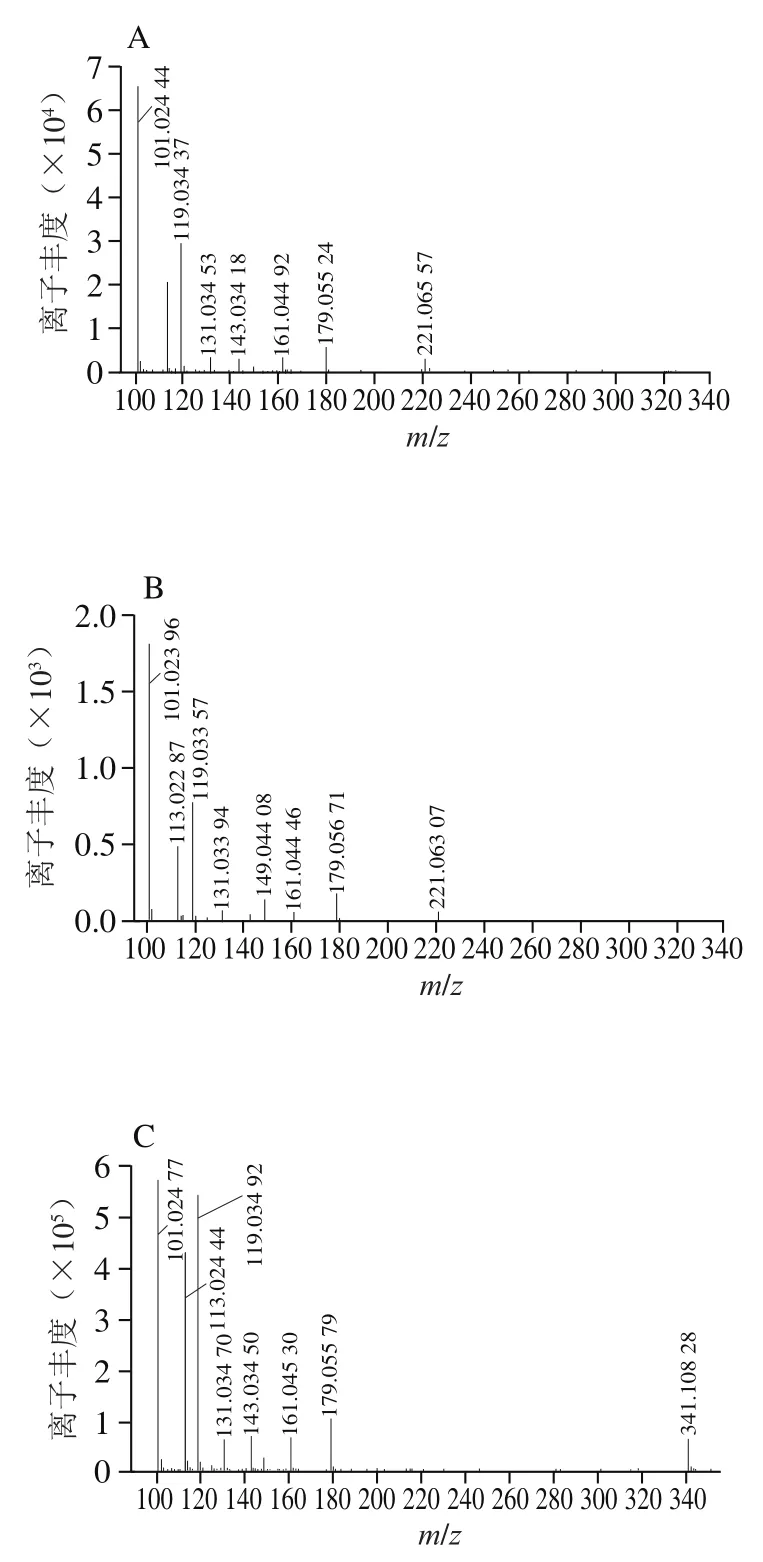
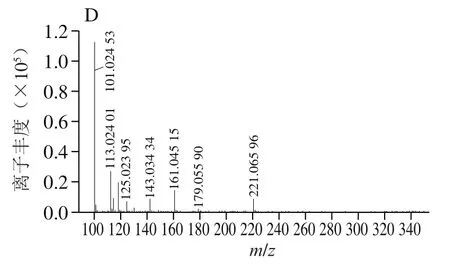
图2 无刺蜂蜂蜜制备单体(A)与海藻酮糖(B)、蔗糖(C)、麦芽糖(D)标准品在ESI-MS/MS光谱(碰撞电压130 V)在负离子模式下([M-H]- m/z 341.108 9)的结果Fig. 2 ESI-MS/MS spectra (at fragmentor voltage of 130 V) in negative ion mode of ([M−H]−) m/z 341.108 9 of stingless bee honey (A) and trehalulose (B), sucrose (C) and maltose (D) standards
2.3 方法学验证
2.3.1 方法的选择性
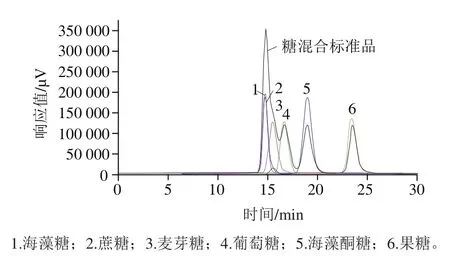
图3 糖混合标准品和单个糖标准品的液相色谱图Fig. 3 Liquid chromatograms of mixed and individual sugar standards
由于蜂蜜中主要的糖种类为葡萄糖、果糖、蔗糖和麦芽糖,并且文献中对蜂蜜报道较多的糖为海藻糖,因此将这5 种糖与海藻酮糖混合到一起作为混合标准糖溶液,观察蜂蜜中其他常见糖对海藻酮糖检测的干扰性。从图3可以看出,海藻酮糖与另外5 种糖完全分离,且保留时间与海藻酮糖单体一致。用1.3.2节色谱条件可以将海藻酮糖完整分离出来,方法具有很好的选择性,因此这种色谱条件可以作为检测蜂蜜中海藻酮糖含量的方法。
2.3.2 海藻酮糖标准曲线
由0.5、1、2.5、5、10、25、50 mg/mL的海藻酮糖标准溶液在1.3.2节色谱条件下检测得出的标准曲线,线性方程为=1.56×10+2.21×10,=0.999 6,因此海藻酮糖在0.5~50 mg/mL范围内线性关系良好。该方法测定海藻酮糖的其LOD为0.07 mg/mL,LOQ为0.22 mg/mL。
2.3.3 重复性、精密度、稳定性实验结果
由表2可以看出,6 份50 mg/mL的海藻酮糖标准品溶液进样后,出峰面积的RSD为2.46%,表明此提取方法重复性良好;同一份海藻酮糖标准品进样后,出峰面积的RSD为0.18%,表明色谱方法的精密度良好;不同时间测定3 份相同质量浓度的海藻酮糖标准品后,出峰面积的RSD为2.43%,表明此色谱方法在5 d内稳定性良好。
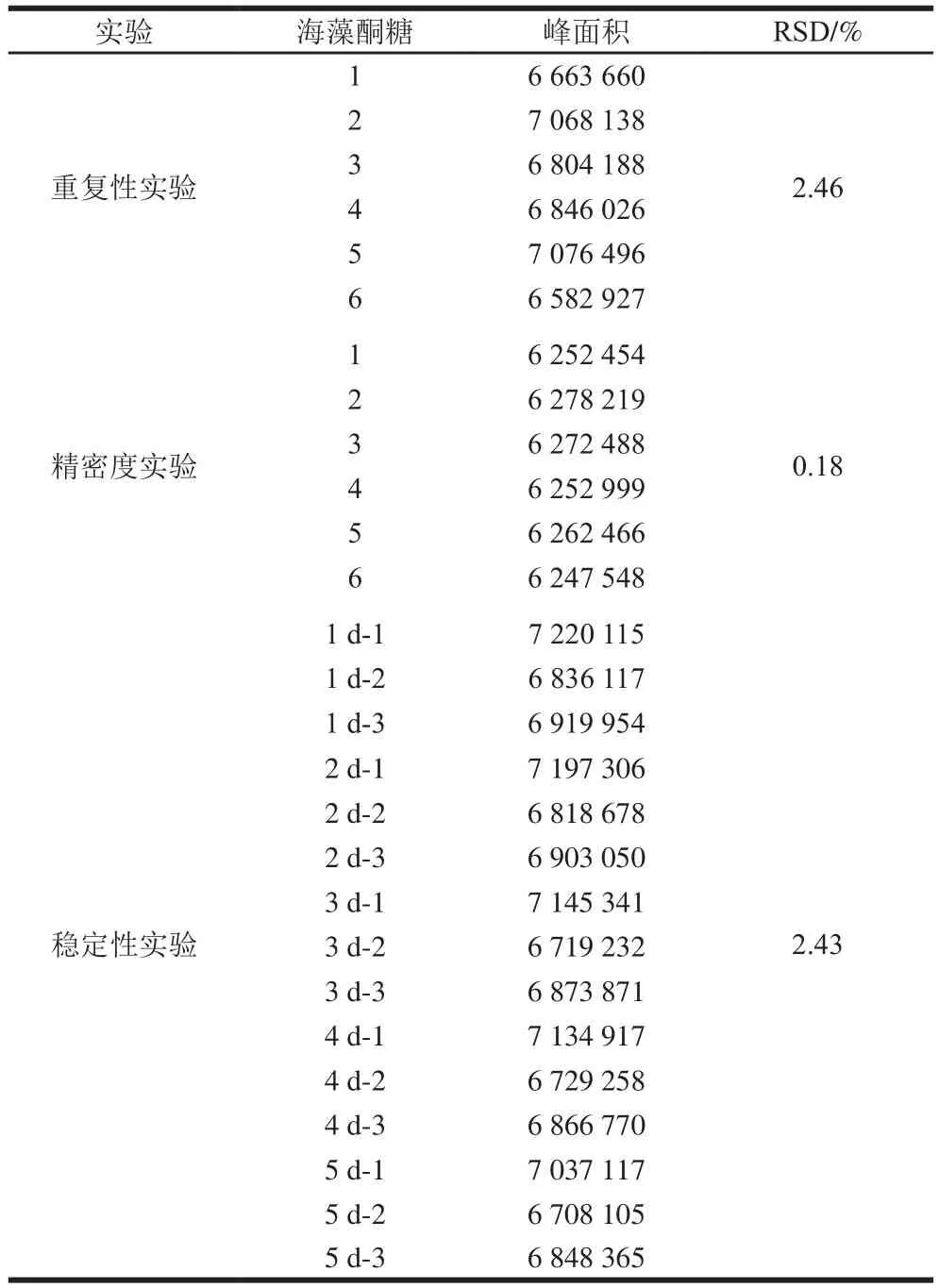
表2 50 mg/mL海藻酮糖标准品溶液的重复性、精密度、稳定性实验结果Table 2 Repeatability, precision and stability for the determination of 50 mg/mL trehalulose standard
2.3.4 回收率实验结果
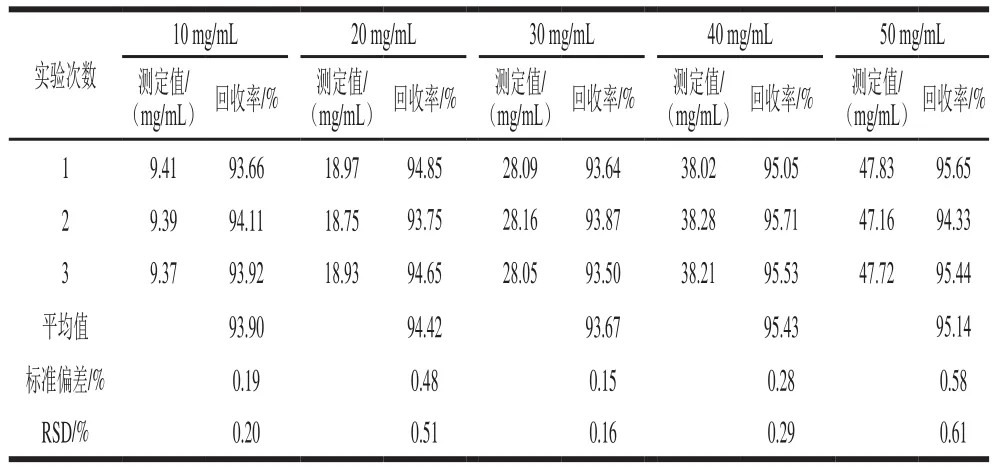
表3 果葡糖浆中海藻酮糖加标回收率数据(n=3)Table 3 Recoveries of trehalulose spiked into high fructose corn syrup (n = 3)
表3表明,不同添加量海藻酮糖在果葡糖浆中的加标回收率在93.50%~95.71%之间,RSD均不高于0.61%,说明本方法有较好的回收率,结果准确可靠。
2.4 无刺蜂蜂蜜样品中海藻酮糖含量测定
通过本实验建立的蜂蜜中海藻酮糖的检测方法,对不同蜂种、采集时间和地点的无刺蜂蜂蜜进行海藻酮糖含量的测定。1~6号样品为2020年5月在云南采集的黄纹无刺蜂蜂蜜,海藻酮糖质量分数为22.90%~30.82%;7~10号样品为2020年5月在云南采集的顶无刺蜂蜂蜜,海藻酮糖质量分数为17.30%~27.91%;11~13号样品为2020年5月和11月在云南采集的戈氏无刺蜂蜂蜜,海藻酮糖质量分数为19.72%~27.74%;14号样品为2020年11月在云南同一蜂场采集的黄纹无刺蜂、顶无刺蜂、戈氏无刺蜂的混合蜂蜜,海藻酮糖质量分数为24.03%;15和16号样品分别为2020年和2019年11月在海南同一蜂场采集的黄纹无刺蜂蜂蜜,海藻酮糖质量分数相似,分别为18.16%和18.52%;17~21号样品为2019年在马来西亚采集的无刺蜂蜂蜜,海藻酮糖质量分数为10.36%~20.92%;22~31号样品为2021年1月在云南采集的黄纹无刺蜂蜂蜜,海藻酮糖质量分数为6.97%~20.61%。
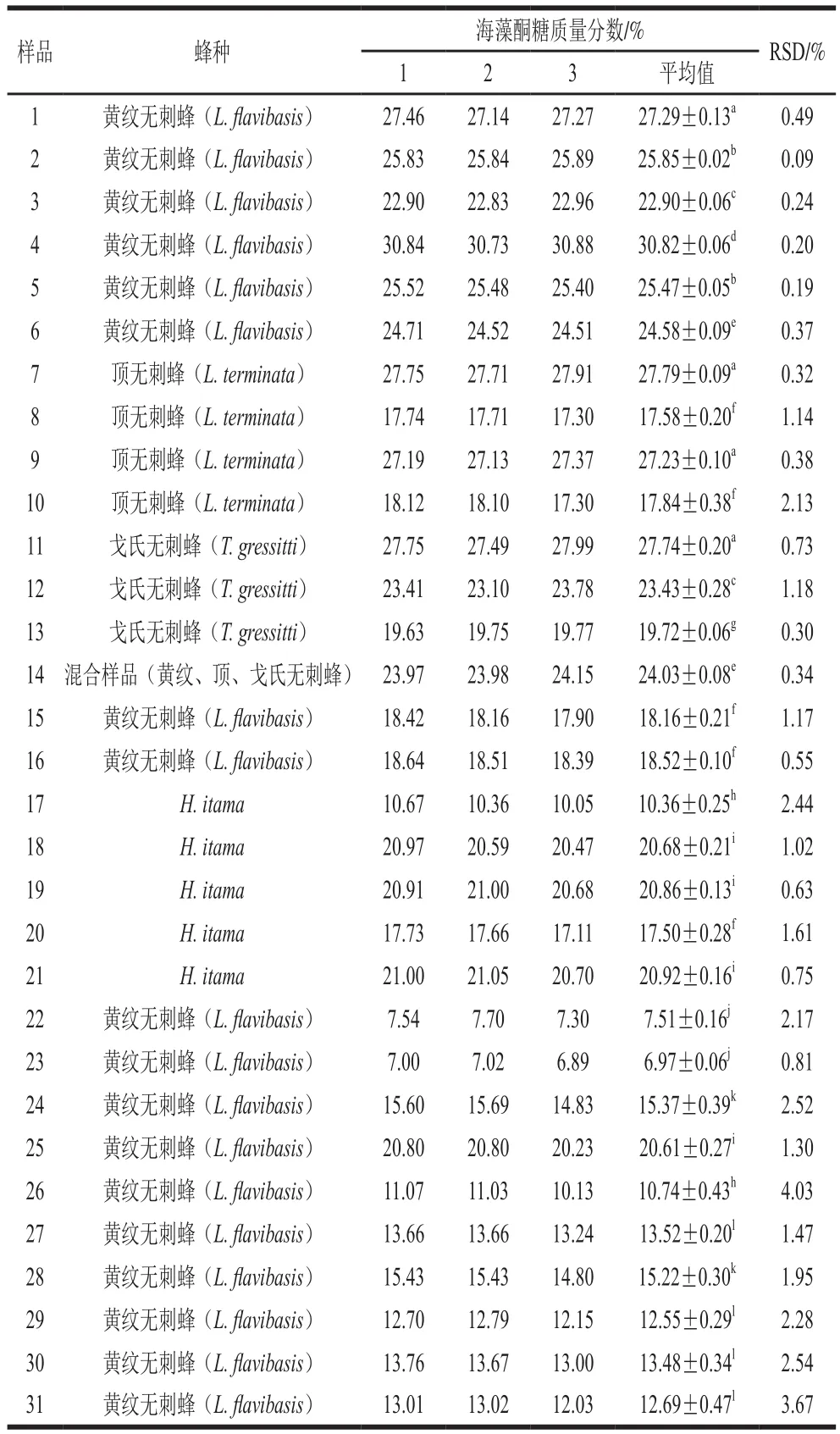
表4 无刺蜂蜂蜜样品中海藻酮糖含量测定结果Table 4 Contents of trehalulose in different stingless bee honey samples
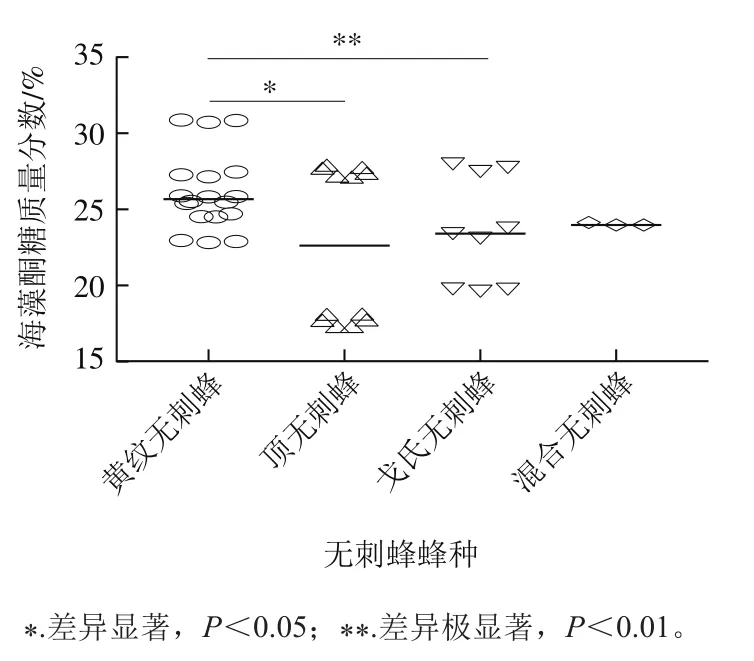
图4 不同种类无刺蜂蜂蜜中海藻酮糖含量Fig. 4 Contents of trehalulose in different stingless bee honey samples
文献中对于蜂蜜中海藻酮糖鲜有报道,Fletcher等运用核磁共振氢谱法确认海藻酮糖,并通过超高效液相色谱-串联四极杆质谱对来自澳大利亚(和)、马来西亚(和)和巴西()的5 种不同无刺蜂的蜂蜜进行检测,首次鉴定出不同寻常的海藻酮糖作为蜂蜜的主要成分,每100 g蜂蜜中含有13~44 g海藻酮糖。Popova等用核磁共振的方法鉴定出非洲无刺蜂蜂蜜中海藻酮糖质量分数大于20%,但我国无刺蜂蜂蜜研究鲜有报道。此结果与表4接近,由于采集的时间和地理环境和蜂种等有差异,2021年冬季于马来西亚和中国云南采集的无刺蜂蜂蜜样品中,海藻酮糖含量略低。
表4中,采集的所有蜂蜜样品海藻酮糖质量分数为7.0%~30.8%,与文献中报道的含量接近。可看出相同采集时间、蜂种和地区的蜂蜜在不同蜂巢中收集,测得的海藻酮糖含量有显著差异(<0.05)。14号混合无刺蜂蜂蜜样品海藻酮糖含量相对居中,15号和16号两年海南采集的样品中海藻酮糖含量相近。但相对于云南采集的样品,海南采集的样品中海藻酮糖含量较低,由于样品过少,需要后期用更多的样品进行实验分析。
2020年采集的黄纹无刺蜂蜂蜜中海藻酮糖含量明显高于2021年(<0.05)。从采集日期分析,2020年5月正值花蜜期,无刺蜂采集的花种类相对丰富,而2021年1月属于冬季,蜜源植物种类相对较少,这可能是海藻酮糖含量较低的原因之一。马来西亚和中国云南的无刺蜂蜂蜜中海藻酮糖含量没有显著差异,可能是由于这两个地区的无刺蜂蜂种习性相似,酿造出的蜂蜜中海藻酮糖含量差异不大。由图4可看出,从云南采集的不同蜂种无刺蜂蜂蜜样品中,黄纹无刺蜂蜂蜜中海藻酮糖含量显著高于顶无刺蜂(<0.05)和戈氏无刺蜂蜂蜜(<0.01),但与混合无刺蜂蜂蜜相似,表明海藻酮糖在不同无刺蜂种的蜂蜜中含量不同。此外,相同蜂种无刺蜂在不同蜂箱中海藻酮糖含量也具有差异,这需要采集大量的样本探究不同蜂种中海藻酮糖含量是否具有明显差异。
3 结 论
采用高效液相色谱-示差检测器法测定蜂蜜中海藻酮糖的含量,用纯水溶解蜂蜜样品,使用离子配体交换柱Hi-Plex Pb(300 mm×7.7 mm,8 μm)作为分离色谱柱,以纯水作流动相,流速0.5 mL/min,进样量10 μL,柱温50 ℃,示差检测池温度50 ℃,海藻酮糖质量浓度在0.5~50 mg/mL范围内线性良好,为0.999 6。通过高效液相色谱-电喷雾离子源四极杆飞行时间串联质谱检测可知,无刺蜂样品中保留时间为18.61 min的目标化合物是海藻酮糖。方法学检验证实海藻酮糖与其他糖类基线分离,本检测方法的回收率高、重复性好,其LOD为0.07 mg/mL,LOQ为0.22 mg/mL,加标回收率为93.50%~95.71%(RSD≤0.61%)。该方法简单快捷、定量准确,可以实现无刺蜂蜂蜜样品中海藻酮糖的准确定量分析,为我国无刺蜂蜂蜜品质评价提供了科学依据,同时本研究建立的检测方法也可为相关食品标准的开发提供参考。
