乳酸乳球菌乳亚种NCU036018细菌素的分离纯化及其抗菌机制
2022-09-01许晓燕熊世进肖沐岩
许晓燕,彭 珍,熊世进,肖沐岩,黄 涛,熊 涛
(南昌大学食品学院,食品科学与技术国家重点实验室,江西 南昌 330047)
金黄色葡萄球菌是常见的食源性病原菌之一,其产生的肠毒素等有害物质会导致食物中毒,主要污染源有乳、乳制品、肉及肉制品等。金黄色葡萄球菌是仅次于沙门氏菌和副溶血弧菌的第三大致病菌,其引起的食物中毒占食源性食物中毒事件的25%左右。近年来,越来越多滥用抗生素的行为导致了病原菌耐药性(antimicrobial resistance,AMR)的出现,进而提高了病原菌给食品和医药行业所带来的健康风险。预计到2050年,AMR每年将造成1 000万 人的死亡。而在食品行业中常用的防腐剂主要为化学合成防腐剂,对人体健康存在一定的安全隐患。因此,绿色天然的细菌素是最具潜力的化学防腐剂的安全替代品之一。细菌素是细菌核糖体产生的一类具有抑菌活性的蛋白类或多肽类物质。它可以通过特异型靶点和非特异性靶点破坏细胞膜的完整性和通透性,或进入细胞内影响DNA和蛋白质的正常代谢等抑制或杀死病原菌,但经人体摄入后可被胃肠道蛋白酶消化酶解,不会破坏肠道菌群的微生态平衡。
乳酸链球菌素是联合国粮农组织/世界卫生组织食品法典委员会在1969年唯一认定为安全的菌素,可作为食品添加剂。但乳酸链球菌素只能在一定的pH值范围内(pH 3.5~8.0)发挥作用,并且随着pH值和温度的升高,其活性也会下降。因此,相对于乳酸链球菌素,市场上更需要活力强且使用范围广的新型细菌素有效遏制致病菌的滋生,以推动食品防腐剂市场的发展。目前自然发酵泡菜已经成为分离产细菌素乳酸菌的重要渠道。例如,高兆建等从泡菜中筛选到1 株产细菌素的发酵乳杆菌,其产细菌素BLF52分子质量为5.6 kDa,并且在一定的温度和pH值范围内具有良好的稳定性,对金黄色葡萄球菌具有显著抑制作用。此外,Gao Yurong等也从传统发酵卷心菜中筛选到1 株格氏乳杆菌,其所产细菌素对革兰氏阴性菌和革兰氏阳性菌均具有抑制作用。但目前对分离自传统发酵泡菜中的乳酸乳球菌乳亚种所产细菌素的研究相对较少。本研究旨在对筛选自传统发酵泡菜中的乳酸乳球菌乳亚种所产细菌素进行分离鉴定,并探究其对金黄色葡萄球菌的抑菌机制,为食品级细菌素在食品行业和制药领域中的应用提供理论支撑。
1 材料与方法
1.1 材料与试剂
指示菌金黄色葡萄球菌()CMCC26003保藏于南昌大学国家食品科学与技术重点实验室。
MRS(de Man, Rogosa and Sharpe)培养基 广东环凯生物科技有限公司;胃蛋白酶、胰蛋白酶、蛋白酶K、-糜蛋白酶、木瓜蛋白酶、过氧化氢酶、脂肪酶、淀粉酶、磷酸盐缓冲液(phosphate buffered saline,PBS)、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)凝胶制备试剂盒 北京索莱宝科技有限公司;细菌基因组DNA提取试剂盒、SDS-PAGE蛋白上样缓冲液(2×)、碘化丙啶(propidium iodide,PI)染色试剂盒、低分子质量蛋白Marker 生工生物工程(上海)股份有限公司。
1.2 仪器与设备
聚合酶链式反应(polymerase chain reaction,PCR)仪美国Applied Biosysterms公司;酶标仪 赛默飞世尔科技有限公司;DM300B正置荧光显微镜 德国徕卡公司;凝胶电泳系统、凝胶成像系统 美国Bio-Rad公司;SP Sepharose Fast Flow手动纯化预装柱 武汉晶诚生物科技公司;Optima 8000 ICP-AES电感耦合等离子体发射光谱仪 美国珀金埃尔默仪器有限公司;冷场发射扫描电镜 日本JEOL公司。
1.3 方法
1.3.1 产细菌素乳酸菌的筛选
1.3.1.1 样品采集及乳酸菌分离
从市场上采集不同种类自然发酵的泡菜样本22 份。从泡菜样品中取1 mL泡菜液用无菌生理盐水进行梯度稀释,选取10、10、10三个梯度各100 μL分别涂布于MRS固体培养基(含溴甲酚紫)上,37 ℃倒置培养48 h。挑取培养基上不同形态的菌落进行连续划线分离。随后在培养基上挑取产黄色光晕且形态单一的菌落于10 mL MRS液体培养基中孵育24 h,将培养液和50%的无菌甘油按1∶1体积比混合并保存于-80 ℃。
1.3.1.2 产抑菌物质乳酸菌的筛选
将活化好的198 株乳酸菌疑似株以2%(/)的接种量接种到MRS液体培养基中,37 ℃培养24 h得到乳酸菌发酵液。将发酵液6 500×离心10 min后收集上清液,为了排除发酵液pH值对抑菌结果的影响,调节其pH 6.1±0.1并用0.22 μm微孔滤膜过滤,保存至4 ℃待用。
使用琼脂扩散法测定不同菌株发酵上清液的抑菌活性。简言之,将培养好的金黄色葡萄球菌加入LB(Luria-Bertani)固体培养基中使其浓度为1.0×10CFU/mL,混匀后倒平板,待冷却凝固后打孔(6 mm),每皿3 个孔,向每孔中加入200 μL制备好的上述分离菌株的发酵上清液,37 ℃下培养14~16 h,根据抑菌圈直径大小筛选抑菌性能优异的菌株。
1.3.1.3 产细菌素乳酸菌的16S rDNA鉴定
使用细菌DNA提取试剂盒对抑菌性能优异的乳酸菌菌株进行基因组DNA的提取。以细菌通用引物27 F(5’-AGAGTTTGATCMTGGCTCAG-3’)和1492 R(5’-GGTTACCTTGTTACGACTT-3’)进行PCR扩增。将PCR产物送至生工生物工程(上海)股份有限公司进行测序,将所得序列在NCBI数据库中使用BLAST工具进行同源性比较,将测序结果导入MEGA5.2中,采用Neighbor-Joining构建系统发育树。
1.3.2 抑菌物质性质的初步探索
参照1.3.1.2节方法制备复筛出的抑菌优异菌株的发酵上清液,将上清液分别在不同温度(60、70、80、90、100 ℃水浴和121 ℃高压蒸汽)处理30 min;不同pH值(2、3、4、5、6、7、8、9、10)处理2 h,之后调回pH 6.1;不同酶(过氧化氢酶、淀粉酶、脂肪酶、胃蛋白酶、胰蛋白酶、木瓜蛋白酶、蛋白酶K、-糜蛋白酶)处理2 h,随后于100 ℃灭活5 min,酶的最终质量浓度为1 mg/mL。以未处理的发酵上清液作为对照。采用琼脂扩散法测定不同处理组的抑菌活性,探究不同处理条件对乳酸乳球菌乳亚种NCU036018无菌发酵上清液抑菌活性的影响。
1.3.3 乳酸乳球菌乳亚种NCU036018生长及抑菌活性曲线
活化后的乳酸乳球菌乳亚种NCU036018按照2%(/)比例接种于新鲜的MRS液体培养基中,在37 ℃条件下静置培养36 h,每2 h取样一次,分别测试发酵液的OD、pH值、无细胞发酵上清液的抑菌活性(琼脂孔扩散法)。观察乳酸乳球菌乳亚种NCU036018在发酵过程中生长曲线、pH值和产细菌素的关系,确定细菌素的最适发酵时间。
1.3.4 细菌素的分离纯化
1.3.4.1 硫酸铵沉淀
向制备好的乳酸乳球菌乳亚种NCU036018发酵上清液中缓慢添加硫酸铵,使溶液中硫酸铵饱和度分别为20%、40%、50%、60%、70%、80%,低温磁力搅拌过夜,4 ℃、8 000×离心15 min,弃去上清液,收集沉淀,并复溶于甲酸铵缓冲盐溶液(0.01 mol/L、pH 3.5)中,琼脂扩散法测定抑菌活性,确定最适的硫酸铵饱和度。
1.3.4.2 超滤
将复溶后的细菌素粗提物转移至超滤管中,分别先后通过截留分子质量为30、10、3 kDa的超滤管进行超滤截留(4 ℃、3 500×、25 min),收集不同的组分,采用琼脂扩散法检测不同组分的抑菌活性。
1.3.4.3 SP Sepharose Fast Flow纯化
选择具有抑菌活性的超滤组分采用Sepharose Fast Flow琼脂糖凝胶柱(1.5 cm×10 cm)进行层析。20 mmol/L、pH 6.0的磷酸缓冲液充分平衡后,采用不同浓度的NaCl(0~1 mol/L)进行线性梯度洗脱,流速1 mL/min。将洗脱液进行真空冷冻干燥并复溶于ddHO中,采用点种法确定具有抑菌活性的洗脱组分,以获得较高纯度的细菌素。
1.3.4.4 Tricine-SDS-PAGE分子质量测定及凝胶原位抑菌检测
将Marker和预处理过的细菌素样品依次加入上样孔中进行SDS-PAGE,两块凝胶同时进行。电泳完成后将其中一块凝胶转移至考马斯亮蓝G-250染液中染色6 h,随后转移至脱色液中脱色6 h。观察样品条带位置并确定其分子质量。另外一块凝胶浸泡于洗涤液(异丙醇∶乙酸∶水=5∶2∶13),洗涤6~8 h,再用无菌水洗6 h,最后转移至无菌培养皿中,覆盖上一层含有金黄色葡萄球菌的LB固体培养基,37 ℃培养14~16 h,观察条带位置是否具有抑菌活性。
1.3.5 乳球菌素036018的抑菌机制
1.3.5.1 乳球菌素036018对金黄色葡萄球菌的最小抑菌浓度
将制得的乳球菌素036018溶液用PBS以两倍稀释法逐步稀释2、4、8、16、32、64、128、256、512、1 024、2 048 倍。以金黄色葡萄球菌为指示菌,采用琼脂扩散法测定抑菌活性。以肉眼观察到产生抑菌圈最小的浓度为乳球菌素036018对金黄色葡萄球菌的最小抑菌浓度(minimum inhibitory concentration,MIC)。
1.3.5.2 乳球菌素036018对金黄色葡萄球菌生物膜形成的抑制
参照Pei Jinjin等的方法进行金黄色葡萄球菌生物膜形成的测定。6 500×、4 ℃离心10 min收集稳定期金黄色葡萄球菌,用LB培养基重悬至OD为0.1,吸取100 μL重悬液至96 孔板中,加入等体积的乳球菌素036018溶液于37 ℃孵育24 h,以PBS处理的菌悬液为阴性对照。小心除去未附着的细胞,PBS洗涤3 次后甲醇固定10 min,风干后再加入200 μL 0.1%的结晶紫室温染色30 min。用PBS洗涤3 次除去多余的结晶紫。在每孔中加入200 μL 95%乙醇溶液溶解附着的结晶紫,用酶标仪测600 nm波长处OD值,PBS为空白对照,生物膜形成率按照下式计算:
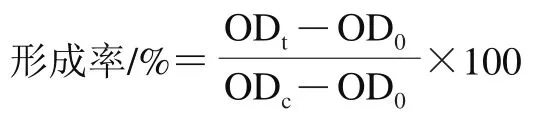
式中:OD为阴性对照组;OD为实验组24 h后吸光度;OD为空白对照组。
1.3.5.3 K泄漏
K浓度的测定按照段改丽的方法并进行一定修改。6 500×、4 ℃离心10 min收集稳定期金黄色葡萄球菌。PBS洗涤2 次后重悬至OD为0.5,加入等体积乳球菌素036018溶液于37 ℃孵育0、0.5、1、2、3 h,PBS进行相同处理的金黄色葡萄球菌作为对照组,使用电感耦合等离子体发射光谱仪检测上清液中K浓度。
1.3.5.4 PI染色
采用Lu Yingying等的方法进行PI染色。6 500×、4 ℃离心10 min收集稳定期金黄色葡萄球菌,用PBS重悬菌体后,按照1∶1比例加入乳球菌素036018溶液分别处理0.5、1、2 h。之后用PBS缓冲液洗涤菌体2 次,重悬细胞并调整浓度为10CFU/mL,取95 μL细胞重悬液加入5 μL PI染色液,混匀后室温避光孵育5~30 min,在荧光显微镜下观察菌体染色情况。
1.3.5.5 扫描电子显微镜观察
根据Lv Xin等的方法利用扫描电镜观察细胞形态。离心收集稳定期金黄色葡萄球菌菌体,PBS洗涤两次,重悬于等体积乳球菌素036018溶液中分别处理30 min、1 h、2 h。6 500×、4 ℃离心10 min收集菌体,用PBS洗涤2 次。加入2.5%戊二醛4 ℃固定过夜。6 500×、4 ℃离心5 min收集菌体,无菌水洗涤3 次。依次使用系列体积分数梯度乙醇(30%、50%、70%、80%、90%、100%、100%、100%)脱水。随后将悬浮在100%乙醇中的菌体转移到干净的硅片上,室温晾干后喷金,以PBS进行相同处理作为对照,通过冷场发射扫描电镜观察菌体的表面结构。
1.3.6 乳球菌素036018在牛奶中的应用
6 500×、4 ℃离心5 min收集稳定期金黄色葡萄球菌,用生理盐水重悬并调节其浓度为2×10CFU/mL,取1 mL菌悬液加入9 mL的巴氏灭菌牛奶中。再分别加入乳球菌素036018溶液使其浓度分别为2、4、8 倍MIC。充分混匀后放于4 ℃贮藏12 h,每隔2 h取样计活菌数。分别加入等体积PBS作为阴性对照。
1.4 数据处理与统计分析
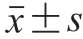
2 结果与分析
2.1 产细菌素乳酸菌鉴定
从发酵泡菜中筛选到的乳酸菌分离株D1对金黄色葡萄球菌具有显著抑菌活性,如图1所示,该菌株在MRS固体平板上菌落形态较小,白色圆润光滑,圆形凸起,边缘整齐有光泽;在油镜下呈卵圆状,成对排列,革兰氏染色呈阳性。
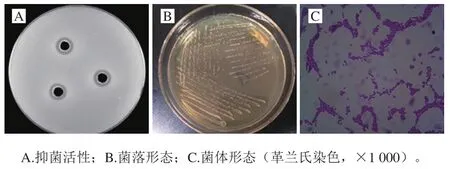
图1 菌株D1的分离鉴定Fig. 1 Isolation and identification of strain D1
生理生化结果显示,菌株D1过氧化氢酶阴性,能发酵葡萄糖、半乳糖、麦芽糖和甘露醇,不能利用菊糖,不能在45 ℃条件下生长,不耐4%的NaCl。
16S rDNA鉴定结果显示(图2),菌株D1与乳酸乳球菌乳亚种相似度达100%,结合生理生化实验确定菌株D1为乳酸乳球菌乳亚种,并将其命名为乳酸乳球菌乳亚种NCU036018。
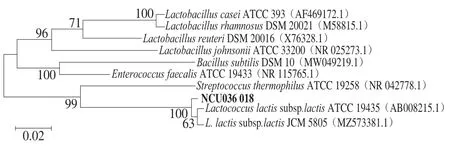
图2 乳酸乳球菌乳亚种NCU036018的系统发育树Fig. 2 Phylogenetic tree of strain L. lactis subsp. lactis NCU036018
2.2 乳酸乳球菌NCU036018发酵上清液抑菌分析
2.2.1 pH值对发酵上清液抑菌活性的影响
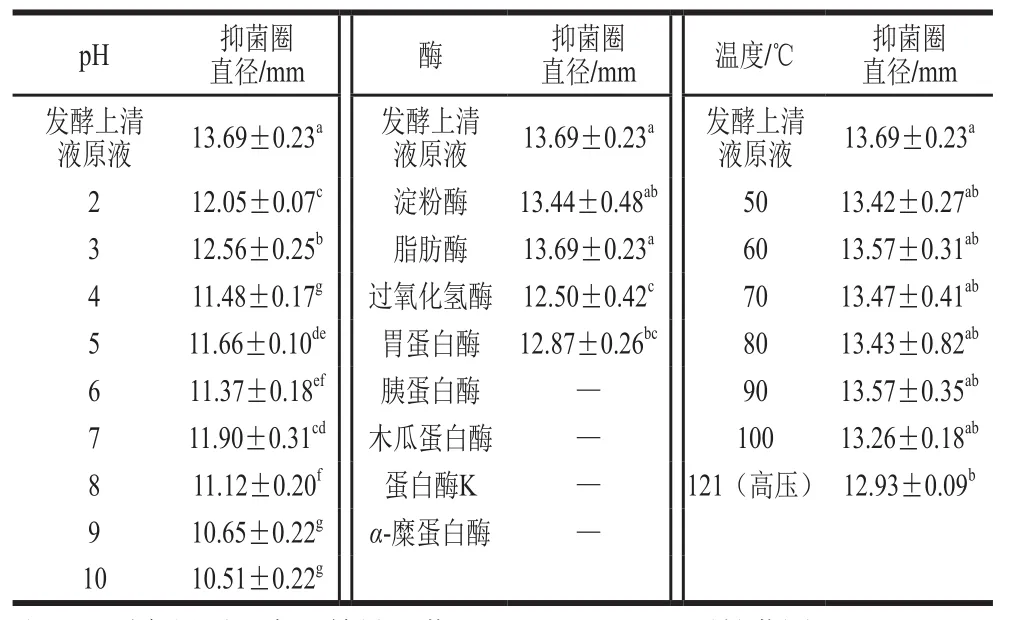
表1 温度、pH值、酶处理对乳酸乳球菌乳亚种NCU036018发酵上清液抑菌活性的影响Table 1 Effects of temperature, pH and enzyme treatment on the antibacterial activity of the fermentation supernatant of L. lactis subsp. lactis NCU036018
由表1可知,随着pH值的升高,乳酸乳球菌乳亚种NCU036018发酵上清液的抑菌活性呈现出显著下降趋势(<0.05),但在pH 10时仍保留了70%以上的活性,说明该抑菌成分具有较好的pH值稳定性。
2.2.2 酶处理对发酵上清液抑菌活性的影响
如表1所示,乳酸乳球菌乳亚种NCU036018发酵上清液经淀粉酶和脂肪酶处理后,抑菌活性无显著变化(<0.05),经过氧化氢酶及胃蛋白酶处理后抑菌活性略有下降,经胰蛋白酶、木瓜蛋白酶、蛋白酶K和-糜蛋白酶处理后抑菌活性完全丧失。由此可以初步确定乳酸乳球菌乳亚种NCU036018发酵上清液主要抑菌成分可能是蛋白类物质。
2.2.3 温度发酵上清液抑菌活性的影响
乳酸乳球菌乳亚种NCU036018发酵上清液经121 ℃高温高压处理后其抑菌活性略有下降,但仍保留了90%以上(<0.05),50~100 ℃等不同温度处理后抑菌活性无显著变化。说明乳酸乳球菌乳亚种NCU036018发酵上清液中抑菌物质的热稳定性良好,可能为耐热的乳酸乳球菌素。
2.3 乳酸乳球菌乳亚种NCU036018生长及抑菌活性曲线
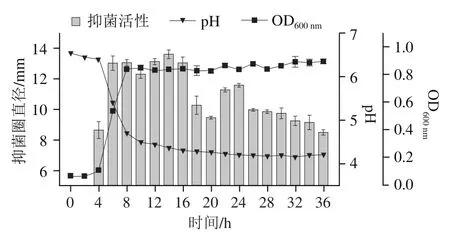
图3 乳酸乳球菌乳亚种NCU036018生长曲线与抑菌活性间的关系Fig. 3 Relationship between growth curve and antibacterial activity of L. lactic subsp. lactis NCU036018
如图3所示,乳酸乳球菌乳亚种NCU036018在MRS液体培养基中培养4 h左右进入对数期,8 h左右进入稳定期。发酵液pH值先快速下降随后逐渐稳定在4.2左右。发酵上清液抑菌活性随培养时间呈先上升后下降的趋势,在14 h处达到峰值,抑菌圈直径为13.60 mm,此时为细菌素的最佳收获时间,这与已有研究结果相似。细菌素一般为次级代谢产物,通常是发酵中后期代谢产物,但也有文献报道某些细菌素为初级代谢产物。此外,发酵后期(18~36 h)上清液的抑菌活性显著降低,这可能与菌体释放的一些水解酶有关。
2.4 细菌素分离纯化
2.4.1 硫酸铵沉淀
如表2所示,随着硫酸铵饱和度的上升,乳酸乳球菌乳亚种NCU036018发酵上清液沉淀物的抑菌活性先上升后下降。在饱和度为70%时,其对金黄色葡萄球菌的抑菌活性达到最强,抑菌圈直径为13.96 mm。因此,后续选择70%的硫酸铵进行盐析。

表2 不同饱和度硫酸铵沉淀物的抑菌活性Table 2 Antibacterial activity of precipitates induced by ammonium sulfate at different concentrations
2.4.2 超滤
硫酸铵沉淀蛋白复溶物经超滤后得到4 个组分,其对金黄色葡萄球菌的抑菌活性见表3,其中截留分子质量为10~30 kDa的组分抑菌圈最大,具有最强的抑菌活性,推测纯化的目的细菌素蛋白分子质量在10~30 kDa范围内。
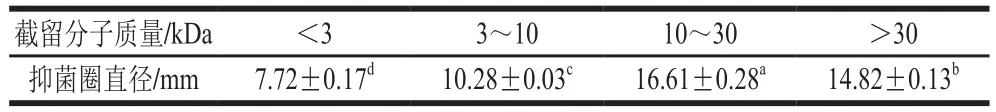
表3 不同截留分子质量组分的抑菌活性Table 3 Antibacterial activity of ultrafiltration fractions with different molecular mass cut-offs
2.4.3 SP Sepharose Fast Flow纯化
大多数细菌素表现出一种阳离子结构,富含带正电的精氨酸和赖氨酸残基,有利于这些多肽和微生物细胞膜之间的相互作用。因此,可通过阳离子交换层析对细菌素进行纯化。如图4所示,0.2 mol/L NaCl洗脱组分具有较高的抑菌活性,说明该组分中含有目的抑菌蛋白。
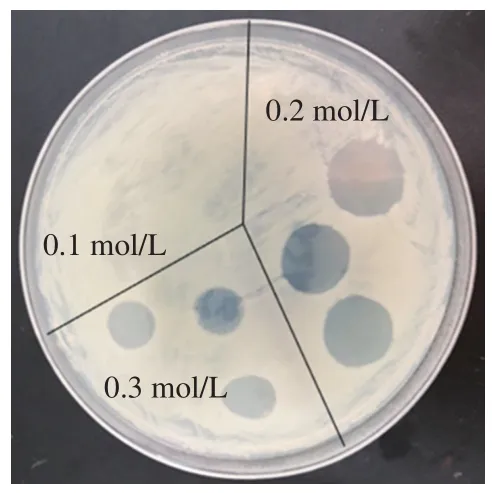
图4 不同浓度洗脱液对金黄色葡萄球菌的抑菌活性Fig. 4 Antibacterial activity of the eluate at different concentrations against S. aureus
2.4.4 Tricine-SDS-PAGE
将0.2 mol/L NaCl溶液洗脱下来的组分除盐后经Tricine SDS-PAGE分析,观察到泳道上出现较为单一的蛋白条带,分子质量在14.4~20 kDa范围内,见图5。凝胶原位抑菌结果显示出清晰的抑菌带,对应于左侧蛋白电泳条带,表明纯化获得的样品为细菌素,并将其命名为乳球菌素036018。一些研究人员从不同的菌株中纯化出分子质量各异的细菌素,如Ahmad等从sp.中分离的细菌素为51 kDa、Wayah等分离自SPW1的细菌素为1 221.074 Da、Ahn等分离自HW01的细菌素为6 kDa。而分子质量在14.4~20 kDa范围内的乳酸乳球菌素鲜见报道,因此乳球菌素036018可能是一种新型细菌素。

图5 乳球菌素036018的Tricine-SDS-PAGE和对应位置抑菌活性的检测Fig. 5 Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE) analysis of lactococcin 036018
2.5 乳球菌素036018抑菌机制分析
2.5.1 乳球菌素036018对金黄色葡萄球菌的MIC
如表4所示,当乳球菌素036018稀释倍数为128 倍时,出现了肉眼可见的最小抑菌圈,直径为(7.78±0.12)mm。因此,乳球菌素036018对金黄色葡萄球菌的MIC为0.50 mg/mL。
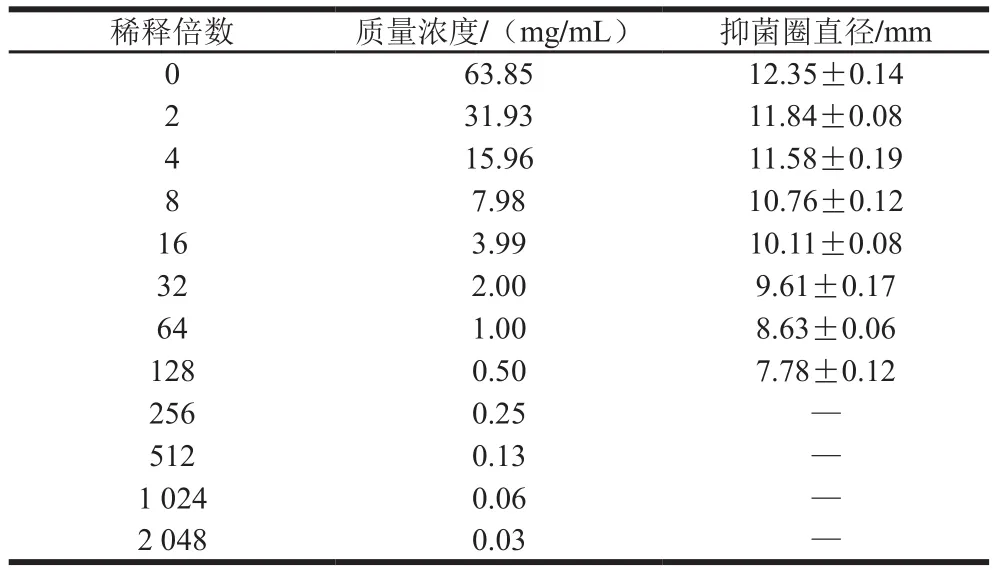
表4 不同稀释倍数下细菌素粗提物抑菌活性Table 4 Antibacterial activity of crude bacteriocin extract at different dilution ratios
2.5.2 乳球菌素036018对金黄色葡萄球菌生物膜形成的影响
生物膜是微生物在器皿和非器皿表面形成的有结构的微生物聚集体,是食品的一个重要潜在污染源。一些致病菌在食品表面进行定植形成一层生物膜屏障外界的不利环境从而发挥致病作用。如图6所示,与对照组相比,经乳球菌素036018处理后,金黄色葡萄球菌生物膜的形成率降至25.51%,说明乳球菌素036018对金黄色葡萄球菌生物膜的形成有较强的抑制作用,可以降低其致病能力。
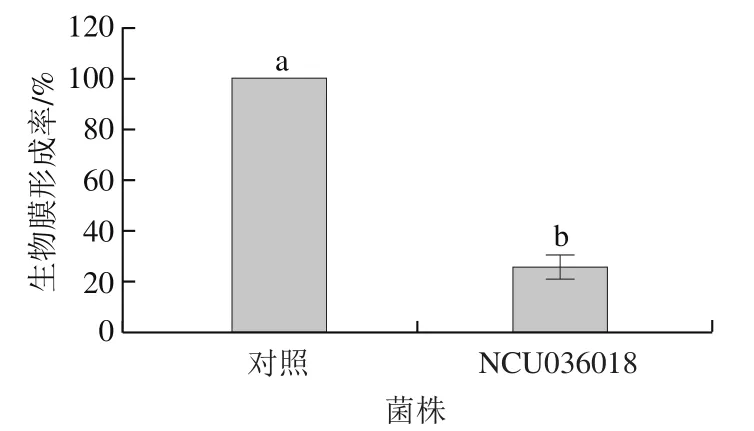
图6 乳球菌素036018处理后对金黄色葡萄球菌生物膜形成的影响Fig. 6 Effect of lactococcin 036018 treatment on the biofilm formation of S. aureus
2.5.3 K泄露
如图7所示,随着乳球菌素036018处理时间的延长,金黄色葡萄球菌细胞外K质量浓度呈上升趋势,且远高于对照组水平。因此,乳球菌素036018可能破坏了金黄色葡萄球菌细胞膜的完整性导致K向胞外释放。其他的细菌素也具有相同的报道,如抗菌肽AMP-jsa9、植物乳杆菌素GZ1-27、抗菌肽F1均通过破坏细胞膜通透性导致K泄漏。对照组在0~120 min内胞外钾离子水平相对稳定在较低水平,而在120~180 min内有较大幅度的上升,可能是因为培养时间过长,菌体在无营养条件下自身死亡从而释放出胞内K所导致。
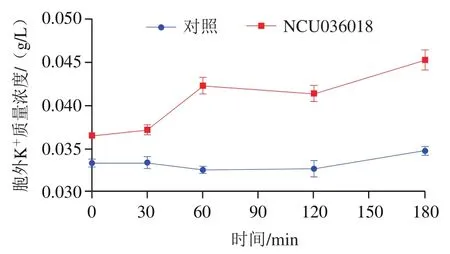
图7 乳球菌素036018及PBS处理的金黄色葡萄球菌细胞外K+质量浓度变化Fig. 7 Changes in extracellular potassium ion concentration in lactococcin 036018- or PBS-treated S. aureus
2.5.4 PI染色

图8 荧光显微镜下金黄色葡萄球菌细胞膜的损伤情况Fig. 8 Damage of S. aureus cell membrane observed by fluorescence microscopy
PI是一种可穿透受损细胞并能与其DNA非特异性结合的活性荧光染料。PI不能透过完整细胞膜,但当细胞膜损伤时,它可进入细胞内与DNA结合呈现出红色。因此,细胞膜损伤可通过PI染色法判断。由图8可知,红色的金黄色葡萄球菌的数量随着乳球菌素036018处理时间的延长而明显增加,而对照组则无明显变化。结果说明乳球菌素036018处理之后金黄色葡萄球菌的细胞膜造成损伤,通透性增加,并且具有时间依赖性。
2.5.5 扫描电子显微镜观察
如图9所示,对照组的细胞结构完整饱满,表现出典型的球状、光滑的细胞膜特征。乳球菌素036018处理不同时间后,金黄色葡萄球菌细胞形态发生明显变化:0.5 h后细胞表面出现轻微皱缩和凹陷;处理时间延长至1 h时,细胞表面有明显的孔洞和大范围的皱缩;处理时间为2 h时,细胞开始表面出现裂纹甚至破碎,有的细胞开始发生溶解。这些结果表明,乳球菌素036018能以时间依赖性方式破坏金黄色葡萄球菌细胞膜结构甚至使其溶解。

图9 乳球菌素036018处理后金黄色葡萄球菌细胞形态变化Fig. 9 Morphological changes of S. aureus CMCC26003 treated with lactococcin 036018 observed by scanning electron microscopy
2.6 乳球菌素036018在牛奶中防腐能力评价
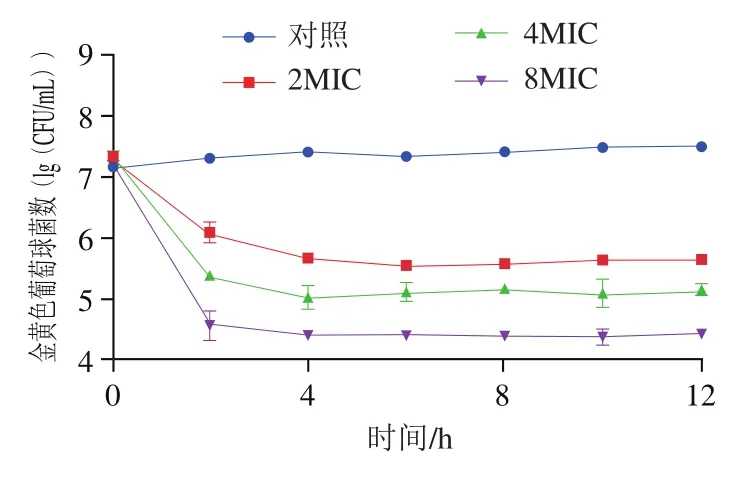
图10 乳球菌素036018在4 ℃巴氏杀菌牛奶中对金黄色葡萄球菌的抑制Fig. 10 Inhibitory effect of lactococcin 036018 on inoculated S. aureus in pasteurized milk during storage at 4 ℃
为了验证乳球菌素036018作为食品基质中生物防腐剂的适用性。将乳球菌素036018加入金黄色葡萄球菌污染的牛奶中观察其防腐效果。如图10所示,接种金黄色葡萄球菌的牛奶于4 ℃贮存12 h后,对照组菌落数略有升高,但不同浓度乳球菌素036018均在2 h内表现出显著的抑制作用(<0.05),且存在剂量依赖,随后菌落数均趋于稳定。其中,8MIC乳球菌素036018的处理有效降低了3 个数量级的金黄色葡萄球菌。这些数据表明,乳球菌素036018是一种有潜力的生物防腐剂,可以在运输和保藏过程中控制乳制品中的金黄色葡萄球菌数量。
3 结 论
从传统发酵泡菜中分离出1 株产细菌素的乳酸乳球菌乳亚种NCU036018,其发酵上清液对金黄色葡萄球菌具有显著的抑制作用,且对pH值、温度稳定,对胰蛋白酶、木瓜蛋白酶、蛋白酶K、-糜蛋白酶敏感,推测其抑菌成分为细菌素。通过硫酸铵沉淀、超滤、阳离子交换层析纯化出细菌素乳球菌素036018,其分子质量为14.4~20 kDa,MIC为0.50 mg/mL。乳球菌素036018能有效抑制金黄色葡萄球菌生物膜的形成,可通过破坏细胞膜完整性、改变膜通透性抑制金黄色葡萄球菌。此外,乳球菌素036018在牛奶基质中能有效抑制金黄色葡萄球菌的生长。综上,细菌素乳球菌素036018具备作为生物防腐剂在食品中应用的潜力。
