芍药PlHSP70和PlDanJ基因的克隆及表达分析
2022-08-31贺丹华超何松林曹健康张明星张佼蕊刘艺平
贺丹,华超,何松林,曹健康,张明星,张佼蕊,刘艺平,3
(1.河南农业大学风景园林与艺术学院,河南 郑州 450002;2.河南科技学院园艺园林学院,河南 新乡 453003;3.河南省优质花卉蔬菜种苗工程研究中心,河南 郑州 450002)
芍药(Paeonialactiflora)与牡丹(Paeoniasuffruticosa)同属于芍药科芍药属,其花朵硕大、花色艳丽,观赏性高[1-2]。芍药属品种丰富,其远缘杂交后代具有形态优美、茎秆挺拔、花头直立等特点,具有较强的抗性[3-6]。但芍药属的远缘杂交存在严重的不亲和现象,具体表现为花粉与柱头识别困难、花粉萌发与花粉管生长困难等[7-9]。因此,探究芍药属组间远缘杂交授粉后,花粉在柱头上的萌发与生长机制是芍药属育种的关键。
热激蛋白(heat shock proteins,HSPs)又称热休克蛋白,是一类植物面对非生物胁迫下具有保护作用的应激蛋白[10-11]。HSP70作为热激蛋白中最保守的家族,在防止蛋白质聚合、协助折叠错误的蛋白质重新折叠等方面起着重要作用[12-13]。DnaJ蛋白又称为 HSP40蛋白,作为HSP70的辅助伴侣分子,可以协助HSP70完成蛋白折叠、解折叠等多种生命活动进程,还可以直接促进 HSP70 的ATP 酶活性[14-16]。有研究表明,HSP在花粉萌发与花粉管生长中具有重要作用,将HSP转基因烟草和棉花与野生型植株、转基因空株对比,转基因植株花粉的萌发率和花粉管伸长显著提高[17]。对拟南芥进行热处理后,发现HSP同源蛋白在花粉管中的表达水平显著提高,当敲除该同源蛋白后,花粉管的生长则出现了显著的滞后,因此,推测HSP家族基因在花粉管的生长发育中起着重要的调控作用[18]。但是,有关HSP家族基因对芍药花粉发育的调控作用未见报道。本研究以芍药‘粉玉奴’的柱头为试验材料,基于河南农业大学牡丹资源与育种课题组的远缘杂交不亲和转录组数据进行HSP家族基因的筛选和分析,并利用RACE技术克隆PlHSP70和PlDanJ基因进行生物信息学分析,以期在芍药属远缘杂交中,阐明HSP基因对花粉生长的调控作用,为进一步探究芍药属远缘杂交不亲和机制提供一定的理论基础。
1 材料与方法
1.1 材料
本研究试验材料均采自于河南省优质花卉蔬菜种苗工程研究中心,取芍药‘粉玉奴’自交授粉和芍药‘粉玉奴’×牡丹‘凤丹白’杂交授粉后2、4、6、8、10、12、24和36 h的柱头,并于2021年3月采集芍药的叶、茎,4月采集芍药的根、花芽、花、柱头。每个样品取0.2 g,3次重复,液氮速冻后存储于-80 ℃冰箱备用。
1.2 方法
1.2.1 转录组中热激蛋白家族基因分析 基于前期研究的转录组数据(登录号:PRJNA592882),筛选出芍药HSP家族基因,并根据转录组中基因的表达量(FPKM)绘制热图并进行分析。利用拟南芥在线网站TAIR(https://www.Arabidopsis.org/)筛选拟南芥HSP家族基因,同时使用MEGA7软件对芍药、拟南芥这2个物种的HSP家族基因的氨基酸序列构建系统进化树。
1.2.2PlHSP70、PlDanJ基因克隆 本试验使用改良的CTAB法提取芍药‘粉玉奴’柱头RNA[19]。RNA反转录使用PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒(TaKaRa,日本),设置3次重复,将RNA反转录成cDNA第一链,产物放于-20 ℃冰箱储存。
依据芍药转录组数据(登录号:PRJNA592882)中筛选的HSP70和DanJ基因序列信息,运用NCBI在线网站搜索同源序列并进行基因比对,依据比对结果选取同源性高的序列用于设计特异性引物(表1)。以cDNA第一链为模板,进行PCR中间序列扩增。使用25μL反应体系:2×GC Buffer I 12.5 μL,Primer F 0.5μL,Primer R 0.5 μL,dNTP 0.2 μL,cDNA 1μL,Taq酶0.2μL,ddH2O 10.1μL。PCR循环条件:95 ℃预变性3 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸90 s,共设33个循环;72 ℃修复延伸7 min。利用RACE克隆方法[20],并通过DNAMAN软件拼接,获得PlHSP70与PlDanJ2条基因cDNA全长序列。
1.2.3 生物信息学分析 运用NCBI数据库中的Blast工具分别对PlHSP70和PlDanJ基因进行序列比对分析;通过在线网址TMPRED预测PlHSP70和PlDanJ蛋白质的跨膜区域;使用GOR4在线预测PlHSP70和PlDanJ蛋白二级结构,并使用网址Swiss-model进行PlHSP70和PlDanJ蛋白三级结构预测;运用DNAMAN9.0软件进行同源氨基酸序列比对;使用MEGA7软件,按照邻近法构建系统树[21]。
1.2.4PlHSP70与PlDanJ基因的表达分析 本试验分别以芍药‘粉玉奴’自交授粉和芍药‘粉玉奴’×牡丹‘凤丹白’杂交授粉后2、4、6、8、10、12、24和36 h的柱头以及芍药‘粉玉奴’根、茎、叶、花、芽、柱头的cDNA 为模板,根据基因序列设计实时荧光定量引物,以β-Tubulin为内参基因(表1),反应体系与程序设置参照HE等[22]方法进行,并设置3个重复,根据2-△△Ct法计算出基因的相对表达量[23]。

表1 芍药PIHSP70与PIDanJ基因克隆及荧光定量 PCR 所用引物Table 1 Cloning of PIHSP70 and PIDanJ genes from Paeonia lactiflora and primers for quantitative PCR
2 结果与分析
2.1 芍药HSP家族基因分析
2.1.1 转录组中芍药HSP家族基因表达模式 依据转录组数据,通过差异表达分析筛选出20个热激蛋白基因(图1)。HSP70家族基因的表达量在自交24 h时高于杂交24 h。HSP90以及DanJ家族基因在杂交36 h时的表达量显著高于杂交24 h。目的基因Unigene40632_All(PlHSP70)在杂交36 h的表达量显著高于杂交24 h,目的基因CL9793.Contig5_All(PlDanJ)在杂交24 h的表达量显著高于杂交36 h,与其他DanJ家族基因具有显著差异。
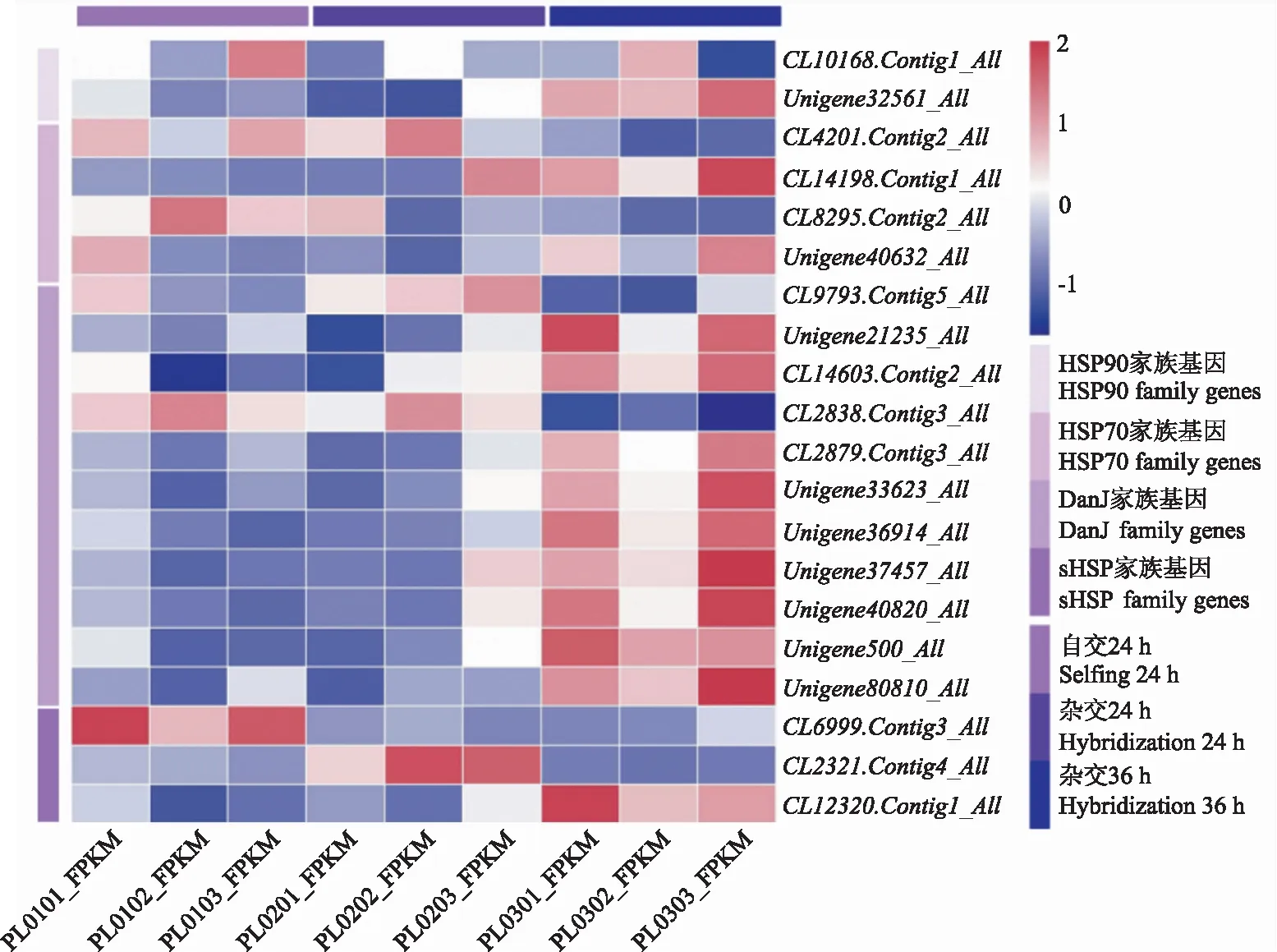
PL0101、PL0102、PL0103为自交24 h柱头的表达量,PL0201、PL0202、PL0203为杂交24 h柱头的表达量,PL0301、PL0302、PL0303为杂交36 h柱头的表达量,图中的9组样品结果已进行标准化处理。PL0101,PL0102,PL0103 are the expression levels of stigma at 24 h of selfing,PL201,PL202,PL203 are the expression levels of stigma at 24 h of hybridization,PL301,PL302,PL303 are the expression levels of stigma at 36 h of hybridization.
2.1.2 芍药HSP基因家族系统进化树分析 利用MEGA7对筛选的29个芍药HSP家族基因成员和32个拟南芥HSP家族基因成员构建系统发育进化树(图2)。整个系统发育树可以分为5个小簇,每个小簇均有芍药热激蛋白分布。目的基因Unigene40632_All(PlHSP70)位于第Ⅳ个小簇,目的基因CL9793.Contig5_All(PlDanJ)聚在第Ⅴ个小簇。
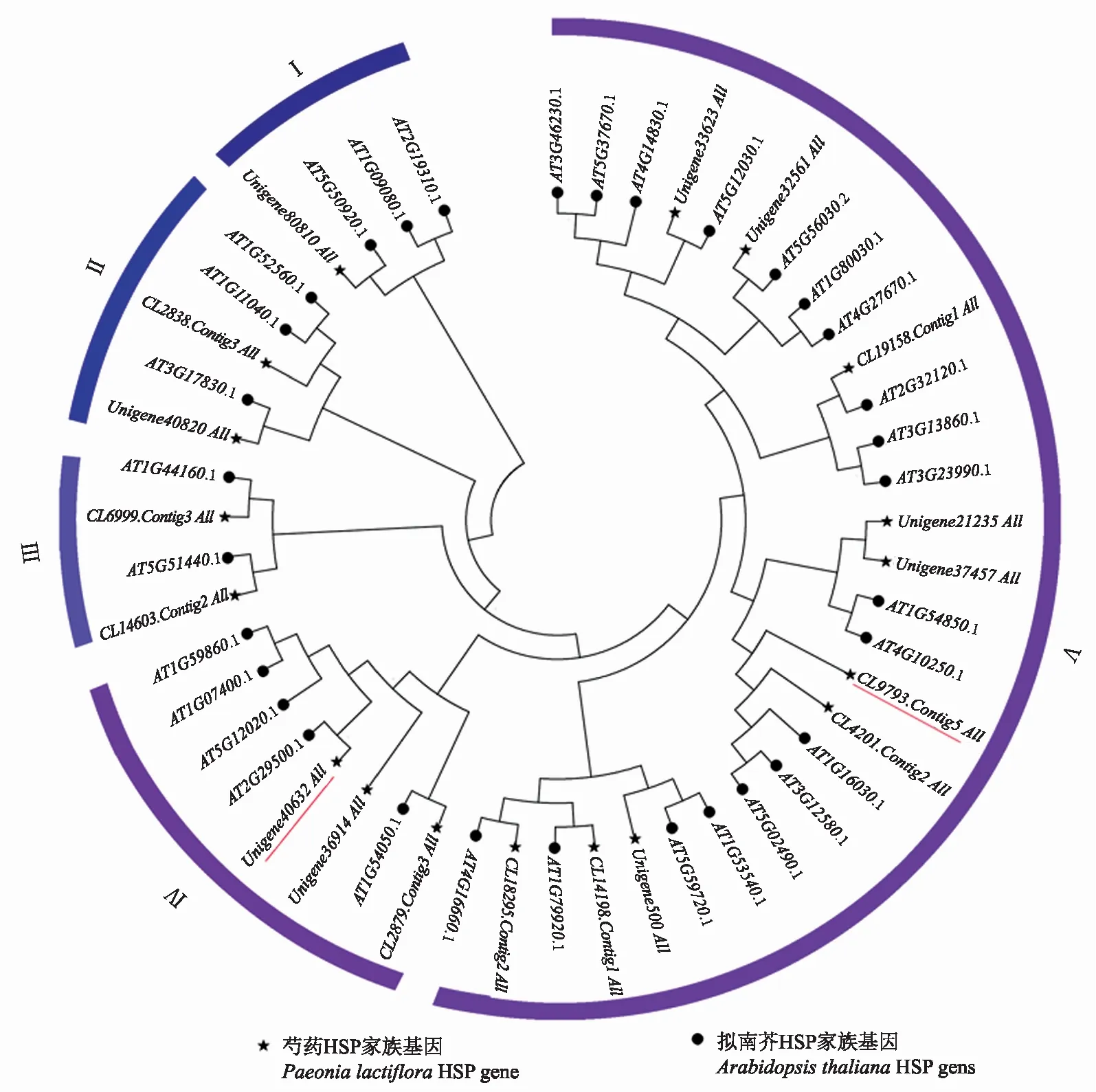
图2 芍药与拟南芥HSP家族基因进化树分析Fig.2 Evolution analysis of HSP gene family in Paeonia lactiflora and Arabidopsis thaliana
2.2 PlHSP70和PlDanJ基因克隆及生物学信息学分析
2.2.1PlHSP70和PlDanJ基因克隆 采用芍药‘粉玉奴’柱头中提取的RNA为模板,通过 RACE克隆技术获得芍药PlHSP70基因与PlDanJ基因的3′端与5′端 cDNA 序列。PlHSP70基因通过扩增获得3′端一条为289 bp的条带(图3),5′端一条为101 bp的条带(图3),最后拼接获得PlHSP70基因的CDS区序列1 539 bp,共编码513个氨基酸。PlDanJ基因通过扩增获得3′端一条为348 bp的条带(图3),5′端一条为171 bp的条带(图3),最后拼接获得PlDanJ基因的CDS区序列1 269 bp,共编码422个氨基酸。
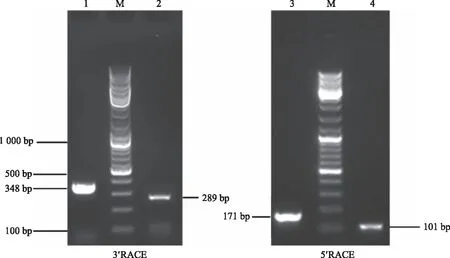
1为PlDanJ-3′ RACE扩增片段;2为PlHSP70-3′ RACE扩增片段;3为PlDanJ-5′ RACE扩增片段;4为PlHSP70-5′ RACE扩增片段;M为10 000 marker。1 is the amplified fragment of PlDanJ-3′ RACE;2 is the amplified fragment of PlHSP70-3′ RACE;3 is the amplified fragment of PlDanJ-5′ RACE;4 is the amplified fragment of PlHSP70-5′ RACE; M is 10 000 marker.
运用NCBI在线网址,分别获取PlHSP70和PlDanJ氨基酸序列同源性较高的10种植物的HSP70和DanJ的氨基酸序列,使用DANMAN9.0软件进行比对。结果表明,PlHSP70与所选植物HSP70氨基酸序列整体相似性为90.5%,PlDanJ与所选植物DanJ氨基酸序列整体相似性为77.49%(图4、图5)。通过NCBI在线网址中CD-search工具进行预测,PlHSP70在其N端具有NBD结构域,PlDanJ具有保守结构域J结构域。

图4 芍药PlHSP70的氨基酸序列与其他植物氨基酸序列的比对图Fig.4 Comparison of amino acid sequences of Paeonia lactiflora PlHSP70 gene with those of other plant genes

图5 芍药PlDanJ的氨基酸序列与其他植物氨基酸序列的比对图Fig.5 Comparison of amino acid sequences of Paeonia lactiflora PlDanJ with those of other plant
运用在线网址NCBI,分别利用PlHSP70与PlDanJ的氨基酸序列对不同物种的同源序列进行比对,为进一步探究PlHSP70、PlDanJ与其他HSP、DanJ类蛋白的进化关系,选取同源性较高的10种植物,使用MEGA7软件构建系统进化树。结果表明(图6、图7),PlHSP70a基因首先与可可聚为一个分支,同源性较高,与葡萄、苦瓜同源性较低;PlDanJ基因与石斛、蝴蝶兰聚为一个分支,同源性相对较高,与黄连木同源性较低。
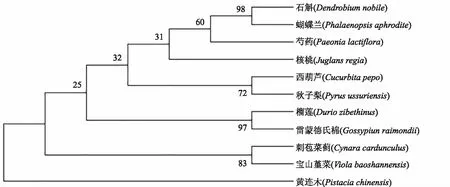
图6 芍药PlHSP70与其他物种HSP70基因的系统进化树分析Fig.6 Phylogenetic tree analysis of Paeonia lactiflora PlHSP70 and other species HSP70 genes

图7 芍药PlDanJ与其他物种DanJ基因的系统进化树分析Fig.7 Phylogenetic tree analysis of Paeonia lactiflora PlDanJ and other species DanJ
2.2.2 PlHSP70和PlDanJ理化性质分析与结构预测 PlHSP70编码513个氨基酸,预测原子组成C2 508H4 041N693O779S24,根据蛋白理化性质分析推测这是一个带负电荷的稳定亲水性蛋白(表2)。PlDanJ蛋白编码422个氨基酸,预测原子组成C2 031H3 223N591O647S27,根据蛋白理化性质分析推测这是一个带负电荷的稳定亲水性蛋白(表2)。将PlHSP70和PlDanJ序列输入SignalP 5.0,结果显示,预测PlHSP70和PlDanJ可能都不具有信号肽切割位点。
表2 芍药PlHSP70与PlDanJ蛋白理化性质分析Table 2 Analysis of physicochemical properties of Paeonia lactiflora PlHSP70 and PlDanJ proteins
PlHSP70中显示α-螺旋(alpha helix,h)占34.38%,延伸链(extended strand,e)占14.06%,而最大的结构元件是不规则卷曲(random coil,c),占51.56%(图8)。在PlDanJ中α-螺旋(alpha helix,h)占28.20%,延伸链(extended strand,e)占18.72%,而最大的结构元件是不规则卷曲(random coil,c),占53.08%(图9)。PlHSP70和PlDanJ三级结构表明其蛋白结构复杂。

A、B为PlHSP70二级结构预测图,C为PlHSP70三级结构预测图。A and B are the secondary structure prediction diagram of PlHSP70,and C is the tertiary structure prediction diagram of PlHSP70.
D、E为PlDanJ二级结构预测图;F为PlDanJ三级结构预测图。D and E are the prediction diagram of PlDanJ secondary structure,and f is the prediction diagram of PlDanJ tertiary structure.
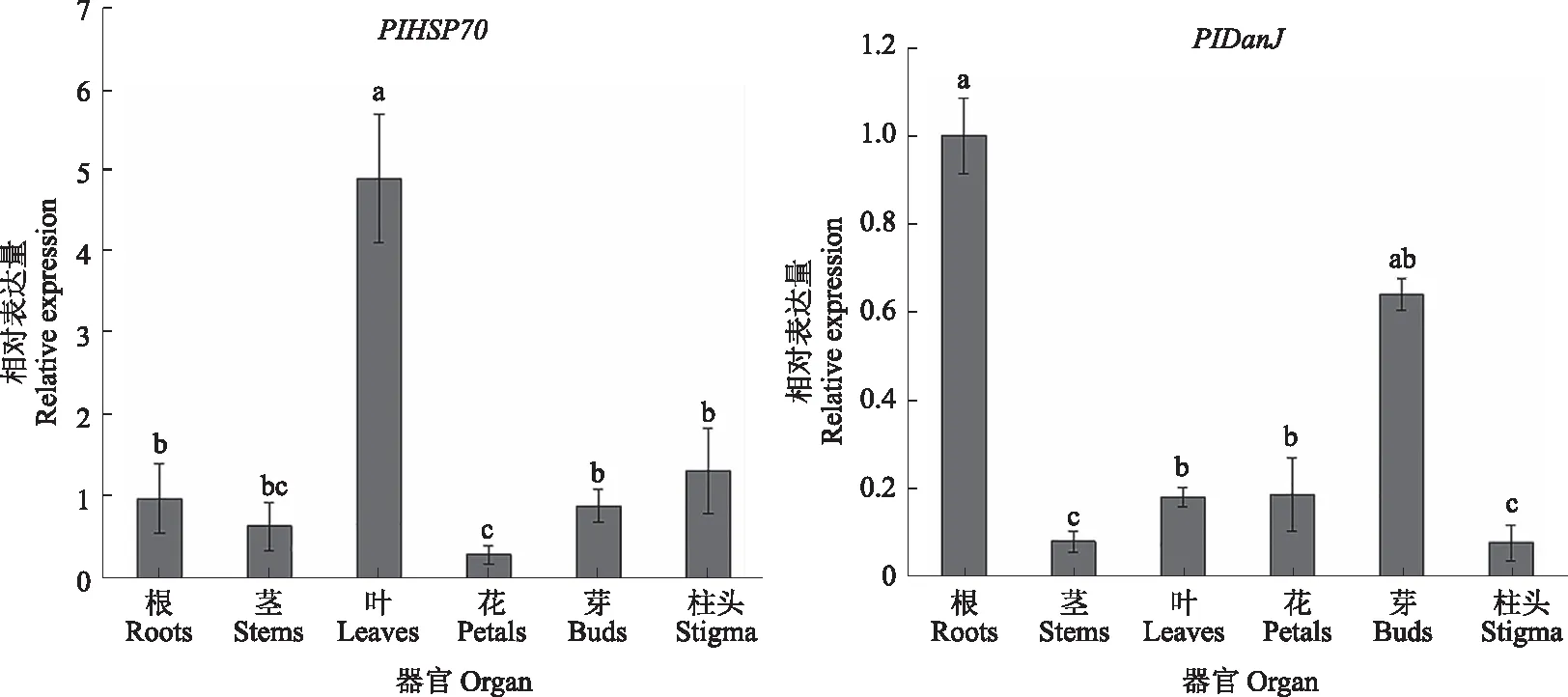
2.2.3 芍药PIHSP70与PIDanJ基因的表达分析 通过荧光定量对PlHSP70与PlDanJ基因在芍药不同部位的相对表达量进行分析。如图10所示,PlHSP70在叶部相对表达量最高,在花瓣部位相对表达量最少;PlDanJ在根部相对表达量最高,在茎部相对表达量最少。
注:不同字母表示处理间存在显著差异(P<0.05)。下同。Note:The different letters indicate significant differences among different treatments(P<0.05).The same as below.
如图11所示,PlHSP70和PlDanJ的相对表达量在授粉后总体呈先上升后下降再上升的趋势。2个基因在自交、杂交授粉后4 h的相对表达量都达到最高,在24 h之前自交授粉的相对表达量显著高于杂交授粉。在24和36 h,2个基因的相对表达量都是杂交高于自交,且36 h的相对表达量高于24 h。

图11 PlHSP70与PlDanJ在芍药自交、杂交授粉后不同时间柱头的相对表达量分析图Fig.11 Analysis of relative expression levels of PlHSP70 and PlDanJ in stigma of Paeonia lactiflora at different times after self-crossing and cross-pollination
3 讨论与结论
基于芍药远缘杂交授粉后的柱头转录组数据筛选出20个HSP家族基因,与拟南芥的HSP基因氨基酸序列信息进行进化分析,本研究发现,芍药HSP家族基因与拟南芥相似,可分成5个亚组。芍药20个HSP家族基因在自交、杂交授粉后不同时期的柱头中均有不同程度的表达,且在自交24 h前的表达量都显著高于杂交24 h前的表达量。结合前期自交与杂交后花粉在柱头的萌发与生长情况,发现自交后前期花粉管的整体生长情况较杂交后生长正常[24],因此推测HSP家族基因的上调可能与芍药授粉后花粉管前期的生长相关。
本研究通过RACE克隆得到芍药热激蛋白基因PlHSP70(GenBank登录号:OM962998)和PlDanJ(GenBank登录号:OM962997),随后分别对其进行系统进化树的构建。系统进化树分析发现,PlHSP70基因的氨基酸序列与所选植物的氨基酸序列的整体相似性高达90.5%,与所选植物HSP70蛋白具有极高的相似度。这与文心兰HSP70进化树分析结果相似[25]。RT-qPCR结果分析表明,PlHSP70与PlDanJ分别在不同器官中的均有表达,这与冯保云等[25]、袁秀云等[26]研究的文心兰、蝴蝶兰等研究情况一致,说明HSP70作为保护蛋白参与了植物生长发育的各个阶段。陈旭[27]通过对拟南芥和水稻花器官不同部位与不同时期的表达量数据进行分析发现,大部分HSP70基因在花药的不同发育时期和组织部位都具有表达变化,说明HSP70基因在花器官的发育过程中具有重要作用。本研究中PlHSP70与PlDanJ在不同器官中的表达具有较强的组织特异性,PlHSP70在芍药柱头部位表达量较高,推测PlHSP70在芍药花发育的过程中发挥着重要的作用。PlDanJ在根部表达量最高,芽部次之,推测PlDanJ在芍药营养器官发育的过程中发挥着重要的作用。
HSP转基因烟草和棉花与野生型植株、转基因空株对比,转基因植株花粉的萌发率和花粉管伸长显著提高[17]。这可能是由于HSP70大量合成,转运至线粒体,促使线粒体数量增加,为花粉的发育提供足够的能量[28]。HSP70与底物蛋白的结合需要在DanJ蛋白的帮助下完成,维持细胞内蛋白的正确折叠及功能的正常发挥[15]。本研究中,在芍药授粉后24 h之前,PlHSP70和PlDanJ在自交亲和的表达水平均明显高于杂交不亲和的表达水平,且在前期研究中发现,自交授粉后1 h柱头上的花粉大量萌发,在12 h可观察到花粉管向花柱方向生长,而杂交授粉后1 h柱头上的花粉未大量萌发,在12 h大量花粉管扭曲生长[24]。由此推测PlHSP70和PlDanJ基因在芍药授粉后花粉的萌发及生长中起着重要的作用。PlHSP70和PlDanJ在授粉后24和36 h的表达量均表现为杂交略高于自交,但是整体低于前期的表达量,这与花粉的整体生长情况相吻合,在杂交授粉24 h后花粉萌发量达到最高[29]。MA等[30]在拟南芥中发现DanJ基因的J结构域可以激活 BIP1和BIP的ATP酶活性,协助HSP70基因发挥功能。因此,推测PlDanJ可能参与PlHSP70调控芍药远缘杂交后花粉的生长,从而影响芍药属远缘杂交不亲和性。
