茂金属@硅氧倍半聚合物催化体系的构建及其在烯烃聚合反应中的催化性能
2022-08-31董晓龙李素云高玉李祖凤华义建军郝海军徐庆红
董晓龙, 李素云, 高玉李, 祖凤华, 义建军, 郝海军*, 徐庆红*
(1.北京化工大学 化学学院,北京 100029; 2.中国石油天然气股份有限公司 石油化工研究院,北京 102206)
茂金属/MAO体系是目前烯烃聚合尤其是乙烯聚合很好的催化剂。但现代聚烯烃工业生产发现,茂金属对烯烃聚合催化时,必须负载在某些载体上,才能得到性能良好的聚烯烃材料[1-2]。如果催化剂茂金属不负载在载体上,亦即催化反应在均相体系中进行,反应得到的聚烯烃会黏附在反应釜壁上,给工业生产会带来巨大麻烦,甚至可能会发生反应釜壁因黏附烯烃聚合物不均所带来的受热不均,进而产生爆炸危险。而当催化活性中心负载在载体上后,上述粘釜现象会大大地降低,甚至不会发生,从而避免了生产过程不安全因素的发生。另外,如果催化活性中心不负载在载体上,就有可能发生单个催化剂分子被众多烯烃分子包围,进而发生催化反应空间拥堵现象。但当催化剂分子负载在载体上后,不但催化反应的空间拥堵现象会得到有效的解决,而且催化剂的催化活性能够得到大幅度提高。因此,载体在烯烃聚合反应的应用中显得至关重要。MgCl2[3]、Al2O3[4]、分子筛[5]、蒙脱土[6]、水滑石[7]、聚苯乙烯[8]等材料都曾被用作茂金属的载体,并被加以研究。在前人的研究基础上,本论文选择三种结构不同的硅氧倍半聚合物作为茂金属Cp2ZrCl2的载体,系统地研究了Cp2ZrCl2在三种载体上的催化行为。
有机硅聚合物是一类聚合链上含有不同官能团的硅基高分子化合物。按照聚合链结构不同,其可以分为聚有机硅氧烷、聚有机硅烷和聚有机硅氧杂烷[9-11]。作为一种有机-无机复合材料,有机硅聚合物主要以硅-氧-硅和硅-碳键为基础骨架[12-16]。有机硅聚合物不但具有类似于二氧化硅的稳定结构,而且其骨架上可以引入不同的官能团,使其具有其它高分子化合物不具备的结构上优势,例如良好的化学稳定性、可调控的周期性孔结构以及配位性能等[17-18]。上述良好的性能使有机硅聚合物在航空、医药、环保及新能源开发等方面具有广泛的应用[19-23]。
有机硅聚合物性能的好坏与材料本身结构有很大关系,而材料结构除了与参与反应的化合物有密切关系外,还与合成方法具有很大关系[24-27]。例如,具有周期性介孔桥联硅氧倍半聚合物可以在模板剂参与下进行合成[28-33];通过含脲基的多功能硅氧烷水解缩合以及尿素单元间的氢键,能够制备得到纤维、球形、管状以及片状桥联硅氧倍半聚合物[35]。本论文采用含硅基的异氰酸酯与有机胺加成并水解合成了具有螺旋状、竹片状以及网络状硅氧倍半聚合物,并制备了Cp2ZrCl2负载于有机硅表面上的负载型茂金属复合催化剂。即:通过3-(三乙氧基硅基)丙基异氰酸酯分别与环己二胺和乙二胺间的加成反应和加成产物在微酸性环境中的水解反应,得到两种微形貌和结构差异的硅氧倍半聚合物;将Cp2ZrCl2负载于上述两种硅氧倍半聚合物表面,制备了两类负载型茂金属催化剂。研究发现,两种负载型催化剂对烯烃均聚和共聚均表现出较高的催化活性,尤其是Cp2ZrCl2负载于螺旋状硅氧倍半聚合物(环己二胺加成并水解的产物)表面形成的复合催化剂催化乙烯聚合产物(聚乙烯)的熔点达到139.2 ℃,远高于目前所报道的其它Cp2ZrCl2负载型催化剂催化乙烯聚合产物,显示出优异的工业应用价值。
1 实验部分
1.1 原料
本课题所用的试剂均为分析级。Cp2ZrCl2(≥98%)、甲苯(≥98%)、二氯甲烷(DCM,≥99%)、3-(三乙氧基硅基)丙基异氰酸酯(≥99%)、氨丙基三乙氧基硅烷(APTES,≥98%)、环己二胺(≥99%)、乙二胺(≥98%)、三乙胺(≥99%)、草酰氯(≥99%)、正己烷(≥97%)、正戊烷(≥98%)均购自北京国药试剂有限公司。在氮气下,通过金属钠回流干燥制备无水甲苯(使用前用水含量分析仪测定微量水含量);干燥的二氯甲烷用分子筛浸泡一周后蒸馏得到(使用前用水含量分析仪测定微量水含量);乙烯通过含有4A分子筛的吸附柱进行纯化。整个实验过程均在惰性气体保护下采用Schlenk操作技术完成。
1.2 螺旋状硅氧倍半聚合物的制备
将1.4 g(10.0 mmol)环己二胺(S,S或R,R)加入到含有40 mL二氯甲烷的Schlenk瓶中,快速搅拌直至混合均匀。向上述混合体系中逐滴加入5.5 g(20 mmol)3-(三乙氧基硅基)丙基异氰酸酯。滴加结束后,混合体系搅拌14 h,随后减压抽走低沸点溶剂及未反应的环己二胺和3-(三乙氧基硅基)丙基异氰酸酯,制得硅氧倍半聚合物前驱体化合物。该化合物的1H-NMR:(CDCl3, 400 MHz)δ5.81(s,J=6.1 Hz, 2H), 5.24(t,J=6.7 Hz, 4H),3.88(q,J=7.9 Hz, 12H), 2.61(m,J=6.3 Hz, 4H),2.38(t,J=6.8 Hz, 4H), 1.54(m,J=7.2 Hz, 4H), 1.27(t,J=6.2 Hz, 22H), 0.62(t,J=7.3 Hz, 4H);13C-NMR:(CDCl3, 400 MHz)δ157.79, 57.56, 55.54, 42.27, 31.29, 23.81,22.21, 16.99, 6.67.MS(ESI+)(M+1):m/zcalcd for C26H56N4O8Si2:608.358 5。前驱体产率为42.1%。核磁共振谱以及质谱分析结果与预想的分子结构组成相一致。
将1.0 g硅氧倍半聚合物前驱体加入到20 mL Schlenk瓶中,然后逐滴缓慢加入4.2 mL 1.0 mol/L HCl溶液,混合物在80 ℃下搅拌1.5 h后静置3 d(80 ℃环境中),得到凝胶状产物。在减压下干燥所得到的凝胶,得到目标螺旋状硅氧倍半聚合物,命名为SS-1。产物的合成过程如图1所示。

图1 硅氧倍半聚合物SS-1的制备过程
1.3 竹片状硅氧倍半聚合物的制备
将0.6 g(10 mmol)的乙二胺加入到含有40 mL二氯甲烷的Schlenk瓶中,快速搅拌直至混合均匀。向上述混合体系中逐滴加入5.5 g(20 mmol)的3-(三乙氧基硅基)丙基异氰酸酯。滴加完毕后,混合体系搅拌14 h,随后减压抽走低沸点溶剂及未反应的乙二胺和3-(三乙氧基硅基)丙基异氰酸酯,得到硅氧倍半聚合物前驱体化合物。该化合物的1H-NMR:(CDCl3, 400 MHz)δ6.39(s,J=7.1 Hz, 2H),5.86(m,J=6.4 Hz, 2H), 3.72(m,J=6.9 Hz, 16H),3.13(q,J=6.2 Hz, 4H), 1.51(s,J=7.0 Hz, 4H), 1.22(s,J=6.4Hz, 18H), 0.57(t,J=6.7 Hz, 4H);13C-NMR:(CDCl3, 400 MHz)δ138.61, 94.31, 57.36, 42.09, 22.47, 16.87, 6.33.MS(ESI+)(M+1):m/zcalcd for C22H50N4O8Si2:554.431 7。前驱体产率为57.3 %。核磁共振谱以及质谱分析结果与预想的分子结构组成相一致。
将1.0 g硅氧倍半聚合物前驱体加入到20 mL 的Schlenk瓶中。然后逐滴加入4.2 mL 1.0 mol/L HCl溶液,混合物在80 ℃下搅拌1.5 h后静置3 d(80 ℃环境中),得到凝胶状产物。在减压下干燥所得到的凝胶,得到目标竹片状硅氧倍半聚合物,命名为SS-2。产物的合成过程如图2所示。
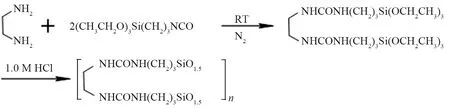
图2 硅氧倍半聚合物SS-2的制备过程
1.4 蜂窝状硅氧倍半聚合物的制备
将干燥的15 mL二氯甲烷、3.7 mL三乙胺(27 mmol)和6 mL APTES(27 mmol)分别加入到50 mL干燥的充满氮气的Schlenk瓶中。在保持混合液0 ℃情况下,向Schlenk瓶内逐滴滴加10 mL含1.0 mL含草酰氯(13.6 mmol)的DCM溶液。滴加加完后,混合物在室温下搅拌6 h,然后减压蒸馏(95 ℃,15 mmHg),得到硅氧倍半聚合物前驱体[34]。该化合物的1H-NMR:(CDCl3, 400 MHz)δ7.57(s,J=6.9 Hz, 2H), 3.80(q,J=7 Hz, 12H), 3.32(t,J=6.7 Hz, 4H), 1.67(m,J=7.7 Hz, 4H), 1.22(t,J=7.1 Hz, 18H), 0.64(t,J=8.3 Hz, 4H);13C-NMR:(CDCl3, 400 MHz)δ159.81, 58.47, 42.02, 22.81, 18.28, 7.55.MS(ESI+)(M+1):m/zcalcd for C20H44N2O8Si2:497.275 1。前驱体产率为34.6%。核磁共振谱以及质谱分析结果与预想的分子结构组成相一致。
将1.0 g硅氧倍半聚合物前驱体加入到20 mL Schlenk瓶中。然后逐滴加入4.2 mL 1.0 mol/L HCl溶液,混合物在80 ℃下搅拌1.5 h后静置3 d(80 ℃环境中),得到凝胶状产物。在减压下干燥凝胶,得到目标蜂窝状硅氧倍半聚合物,命名为SS-3[35]。产物的合成过程如图3所示。
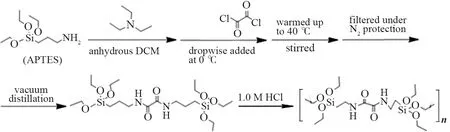
图3 硅氧倍半聚合物SS-3的制备过程
1.5 Cp2ZrCl2负载型复合催化剂的制备
将0.5 g SS-1和25 mL无水甲苯溶液于Schlenk瓶中在40 ℃下搅拌2 h,然后将30 mg Cp2ZrCl2加入到上述Schlenk瓶中并继续搅拌10 h,然后过滤混合物,得到的固体用甲苯和正己烷洗涤数次,在真空下抽干并置于充满氮气的手套箱内保存。以上步骤均在氮气保护下完成。所制备的复合催化剂记为Cp2ZrCl2@SS-1.
以上述相同方法及相同各物质加入量制备Cp2ZrCl2负载于棒状硅氧倍半聚合物和蜂窝状硅氧倍半聚合物表面上形成的复合茂金属催化剂,分别记为Cp2ZrCl2@SS-2和Cp2ZrCl2@SS-3。复合催化剂Cp2ZrCl2@SS-2和Cp2ZrCl2@SS-3的保存方式完全和Cp2ZrCl2@SS-1相同。
1.6 Cp2ZrCl2负载型复合催化剂催化活性的测定
乙烯均聚:向聚合反应器中加入200 mL干燥甲苯,并添加所制备的一定量催化剂及适量甲基铝氧烷(MAO)。乙烯以2.5×105Pa的压强引入反应器中,在60 ℃下进行聚合反应1 h。然后用酸性乙醇终止反应。
空白实验:体系中不加入任何催化剂,其他试剂的加入量和反应条件与上述(在催化剂存在下的乙烯均聚)反应完全相同。空白实验验证MAO是否具有催化活性。
乙烯-辛烯共聚:向聚合反应器中加入200 mL配制好的一定浓度辛烯甲苯溶液,并添加所制备的一定量催化剂及适量甲基铝氧烷(MAO)。向盛有催化剂的反应器中引入乙烯(压强为2.5×105Pa),并进行聚合反应1 h(反应温度为60 ℃)。最后用酸性乙醇终止反应。
1.7 样品表征
利用Bruker Vector-22(德国制造)傅立叶变换红外光谱(FT-IR)在400~4 000 cm-1范围内对合成样品进行红外光谱分析(合成样品与KBr质量比为1∶100),仪器分辨率为2 cm-1。利用Quantachrome NOVA 2000e吸附仪(美国康塔公司制造)对样品比表面积及比孔容进行测试,测试环境温度为77 K,测试前样品在110 ℃ 环境中脱气6 h。样品的比表面积利用Brunauer-Emmett-Teller(BET)计算法得到。利用JEM-2 010扫描电子显微镜(SEM,日本电子株式会社制造)对聚合物样品形貌进行分析,仪器工作电压为200 kV。使用iCAP 6 300型电感耦合等离子体原子发射光谱(ICP-OES,美国Thermo Electron公司)测定锆含量。使用DSC(NETZSCH 200 F1 德国耐驰)按照10 ℃/min升温速率从室温到230 ℃测定聚乙烯和乙烯-辛烯聚合物的熔点。
2 结果与讨论
2.1 三种硅氧倍半聚合物的结构表征
硅氧倍半聚合物SS-1、SS-2及SS-3的红外光谱吸收谱如图4所示。从图中可以发现,二者红外吸收光谱基本一致。对于SS-1,在2 984 cm-1处对应于六元环中的分子中碳氢伸缩振动(νC-H)(图1a);三种聚合物分子链中的碳氢伸缩振动(νC-H)均位于2 856 cm-1处(由于样品SS-3中含C-H基团数量较少,其在该波长处的吸收较弱),羰基(νC=O)和亚氨基(νN-H)伸缩振动分别位于1 648和1 554 cm-1处,Si-O-Si伸缩振动(νSi-O-Si)位于1 024~1 126 cm-1处。上述聚合物链上基团红外吸收位置均与文献[27]所报道的相一致。

图4 SS-1(a),SS-2(b)和SS-3(c)的红外吸收光谱图
硅氧倍半聚合物SS-1(RR, a)、SS-1(SS, b)、SS-2(c)和SS-3(d)的扫描电镜照片如图5所示。从图5a和5b可以看出,以1,2-环己二胺为原料制备的硅氧倍半聚合物呈粗纤维螺旋状,RR型1,2-环己二胺所合成产物呈左旋状,SS型则呈右旋状,与1,2-环己二胺椅式构像中两个氨基的空间走向相一致。从两种螺旋链较粗的直径(大约为0.5 μm)可以看出,聚合物螺旋是由多条聚合物链互相拧在一起形成的,链与链之间的氢键作用可能是这种粗螺旋形成的内在力量。因此,在这种螺旋状材料的内部可能有大量微孔存在。聚合物SS-2微形貌呈竹片状(图5c)。这种片状结构可能是由聚合物链通过氢键而形成的多层结构。对于SS-3,其呈现出蜂窝状形貌(图5d),材料内部存在大量堆积孔。由于合成聚合物骨架上含有大量的极性基团,且材料内部可能有大量孔的存在,这为Cp2ZrCl2在其上面的负载创造了必要条件。

图5 SS-1(RR, a)、SS-1(SS, b)、SS-2(c)和SS-3(d)的SEM照片
氮气的吸脱附曲线(如图6所示)表明,上述三种硅氧倍半聚合物内部有孔的存在,因为三条曲线均系IV型吸附等温线,高压下没有明显饱和吸附平台。样品SS-2和SS-3氮气吸脱附曲线在0.90~0.99 P/P0范围内出现的急剧拐点表明,两样品中可能存在一些由于颗粒堆积而形成的大孔,这种情况在SS-1中并不明显。BET计算表明,样品SS-1、SS-2、SS-3的比表面积分别约为44.6、36.2及14.8 m2/g;孔分布曲线(如图7所示)表明,SS-1中存在直径大约为2.42 nm的孔,SS-2中存在2.17和3.77 nm两种不同孔径的孔,SS-3中存在直径大约为3.81 nm的孔。有机聚合链间的氢键是孔形成的重要因素。另外,样品SS-3中存在的大量堆积孔也可以从图7c中反映出来。

图6 SS-1(a)、SS-2(b)和SS-3(c)的氮气吸附脱附曲线

图7 SS-1(a)、SS-2(b)和SS-3(c)的孔径分布
2.2 Cp2ZrCl2在三种硅氧倍半聚合物表面上的稳定性探究及复合催化剂在烯烃聚合反应中的催化活性
2.2.1 Cp2ZrCl2在三种硅氧倍半聚合物表面上的稳定性探究
将Cp2ZrCl2分别负载于SS-1、SS-2及SS-3上制备得到复合催化剂Cp2ZrCl2@SS-1、Cp2ZrCl2@SS-2和Cp2ZrCl2@SS-3。首先探究了Cp2ZrCl2在三种硅氧倍半聚合物表面上存在的稳定性,并以Cp2ZrCl2负载前后SS-1结构中N 1s和O 1s电子结合能的变化对复合催化剂主客体之间的相互作用进行探究。研究发现,当Cp2ZrCl2负载于SS-1表面上后,SS-1聚合链上N原子和O原子1s轨道电子结合能在负载前相比发生了明显变化(如图8a和8b所示)。负载后聚合链上N 1s的两种电子结合能N 1s(N-H)和N 1s(N-C)分别从负载前399.0和399.6 eV升高至399.1和399.8 eV;O 1s电子结合能O 1s(O=C)和O 1s(O-Si)则分别从负载前的531.2和531.9 eV升高至531.6和532.1 eV。元素电子结合能的变化说明,在SS-1表面,Cp2ZrCl2与聚合物链间存在一定的作用力。结合主客体的分子结构特点,这种作用可能来自于Cp2ZrCl2中的Zr-Cl键与SS-1结构中的N-H键发生的脱HCl反应,Cp2Zr结构以键合形式链接于SS-1骨架之中。受这种强烈相互作用的影响,N 1s电子结合能在Cp2ZrCl2负载前后发生了一定程度的变化。这种主客体之间的强烈相互作用进一步被Cp2ZrCl2中Zr3d轨道电子结合能在负载前后的变化所证明。负载前,Cp2ZrCl2中Zr3d两种电子结合能分别为184.6(Zr-Cl)和182.5 eV(Zr-Cp);负载后,上述两种状态结合能分别为184.9(Zr-N)和182.1 eV(Zr-Cp),Zr-Cl键被Zr-N键所取代。Cp2ZrCl2以键合形式被牢牢地固定于SS-1骨架表面上。
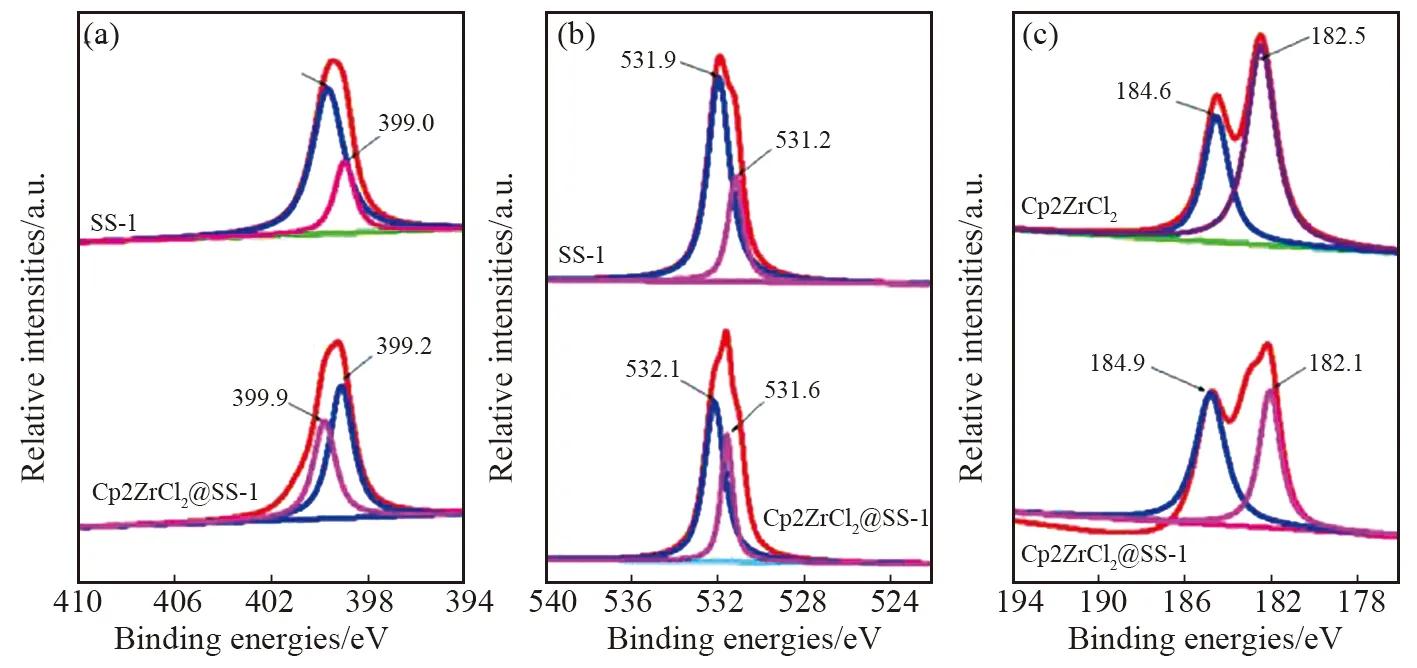
图8 SS-1和Cp2ZrCl2@SS-1中N 1s(a)、O 1s(b)、Zr 3d(c)电子结合能谱图
Cp2ZrCl2@SS-1的EDS分析结果及其元素分布(如图9所示)也证明了上述结论的成立。分析未发现Cp2ZrCl2@SS-1中有Cl元素存在,说明Cp2ZrCl2分子与SS-1骨架发生了脱HCl的反应。在Cp2ZrCl2@SS-1中,锆的质量百分含量约为0.28%,且均匀地存在于SS-1表面上(从图9分析可知)。

图9 Cp2ZrCl2@SS-1中的元素分布图
上述主客体之间相互作用方式在复合催化剂Cp2ZrCl2@SS-2和Cp2ZrCl2@SS-3中也同样存在。
2.2.2 负载型复合催化剂在烯烃聚合反应中的催化活性
茂金属负载过去主要集中在以硅胶为载体的研究方面[36-38],而以硅氧倍半聚合物为载体制备负载型茂金属复合催化剂、并将其应用于催化烯烃聚合反应尚未见文献报道。本文对所制备的三种负载型复合催化剂Cp2ZrCl2@SS-1、Cp2ZrCl2@SS-2和Cp2ZrCl2@SS-3在乙烯均聚、乙烯与辛烯共聚合反应中的催化性能进行了深入研究,并将它们在上述反应中的催化活性与其他Cp2ZrCl2负载型复合催化剂的催化活性进行了比较。
复合催化剂在乙烯均聚反应中的催化性能向一定量和一定比例的甲苯、MAO(助催化剂)和负载型复合催化剂(Cp2ZrCl2@SS-1、Cp2ZrCl2@SS-2和Cp2ZrCl2@SS-3中的一种)的混合体系中(以2.0 L反应釜为反应容器)通入乙烯,60 ℃下进行聚合反应1 h(最后以酸性乙醇终止反应)。以反应得到的聚乙烯量以及参与反应的催化剂中Zr含量对比值来评价催化剂的活性。实验结果与计算结果表明,在催化乙烯聚合反应中,Cp2ZrCl2@SS-1的活性约为1.01×106g PE/Mol(Zr)·h,Cp2ZrCl2@SS-2的反应活性约为6.43×105g PE/Mol(Zr)·h,Cp2ZrCl2@SS-3的反应活性约为4.51×105g PE/Mol(Zr)·h,以Cp2ZrCl2@SS-1的活性最高。重要的是,由Cp2ZrCl2@SS-1催化得到的聚乙烯熔点高达139.2 ℃,高于Cp2ZrCl2@SS-2(135.4 ℃)和Cp2ZrCl2@SS-3(136.2 ℃)催化聚合产物(如图10所示)。我们推测这一结果可能与载体的螺旋结构有关,沿螺旋体分布的催化剂分子可能使聚烯烃的形貌变为致密扭曲状,从而提升聚乙烯的熔点。

图10 Cp2ZrCl2@SS-1(a),Cp2ZrCl2@SS-2(b)和Cp2ZrCl2@SS-3(c)催化乙烯聚合产物的DSC谱图
上述三种复合催化剂催化乙烯聚合产物分子量分布(重均分子量/数均分子量,Mw/Mn)分别为3.05(Cp2ZrCl2@SS-1催化产物)、3.23(Cp2ZrCl2@SS-2催化产物)和3.08(Cp2ZrCl2@SS-3催化产物),均高于Cp2ZrCl2均相催化乙烯聚合产物的分子量分布值2.74。三种复合催化剂异相催化乙烯聚合产物的相关参数列于表1中;催化产物聚乙烯的颜色及形态如图11a-c所示。

图11 Cp2ZrCl2@SS-1(a)、Cp2ZrCl2@SS-2(b)和Cp2ZrCl2@SS-3(c)催化乙烯均聚产物的颜色及外观;Cp2ZrCl2@SS-1对乙烯与0.1 mol/L辛烯(d)、0.3 mol/L辛烯(e)和0.5 mol/L辛烯(f)催化共聚产物的颜色及形态

表1 三种负载型复合催化剂催化乙烯聚合反应相关参数
上述反应体系在不加入催化剂情况下,MAO对乙烯聚合反应不具有任何催化活性。
Cp2ZrCl2@SS-1 在乙烯与1-辛烯共聚合中的催化性能本论文系统地研究了Cp2ZrCl2@SS-1在乙烯与1-辛烯共聚合中的催化性能。向盛有一定浓度1-辛烯的甲苯溶液2.0 L反应釜中加入一定质量的复合催化剂,并向其中通入乙烯气体(压强为2.5×105Pa),60 ℃下持续反应1h(以酸性乙醇最后终止反应)。以0.1、0.3及0.5 mol/L三种不同浓度的1-辛烯甲苯溶液为研究对象。cat-1对三种体系共聚合反应的催化活性分别为5.29×105、4.85×105和4.17×105gPE/Mol(Zr)·h;聚合物分子量分布值(Mw/Mn)分别为3.79、3.93和4.04;聚合物熔点(如图12所示)分别为121.7、116.9和107.4 ℃。Cp2ZrCl2@SS-1催化乙烯与1-辛烯共聚合反应的催化活性小于催化乙烯均聚催化活性,其中的主要原因来自于参与反应的分子大小不同。在乙烯均聚反应中,反应物分子较小、分子相互接触相对较容易;而在乙烯与1-辛烯共聚合反应中,1-辛烯分子较大,乙烯分子与1-辛烯分子接触较困难。对于异相聚合产物分子量分布值较大的原因,目前尚不清楚。Cp2ZrCl2@SS-1催化乙烯与1-辛烯共聚合产物的参数列于见表2中。不同辛烯浓度下的催化产物的颜色及形态如图11d-f所示。

图12 Cp2ZrCl2@SS-1对不同浓度辛烯与乙烯催化聚合产物的DSC谱图

表2 Cp2ZrCl2@SS-1催化不同浓度1-辛烯和乙烯共聚合反应相关参数
三种负载型复合催化剂催化乙烯均聚或乙烯和辛烯共聚反应如图13所示。
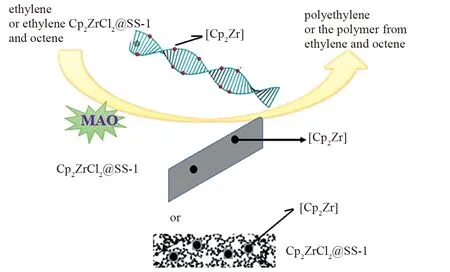
图13 三种负载型复合催化剂催化乙烯均聚或乙烯和辛烯共聚反应示意图
3 结论
合成得到了三种微形貌和结构差异的硅氧倍半聚合物,并将二氯二茂锆(Cp2ZrCl2)负载于上述三种硅氧倍半聚合物表面,制备得到三种负载型茂金属催化剂。所制备的负载型茂金属催化剂对烯烃均聚和共聚均表现出较高的催化活性,负载于螺旋状硅氧倍半聚合物表面的Cp2ZrCl2催化乙烯聚合产物熔点达到139.2 ℃,系目前所报道的熔点较高的聚乙烯产品,显示出优异的工业应用价值。本论文研究成果对于开发新一代聚烯烃催化剂载体、促进载体与催化活性中心一体化研究、提高烯烃聚合催化剂的活性及提升烯烃聚合产物的性能具有重要的价值和意义。
