基于A2O-MBR 工艺的耐盐活性污泥微生物群落研究
2022-08-31杨宗政张天宇李文轩武莉娅
杨宗政,张天宇,孙 炜,李文轩,马 建,武莉娅,3
(1.天津科技大学海洋与环境学院,天津 300457;2.天津科技大学化工与材料学院,天津 300457;3.天津市卤水化工与资源生态化利用重点实验室,天津 300457;4.天津津港基础设施养护运营工程管理有限公司,天津 300456)
渔业、食品加工、纺织、皮革和石油等行业产生的废水含有一定量的总溶解性固体(TDS)〔1〕,其中TDS 质量分数<1%的废水被称为含盐废水〔2〕。含盐废水的水量占全球废水总量的5%左右〔3〕,如未经处理直接排放,可能导致地表水、地下水及土壤受到污染〔4〕。因此,开发高效稳定的含盐废水处理工艺成为研究重点。
生物法是处理含盐废水最常用的方法〔5〕。上流式厌氧污泥床反应器(UASB)、膜生物反应器(MBR)、序批式反应器(SBR)、活性污泥法(ASP)、人工湿地(CWs)等基于微生物附着和悬浮生长的生物处理工艺,可用于含盐废水的处理〔6−7〕。但在处理过程中,高TDS 会抑制活性污泥微生物的生长,进而影响污水处理效率〔8〕。因此,基于稳定的污水处理反应器,通过TDS 梯度驯化提高活性污泥对含盐环境的的适应能力,是实观含盐废水生化处理的重要前提〔9〕。据报道,采用逐步提高系统盐浓度的方式进行污泥耐盐驯化,驯化后的污泥可很好地降解含盐废水中的有机物〔10−11〕。
近年来,高通量测序技术被广泛用于微生物群落的分析〔12〕,特别是含盐废水处理过程中活性污泥微生物的种群变化〔13−15〕。但现有研究大多只涉及盐度对微生物群落结构的影响,耐盐活性污泥驯化的相关研究较少,且在提升盐度的同时没有考虑出水是否达标。因此,在出水能够稳定达标的耐盐工艺基础上,分析活性污泥的微生物群落结构变化,对于优化污水处理工艺有重要的指导意义。笔者采用实验室规模的A2O-MBR 反应装置,研究了进水TDS 从2 000 mg/L 逐步增至7 000 mg/L 的过程中活性污泥系统连续处理废水的性能,以及微生物群落结构的变化,以出水COD、NH4+−N、TN 达标作为阶段驯化的要求,进行耐盐活性污泥的驯化。基于高通量测序的方法,阐述了活性污泥耐盐驯化过程中微生物的演替过程及优势菌种丰度的变化。
1 实验部分
1.1 实验材料及装置
实验接种污泥取自天津市某污水处理厂厌氧池、缺氧池、好氧池,污泥质量浓度为3 200 mg/L。实验用水为模拟含盐废水,组分包括:281.4 mg/L 葡萄 糖、25 mg/L MgSO4·7H2O、0.1 mg/L FeCl3·6H2O、95.5 mg/L NH4Cl、13.2 mg/L KH2PO4、0.1 mg/L Co(NO3)2·6H2O、0.1 mg/L Na2MoO4·6H2O、0.1 mg/L CuSO4·5H2O、0.1 mg/L MnSO4·5H2O、0.1 mg/L ZnSO4·7H2O、2 000~7 000 mg/L NaCl。废 水COD、TN、TP 分别为243~325、22.5~27.6、2.5~3.5 mg/L。
实验采用A2/O-MBR 组合工艺装置连续运行,如图1 所示。

图1 实验装置Fig.1 Schematic diagram of experimental device
实验装置由聚氯乙烯(PVC)制成,有效容积为132 L。装置内部由隔板分为5 部分,包括沉淀池(12 L)、厌 氧 池(27 L)、缺 氧 池(27 L)、好 氧 池(37 L)、膜池(29 L)。除沉淀池外各反应池均配置曝气系统,其中厌氧池、缺氧池用时间继电器控制曝气系统的启停时间以实现间歇曝气。控制厌氧池溶解氧(DO)在0.2 mg/L 以内,缺氧池DO 在0.2~0.5 mg/L,好氧池、膜池持续曝气,保持池内DO 在3~5 mg/L。膜池采用中空纤维膜(天津膜天膜科技股份有限公司)进行过滤,膜面积为0.25 m2、孔径为0.22 μm、膜通量为10~20 L/(m2·h)。原水进入厌氧池为聚磷菌的释磷过程提供有机碳源,厌氧池混合液通过溢流依次进入缺氧池、好氧池和膜池,膜池底部污泥通过回流泵回流至厌氧池,膜依靠负压间歇出水。
系统水力停留时间(HRT)为32 h,硝化液回流比控制在250%,采用逐步增加TDS 的方式进行耐盐活性污泥的驯化。驯化过程共3 个阶段(TDS 分别为2 000、4 500、7 000 mg/L),以出水COD、NH4+−N、TN 达标且稳定作为每个阶段的驯化终点,考察TDS 对装置出水水质及活性污泥微生物群落结构的影响。
1.2 实验方法
实验过程分3 个阶段,各阶段TDS 依次为2 000、4 500、7 000 mg/L;整个过程持续运行38 d,平均各阶段持续12~13 d。取各阶段末期的活性污泥样品,命名为H0、H1、H2、Q2(H 代表膜池样品,Q 代表缺氧池样品,样品TDS 依次为2 000、4 500、7 000、7000 mg/L),样品采集至无菌离心管后迅速置于−20 ℃冰箱中保藏。
1.3 DNA 提取/QC
用DNA 提取试剂盒从样品中提取DNA,用Equalbit dsDNA HS Assay Kit 检 测DNA 浓 度。
1.4 PCR 扩增及高通量测序
以20~30 ng DNA 为模板,用金唯智设计的一系列PCR 引物扩增原核生物16S rDNA 上包括V3 及V4 的2 个高度可变区。再通过PCR 向16S rDNA 的PCR 产物末端加上带有Index 的接头,以便进行NGS 测序,用磁珠进行文库纯化后通过酶标仪检测浓度、琼脂糖凝胶电泳检测片段大小,用酶标仪检测文库浓度。将文库定量到10 nmol/L,按Illumina MiSeq/Novaseq(Illumina,San Diego,CA,USA)仪器使用说明书进行PE250/FE300 双 端 测 序,由MiSeq/Novaseq 自 带 的MiSeq Control Software(MCS)/Novaseq Control Software(NCS)读取序列信息。
1.5 数据分析
双端测序得到的正反向reads 首先进行两两拼接,过滤拼接结果中含有N 的序列,保留序列长度>200 bp 的序列。经过质量过滤,去除嵌合体序列,最终得到的序列用于OTU 聚类。使用VSEARCH(1.9.6)进行序列聚类(序列相似性设为97%),比对的16S rRNA 参考数据库为Silva 138。 用RDP classifier(Ribosomal Database Program)贝叶斯算法对OTU 的代表性序列进行物种分类学分析,并在不同物种分类水平下统计每个样本的群落组成。
基于OTU 得到分析结果,采用对样本序列进行随机抽平的方法,分别计算Shannon、Chao1 等α多样性指数以反映群落的物种丰度和多样性,作Rarefaction 曲 线 和Rank−Abundance 曲 线 图 反 映 物种丰富度和均匀度。
通过(un)weighted unifrac 分析比较样本间是否有显著的微生物群落差异。PCoA 为展示β多样性可视化图,基于Brary−Curtis 样本间距离矩阵。通过层次聚类中的非加权组平均法构建UPGMA 聚类树。
1.6 常规检测项目
COD 采用重铬酸钾法测定;NH4+−N 采用纳氏试剂分光光度法测定;TN 采用碱性过硫酸钾消解紫外分光光度法测定;污泥形态采用扫描电镜(JSM−IT300LV)在5 000 倍下进行观察。
2 TDS 对活性污泥系统的影响
2.1 TDS 对活性污泥系统出水水质的影响
耐盐驯化期间装置的进出水水质见图2。
由图2 可知,随着进水TDS 的增加,出水TN、NH4+−N、COD 均逐渐升高,去除率下降。进水TDS为2 000 mg/L 时,出水COD、NH4+−N、TN 升高,但微生物较易适应低浓度的TDS 环境,因此出水很快恢复至达标水平;在进水TDS 升至4 500 mg/L 的初始驯化阶段,出水NH4+−N 与COD 不断升高且持续8 d处于恶化状态,说明微生物难以快速适应此时的环境,8 d 后 出 水NH4+−N、COD 恢复至正常状态。由图2(c)可见出水TN 居高不下,有研究指出亚硝酸盐氧化菌相较于氨氧化菌对盐度更加敏感〔16〕,使得反硝化脱氮过程滞后于硝化过程,出水TN 达标晚于NH4+−N 与COD。当进水TDS 升至7 000 mg/L 时,出水水质虽有一定程度的波动,但在驯化阶段末期,出水TN、NH4+−N、COD 相比前2 个阶段明显降低,这可能是由于适当提升进水TDS 后,盐离子胁迫刺激生物机制的应激反应,提高了系统内微生物的耐受程度,优化了装置的运行效果〔17〕。

图2 耐盐驯化期间装置出水水质变化情况Fig. 2 Changes of effluent quality during salt acclimation
2.2 TDS 对活性污泥形态的影响
驯化期间膜池活性污泥的微观结构如图3 所示。
由图3 可见,培养初期污泥颗粒结构松散,颗粒表面空隙较大,难以达到良好的出水效果。但经过不断的驯化培养及TDS 的提升,污泥最终由胞外聚合物紧紧黏结在一起,结构紧凑,装置出水各指标均维持在较低的数值水平。

图3 膜池活性污泥的微观结构Fig. 3 Microstructure of activated sludge in MBR tank
3 细菌多样性分析
按照97%相似性对unique 序列(重复次数>1)进行OTU 聚类,在聚类过程中进一步去除嵌合体序列,得到OTU 的代表序列,通过聚类得到2 068 个OTUs。为直观展示活性污泥耐盐性驯化过程中细菌OTU 的变化与联系,对4 个活性污泥样品作相似性Venn 分析,结果见图4。
由图4 可见,4 个样品间共有OTU 为227 个,表明4 个菌群有一定的结构相似性,其中H0 与H1 的重叠程度较高,而H0 与H2 的重叠程度较低,表明TDS 提升初期活性污泥中的微生物群落结构变化并不明显,但当TDS 提升至一定程度时,污泥中的微生物群落结构发生明显的变化;H2 与Q2 同样有着较高的重叠度,这可能是由于在活性污泥回流系统的作用下,Q2 中混入部分H2,导致两者具有一定相似性。
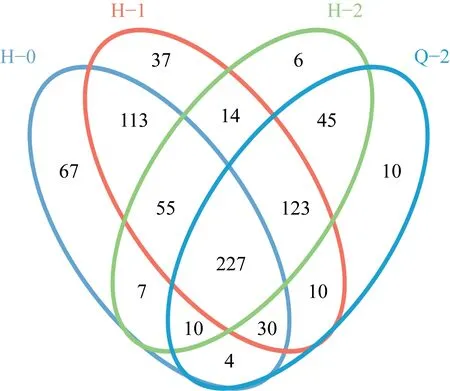
图4 Venn 图Fig.4 Venn diagram
初始活性污泥中的特有OTU 共67 个,当TDS 提升至4 500 mg/L 后特有OTU 降至37 个,当TDS 进一步提升至7 000 mg/L 后,特有OTU 仅为6 个,相同TDS 下缺氧池污泥样品Q2 的特有OTU 也仅为10 个,说明提升TDS 对微生物菌群多样性的影响显著。对每个OTU选择一条代表性序列,用RDP classifier 对代表性序列进行物种分类注释,从而得到每个样本的群落组成,最终共注释得到31 个门、265 个属和218 个种水平的细菌。
为分析单个样品内部微生物群落中的物种多样性,测定了4 个活性污泥样品的多样性指数,包括Ace 指数(估计群落中OTU 数目的指数)、Chao1 指数(评估物种丰度)、Shannon 指数和Simpson 指数(反映样本中微生物多样性),结果见表1。
由表1 可以看出,与其他3 个样品相比,H1 的物种丰富度和多样性最为突出,可能是因为适当提升盐度比低盐条件更利于微生物的繁殖,这与颜培等〔18〕的研究结果相似;而H2与Q2的各项指数偏低,也说明高TDS条件对微生物生长状态的抑制作用较为明显。
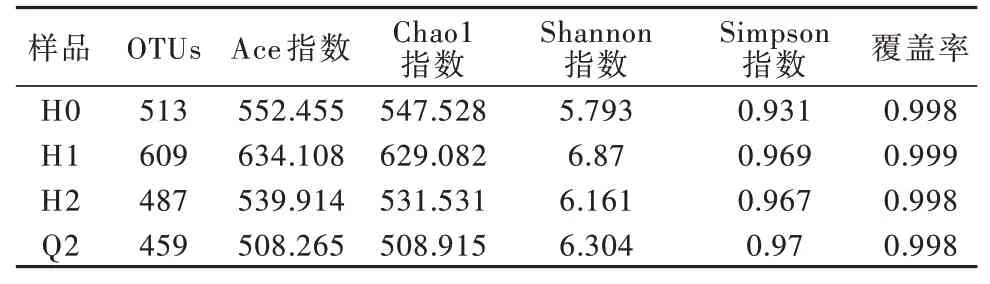
表1 Alpha 多样性指数统计Table 1 Alpha diversity index statistics
对样本进行PCoA 分析,结果如图5 所示。
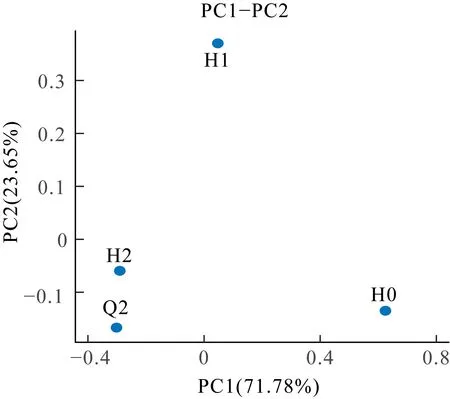
图5 PCoA 图Fig.5 PCoA diagram
由图5 可知,4 个污泥样品之间是离散的,表明各组之间微生物群落结构不同。样本点之间的距离表示各个样本的相似性及差异性,H2 与Q2 样品在PC2 影响因素上距离相近,可能是由于在活性污泥回流系统的作用下Q2 中混入部分H2,导致两者具有一定相似性;在两类影响因素上与H0 和H1 距离较远,说明随着TDS 的提高微生物群落结构发生显著变化。
4 微生物群落结构的差异性分析
4.1 门水平微生物群落结构的差异性分析
门水平下物种相对丰度如图6 所示。
由图6 可知,活性污泥中主要细菌门类共有5种,分别为Proteobacteria(变形菌门)、Bacteroidota(拟杆菌门)、Firmicutes(厚壁菌门)、Bdellovibrionota(蛭弧菌门)、Nitrospirotae(硝化螺旋菌门),其中Pro⁃teobacteria 和Bacteroidota 为各样品中的主要优势菌门。Proteobacteria 占比最大,为63.21%~75.98%,这与张兰河等〔19〕的研究发现相似,Jinchi YAO 等〔20〕还发现在高盐环境下Proteobacteria 和Bacteroidota 对反硝化及COD 降解起到重要作用;而次优势菌门中Nitrospirotae 占 比 为3.05%~3.26%,Tongdou ZHU等〔21〕发现其在硝化作用中起关键作用,保证了活性污泥系统的硝化能力;其他2 个次优势菌门中,Firmicutes 大多可产生芽孢,能够抵抗脱水和极端环境〔22〕,Bdellovibrionota 中的BeT/BeTs 基因可从海水或猎物细菌细胞中引入甜菜碱,抵抗高TDS 环境〔23〕,两 者 的 物 种 丰 度 分 别可 达1.75%~3.51% 和1.08%~2.71%,能够促进高盐环境下活性污泥系统对污染物的去除。

图6 门水平下物种相对丰度Fig.6 Relative abundance of species at phylum level
随着TDS 的提升,Proteobacteria、Bacteroidota 的相对丰度变化差异较小,始终占据优势菌门的地位,而次优势菌门Nitrospirotae、Firmicutes(厚壁菌门)与Bdellovibrionota 的相对丰度有所提高,保证了高TDS环境下A2/O-MBR 工艺良好的降解有机物能力与脱氮能力。
4.2 属水平微生物群落结构的差异性分析
属水平下物种相对丰度如图7 所示。
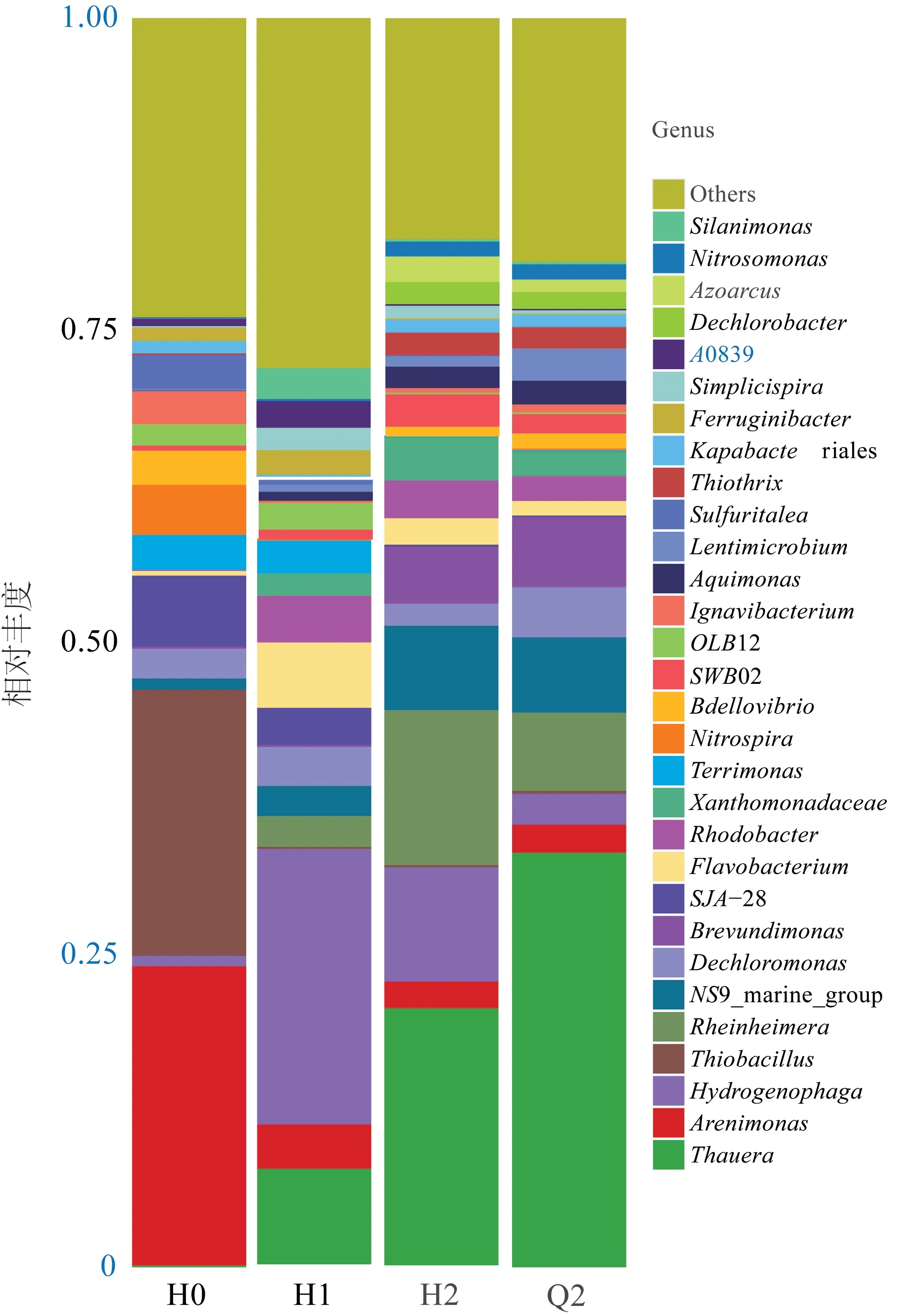
图7 属水平下物种相对丰度Fig.7 Species relative abundance at genus level
由图7 可见,H0 中Arenimonas(砂单胞菌属)作为需氧细菌菌属,可以降解各种糖和氨基酸〔24〕,有个别菌株含有反硝化作用的关键酶〔25〕,Thiobacillus(硫杆菌属)能够进行自养反硝化作用〔26〕,这2 种优势菌属在初期可以保证整个活性污泥系统的脱氮能力及降解污染物的能力。当TDS 提升至4 000 mg/L 时,2 种菌属的生长受到抑制,Hydrogenophaga(噬氢菌属)占据绝对优势,相对丰度最高达到15.6%,在此驯化阶段出水TN持续降低,可能是由于Hydrogenophaga参与了同步硝化-反硝化过程〔27〕。当TDS 为7 000 mg/L 时,原优势菌属逐渐被Thauera(陶氏菌属)和Rheinheimera(莱茵海默氏菌属)取代,Thauera物种丰度由0.12%快速增加至12.08%,Rheinheimera物种丰度由1.28%增加至7.23%。Thauera可降解的污染物广泛,有利于污水中污染物的去除〔28〕,且有研究发现Thauera与Rheinheimera在高盐环境下仍可保持良好的脱氮及降低COD 的能力〔29−30〕。缺氧池作为整个工艺的核心脱氮反应段,其对应样品Q2中的Thauera相对丰度占比最高(21.03%),这也是污泥驯化末期装置出水达标的主要原因。具有脱氯能力的次优势菌属Dechloromonas(脱氯菌属)在氯离子不断提高的情况下,相对丰度由1.03%增加至2.54%,促进了系统的硝化能力,NS9_marine_group 菌属因其较高的抗逆性〔31〕,相对丰度由0.73% 增至3.97%。次优势菌属的演替再次验证了最后阶段的良好出水水质状态;在整个耐盐活性污泥驯化及高盐废水处理过程中,系统功能菌种类丰度增加,处理能力得以增强。
5 结论
(1)耐盐活性污泥驯化期间微生物群落多样性与装置处理废水的性能变化显著。TDS 为2 000 mg/L 时A2/O-MBR 装置运行效果良好,出水各项指标波动较小;随着进水TDS 提升至4 500 mg/L,活性污泥的反硝化作用和COD 降解能力大幅削弱,装置出水COD、TN居高不下,但Venn 图、Alpha 多样性指数、PCoA 分析显示此阶段末期微生物群落的丰富度与多样性有所提高,装置出水最终可恢复正常;当进水TDS 提升至7 000 mg/L 后,微生物群落多样性显著降低,出水水质出现大范围波动,但系统内的微生物受盐离子胁迫刺激对盐耐受程度提高,装置的运行效果有所提升,最终各阶段出水的TN、NH4+−N、COD 均优于《污水综合排放标准》(DB 12/356—2018)要求。
(2)在耐盐活性污泥驯化期间,初始优势菌属Arenimonas(砂单胞菌属)与Thiobacillus(硫杆菌属)的优势地位逐渐被Dechloromonas(脱氯菌属)、Thauera(陶氏菌属)与Rheinheimera(莱茵海默氏菌属)等菌属取代,由于三者能够共同完成硝化、反硝化及降解COD 过程,保证了高TDS 环境下装置对污染物的去除能力和脱氮能力,为含盐废水处理过程中菌群的优化提供了依据。
