白介素-1受体相关激酶的免疫调控及其在炎症性肠病中的研究进展①
2022-08-30段正兰冯泽宇王包晟刘慧泽陈玉根南京中医药大学附属第一临床医学院南京210000
段正兰 冯泽宇 王包晟 刘慧泽 陈玉根 (南京中医药大学附属第一临床医学院,南京 210000)
炎症性肠病(inflammatory bowel disease,IBD)是一个慢性、特发性、复发性和组织破坏性疾病,包括克罗恩病(Crohn's disease,CD)和溃疡性结肠炎(ulcerative colitis,UC)[1]。其特征为基因易感个体对肠道微生物产生异常免疫应答[2]。目前临床实践中,尽管抗肿瘤坏死因子治疗不断发展,IBD 管理仍然是一个艰巨的挑战[3]。传统IBD 治疗方法常导致多重严重的副作用和治疗耐药性[4]。白介素-1受体相关激酶(interleukin-1 receptor-related kinase,IRAKs)是一类与IL-1R 和TLR 信号转导相关的丝氨酸-苏氨酸蛋白激酶,在先天免疫、适应性免疫和炎症的正向或负向调节中均起主要作用。IRAK 家族参与NF-κB 信号、丝裂原活化蛋白激酶(MAPK)和肿瘤坏死因子受体(TNFR)超家族信号通路。近年研究表明,IRAK 与炎症疾病、代谢疾病、心血管疾病和肿瘤等有关[5]。
1 IRAKs结构、定位与表达
1.1 IRAKs 结构 IRAKs 家族有 4 个成员:IRAK1、IRAK2、IRAKM、IRAK4,具有相似结构域,包括1 个N 端死亡域(DD)、1个脯氨酸/丝氨酸/苏氨酸丰富域(ProST)、1个激酶/假激酶域和1个C端域(IRAK4除外)。DD 是蛋白相互作用的基序,与IRAK 与配体蛋白MyD88结合有关。C端区域对招募和激活下游效应因子TNF 受体相关因子6(TRAF6)具有重要作用[6]。其中 IRAK1、IRAK2、IRAKM 分别具有 3、2、1 个与TRAF6 相互作用的基序。IRAK4 如何与TRAF6 相互作用尚不清楚,似乎与磷酸化依赖的IRAK1 作用模式不同,仅有非磷酸化的IRAK4 可与TRAF6 结合[7]。IRAKM 在其伪激酶结构域中含有1 个鸟苷环化酶中心,FREIHAT 等[8]证明野生型IRAKM 能够通过其鸟苷酸环化酶中心产生环鸟甘酸(cGMP),对下游先天免疫信号起抑制作用。
1.2 IRAKs 定位与表达 人IRAK1 基因定位于染色体Xq28 区域,是由712 个氨基酸组成的蛋白,分子量约为 85 kD[9]。IRAK1 是通过配体与 IL-1R、TLRs 结合而启动的事件链中的重要中介物。鼠IRAK1 基 因 定 位 于 染 色 体 Xq29.52-29.7 区 域[9]。人和鼠IRAK1 均包含14 个外显子和13 个内含子。人IRAK1 广泛分布于各组织,鼠IRAK1 主要分布于肝脏、肾脏、睾丸[10-11]。
人IRAK2 基因位于染色体3p25.3~3p24 区域,是由590 个氨基酸组成的蛋白,分子量为65 kD,与IRAK1 具有相似的序列和功能。小鼠和人IRAK2表现出67%的序列一致性,在人体各组织器官中均有表达。
人IRAKM 基因位于染色体12q14.1~12q15 区域,是由596个氨基酸组成的蛋白,分子量为68 kD。鼠IRAKM 定位于10 号染色体。人IRAKM 主要存在于外周血白细胞,在其他组织中也有少量表达。多种细胞系研究中,IRAKM 仅在单核细胞中被检测到,其中巨噬细胞表达最高,在嗜酸性粒细胞和中性粒细胞中也呈高表达。相反,鼠IRAKM 在所有组织中均有表达,其中肝脏和胸腺表达最高。在细胞水平,鼠IRAM 主要表达于单核细胞、B 细胞和成纤维细胞。
人 IRAK4 基因位于 12 号染色体 12p11.22 区域,由460 个氨基酸组成,分子量为52 kD。与小鼠IRAK4 有87%相似性,84%同源性。鼠IRAK4 位于15 号染色体。IRAK4 在多种组织中均有表达,主要表达于肾脏和肝脏。
2 IRAKs转录调控
病原体相关分子模式(pathogen-associated molecular patterns,PAMPs),如细菌脂多糖和病毒RNA(图1),可与TLRs 胞外结构域结合,并启动先天免疫信号(图 1)[12-13]。PAMPs 的结合诱导细胞内Toll/IL-1R(TIR)域二聚,为下游信号转导分子招募提供了支架。髓样分化因子(myeloid differentiation factor,MyD88)由2 个蛋白-蛋白相互作用域组成,具有 1 个 N-端 DD 和 1 个 Toll/IL-1R 同源(TIR)域[14]。随后,MyD88和IRAK4、IRAK2通过死亡域相互作用形成1 个大的寡聚左旋螺旋信号复合物,称为Myddosome[15]。这个高阶复合体的组装导致 IRAK4 介导的IRAK1 募集和磷酸化,激活的IRAK1 进一步自磷酸化,导致ProST 区域过度磷酸化,这种过度磷酸化诱导IRAK1从Myddosome中解离并与下游效应因子肿瘤坏死因子受体相关因子6(TRAF6)结合[10,16-17]。随后,IRAK1 和 TRAF6 与受体复合物分离,并与预先形成的由转化生长因子激酶1(TAK1)、转化生长因子激活激酶结合蛋白1(TAB1)和转化生长因子激活激酶结合蛋白2(TAB2)组成复合物相互作用,这种相互作用诱导TAB2 和TAK1磷酸化,与TRAF6 和TAB1 一起转位至细胞质。在细胞质中,由 TRAF6、TAK1、TAB1 和 TAB2 组成的多聚体蛋白复合物进一步与泛素连接酶Ubc13 和Uev1A 结合,导致 TRAF6 泛素化,这是触发 TAK1 激酶活性的关键。激活的TAK1 磷酸化IκB 激酶复合物(IKKs)和丝裂原活化蛋白激酶(MKKs)。IKKs 磷酸化NF-κB 的抑制因子IκB 使其泛素化而被降解,使NF-κB 核易位激活下游一系列信号,导致炎症因子产生,如 IL-1β、TNF-α、IL-6 和 IL-18。激活的MKKs磷酸化并激活MAPK家族成员ERK/JNK/p38,随后,激活下游效应因子AP-1/CREB,促进炎症因子产生。IRAK1 还可与IRF7 相互作用并使其磷酸化,导致IRF7 易位进入细胞核并诱导Ⅰ型IFN 基因转录[18]。
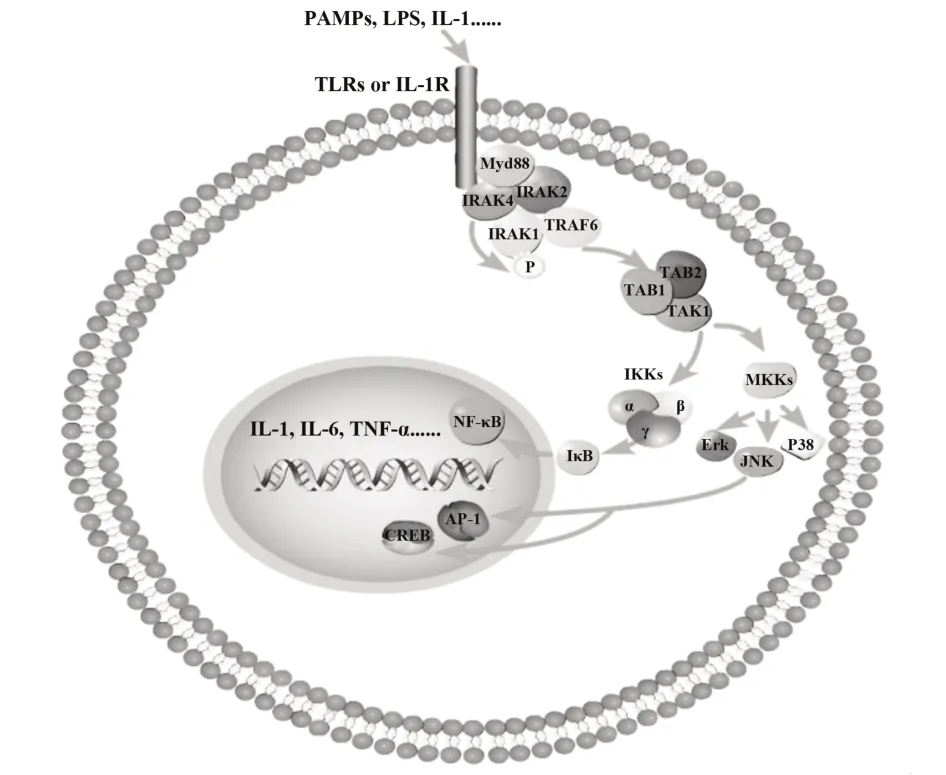
图1 IRAKs转录调控机制Fig.1 Transcriptional regulation mechanism of IRAKs
3 IRAKs在免疫应答中的作用
3.1 先天性免疫 单核细胞起源于骨髓中央循环白细胞,可分化为巨噬细胞和树突状细胞,是参与适应性免疫系统相互作用的抗原呈递细胞,IRAKs可调节单核细胞的免疫功能。IRAK1/4抑制剂消除了脂多糖和TLR2 配体Pam3Csk 刺激人髓系白血病单核细胞(THP-1)诱导的活性氧、IL-1β 生成、NK1/2磷 酸 化 、AP-1 和 caspase-1 激 活[19]。 TLR7/8 配 体R848 刺激人原代单核细胞后,IL-6、TNF-α 表达、IRF5 与 CXCL10 结 合 以 及 NF-κB p65 入 核 均 被IRAK4 抑制剂所逆转[20]。IRAK4-/-单核细胞 IL-10产生增加,当采用同种异体CD8+或CD4+T 细胞与IRAK4-/-单核细胞共培养时,CD8+T 细胞增殖减少。但 中 和 IL-10 可恢 复 CD4+、CD8+T 细 胞 增 殖[21]。IRAKM 可抑制促炎单核细胞极化,与野生型单核细胞相比,IRAKM-/-单核细胞中JNK1/2、miR-24、CCR5表达增加,SR-B1 水平降低。IRAKM-/-小鼠使循环血液中的CD11b+Ly6C+单核细胞增加,脾细胞中miR-24 水平升高,血液单核细胞中SR-B1 表达降低[22]。
IRAKs 可调节巨噬细胞极化、迁移和炎症因子释放。过表达IRAK4 逆转了过表达miR-93 引起的RAW264.7 巨噬细胞细胞因子、趋化因子产生和NF-κB 激活减少[23]。敲减 IRAKM 后,巨噬细胞RAW264.7 NF-κB 激 活 ,诱 导 IL-12 和 TNF-α 生成[24-25]。IRAKM-/-巨噬细胞在LPS、IFN-γ 刺激下,表面标志物 CD206 表达下降,HLA-DR 表达增加[26]。IRAK1-/-小鼠骨髓来源巨噬细胞中,CpG、R484、LPS(TLR9、TLR7、TLR4 配体)刺激后 caspase-1 剪切、IRAK1 与 ASC 结合、IκBα 降解和 IL-18 产生均明显减少[27]。IRAK1 可与包含 ASC 和 NLRP3 的炎症小体复合物共定位[28]。此外,IRAK1 可在小鼠巨噬细胞中与VASP 共定位。IRAK1-/-小鼠BMMs 迁移减弱,VASP 磷酸化降低[29]。IRAKM 敲除逆转了 LPS刺激BMMs引起的Nox-1、C/EBPβ、C/EBPδ表达增加及 Rac1、GPX3、过氧化氢酶、PPARα 和 PGC-1α 激活[30]。表明IRAK1 通过诱导下游炎症小体参与巨噬细胞炎症、迁移。
3.2 适应性免疫 IRAKs 可调节T 细胞增殖分化和Th1/Th17/Treg 平衡。IRAK4 抑制剂减少了人CD4+T细胞增殖,降低了CD4+IFN-γ+、CD4+IL-17+T细胞数量,并通过减少NF-κB、STAT1和STAT3磷酸化降低 CD4+T 细胞 IL-17、IFN-γ 分泌[31]。IRAK4 缺失的人群中,T 细胞活化的表面标志物CD25 和CD69表达下调,T 细胞分泌的 IL-6 和 IFN-γ 受损,说明IRAK4 与 T 细胞活化有关[32]。IRAK1-/-小鼠 T 细胞NFATc2 核水平及NFATc2 和Smad3 相互作用增加导致Treg 标志物Foxp3 水平上调。同时,IRAK1-/-T细胞中 IL-17 和 RORγt 表达减少,表明 IRAK1 通过NFATc2、Smad3 调节 Th17/Treg 平衡[33]。IRAK1 通过上调IL-23R 和随后的STAT3 磷酸化促进Th17 细胞产生,还通过促进T-bet产生和减少Treg生成促进Th1 分 化[34]。 经 IRAKM siRNA 处 理 后小 鼠脾 脏CD4+、CD8+T 细胞增加,凋亡数减少,IRAKM-/-小鼠肺内CD3+CD4+Foxp3+T 细胞百分比低于野生型小鼠,而 CD3+CD4+IL-17A+T 细胞、Th1 及 Th17 相关细胞因子在IRAKM-/-小鼠肺组织中显著升高,表明IRAKM负向调节Th1/Th17/Treg平衡[35-36]。
IRAK4 与 B 细胞活化成熟相关,IRAKM 影响 B细胞的功能。 IRAK4 及MyD88 缺陷患者IgM+IgD+CD27+B 细胞亚群特异性降低,IRAK4 缺陷患者IgM+IgD+CD27+B 细胞减少不随年龄增加而得到补偿[37]。IRAK4 缺失人群血清中结合碳水化合物IgM 较正常人显著降低,补体结合减少,且IgM 对肺炎链球菌、金黄色葡萄球菌的识别能力下降[38]。IRAK4-/-小鼠在感染弓形虫后卵泡和生发中心面积减小,总B细胞、B细胞活化标志物CD86、CD69表达和 Ki67+B 淋巴细胞数减少[39]。IRAKM-/-B 细胞中CD86、MHC分子Ⅰ-Ab表达、IκBα降解增加[40]。
4 IRAKs在肠炎中的作用
4.1 IRAK1 IL-1 诱导产生的 GM-CSF+CD4+T 细胞是一种独特T 辅助细胞群,通过影响造血系统向粒-单核细胞分化以及促进M1 型巨噬细胞分化导致结肠炎,将 WT 和 CSF2-/-小鼠的 CD4+CD45Rbhi细胞移植到Rag1-/-受体小鼠中诱导结肠炎,移植CSF2-/-T细胞后的Rag1-/-小鼠体质量下降缓解,组织病理学显示炎症细胞浸润减少,病理评分显著降低,但移植了WT CD4+T 细胞的Rag1-/-小鼠在结肠固有层白细胞(LPLs)和肠系膜淋巴结(MLNs)中检测到大量GM-CSF+CD4+T 细胞,IL-17a+和 IFN-γ+T 细胞显著增加。在DSS 诱导的结肠炎中,GM-CSF 缺乏小鼠肠炎显著减轻。而GM-CSF+CD4+T 细胞的产生依赖IL-1/IRAK1 信号通路,IL-1β 可促进 IRAK1 泛素化,导致下游p65 激活,免疫沉淀实验发现p65 可直接结合至CSF2 基因的启动子区域。体外培养WT 和IRAK1-/-CD4+T 细胞时,IRAK1 缺陷显著抑制GM-CSF+CD4+细胞分化,IRAKM 缺失对 IL-1 诱导的GM-CSF 生成无显著影响[41]。BERGLUND 等[42]证明IRAK1 缺陷小鼠改善了DSS 处理后小鼠体质量、脾脏重量下降。但IRAK1-/-雄性小鼠对局部结肠炎和胸腺萎缩具有显著保护作用,而雌雄小鼠无保护作用,表明IRAK1 在DSS 诱导的结肠炎中具有性别特异性。JIN 等[43]发现质核糖核蛋白Ⅰ(hnRNPⅠ)上皮特异性敲除的新生小鼠结肠中IRAK1 蛋白水平异常升高,无法对环境微生物产生免疫耐受,出现早期自发的结肠炎,提示hnRNPⅠ可能通过抑制IRAK1 对新生儿免疫适应、结肠炎预防起关键作用。炎症条件下,IRAK1-/-CD4+T 细胞在脾、肠系膜淋巴结、结肠组织中分化为Th1 细胞和Th17 细胞能力受损,体外转录组分析显示IRAK1 促进T 细胞激活和肠道归巢分子表达。IRAK1-/-T 细胞接种至Rag1-/-小鼠后未能上调表面α4β7 整合素表达,显著降低了T 细胞诱导肠炎的能力,表明IRAK1 通过调节T细胞活化、分化和肠道归巢引发肠道炎症[34]。
IRAK1 与UC 患者活动期病变中趋化因子和急性期蛋白表达升高密切相关,可能与UC 患者病变部位炎症细胞浸润增加有关。与正常黏膜相比,UC患者活动期病变部位 IL-36α 和 IL-36γ mRNA 表达明显增高,CD 患者活动期病变中IL-36α 和IL-36γ mRNA表达有所增加,但差异无统计学意义。IL-36α和 IL-36γ 可促进 MyD88 接头蛋白和 IRAK1 形成复合物,从而激活下游信号通路,诱导结肠上皮细胞趋化因子和急性期蛋白表达,如CXCL1、CXCL2、CXCL3、IL-1β、补体C3、补体因子B、ICAM-1和IL-32。这些趋化因子的产生与IRAK1/4 通路密切相关,当MyD88、IRAK1、IRAK4、TRAF6 和TAK1 分别被抑制后,IL-36α 和 IL-36γ 诱导的趋化因子表达显著下降[44]。
IRAK1 是肠炎发生发展中的关键因子,多项研究表明抑制IRAK1 可改善黏膜屏障、降低氧化应激水平、减少炎症因子释放,从而有效缓解结肠炎相关症状。WU 等[45]发现含有 miR-146a 的胞外囊泡(EVs)通过靶向TRAF6和IRAK1缓解2,4,6-三硝基苯磺酸(trinitrobenzene sulfonic acid,TNBS)诱导的大鼠结肠炎,同时抑制 p65 和 IκBα 磷酸化,抑制炎症因子TNF-α、IL6和IL-1β等表达。此外,多个天然产物也可通过抑制IRAK1 相关通路改善化学诱导的动物肠炎模型。五倍子主要成分penta-O-galloylβ-D-glucose(PGG)通过抑制MyD88与巨噬细胞结合显著减少腹膜和结肠巨噬细胞IRAK1、NF-κB 和MAPKs 激活,抑制 IL-1、TNF-α 和 IL-6 表达,增加IL-10 表达。口服PGG 可抑制TNBS 诱导的结肠炎小鼠结肠缩短和髓过氧物酶活性[46]。人参皂苷Re可在体外抑制巨噬细胞TLR4 与LPS 结合,减少LPS刺激后巨噬细胞IRAK1、核因子κB 激酶亚基β(IKKβ)磷酸化和NF-κB 活化,以及LPS 刺激的腹膜巨噬细胞中IRAK1 和IRAK4 降解,降低促炎细胞因子TNF-α和IL-1β表达。口服人参皂苷Re可明显抑制LPS诱导的全身炎症和TNBS诱导的结肠炎,还可逆转紧密连接相关蛋白ZO-1、claudin-1 和occludin表达减少[47]。人参的另一种成分人参皂苷Rb1及其代谢物化合物K也可通过抑制IRAK1、IKKβ、NF-κB和MAPK(ERK、JNK 和p38)激活有效抑制促炎细胞因子产生,降低TNBS 诱导的肠炎小鼠环氧合酶2(cyclooxygenase 2,COX-2)和诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)表达,减轻结肠损伤[48]。熊果酸可通过抑制巨噬细胞中IRAK1、TAK1、IKKβ 和IκBα 磷酸化和巨噬细胞迁移,从而抑制 NF-κB 和 MAPKs 活化,导致炎症因子 IL-1β、IL-6、TNF-α 和 COX-2、iNOS 表 达以及 前 列腺素(PGE2)和NO 水平下降,从而显著改善TNBS 诱导的小鼠结肠炎[49]。何首乌用于治疗各种炎症性疾病,其甲醇提取物Ph-ME 可抑制腹膜巨噬细胞中NO、TNF-α 和 PGE2 释放。Ph-ME 通过抑制上游炎症信号级联反应,包括Syk、Src 和IRAK1,从而激活NF-κB、激活蛋白(AP-1)和 cAMP 反应元件结合蛋白(CREB)抑制促炎基因,如iNOS、COX-2 和TNF-α mRNA表达,显著改善DSS诱导的小鼠结肠炎[50]。
一项多中心、双盲、随机研究中,RDP58(一种新型的抗炎d-氨基酸十肽,通过干扰MAPK 前体和MyD88-IRAK1-TRAF6 蛋白复合物形成抑制促炎细胞因子合成)对UC 治疗效果显著。RDP58 干预第28 天后,高剂量组(300 mg)临床活动指数评分较安慰剂组显著降低,结肠组织学评分显著改善[51]。综上,IRAK1可能是治疗IBD的潜在靶点。
4.2 IRAKM IRAKM 对DSS 诱导的结肠炎及其进展具有显著抑制作用,IRAKM 敲除加重了DSS 诱导的小鼠结肠炎,提高结肠组织病理学评分和炎症因子表达,这是IRAKM 在结肠炎中作用的第一次研究[52]。作为 TLR 信号负调节因子的 IRAKM 表达依赖于肠道共菌群,在无菌小鼠中IRAKM 表达减少,而将共生菌引入无菌小鼠中可诱导IRAKM 表达。IL-10-/-IRAKM-/-小鼠肠炎加重,炎症细胞因子基因表达增加,表明IRAKM 在调节宿主与肠道菌群的免疫应答中发挥重要作用[53]。DASKALAKI 等[54]发现红藻中的新大黄三醇及其相关二萜可抑制巨噬细胞激活,并通过诱导IRAKM 表达促进M2 型巨噬细胞分化。IBD 患者 IRAKM 表达上调,IRAKM-/-小鼠对结肠炎和结肠炎相关肿瘤具有保护作用。IRAKM-/-小鼠肠道免疫系统对消除微生物易位后引起的上皮屏障损伤高度有效,这种作用机制与肠道相关淋巴组织增大、中性粒细胞迁移增加和T 细胞募集增强有关[55]。FERNANDES 等[56]发现活动性UC 和 CD 患者 IRAKM、Bcl-3 水平升高,IBD 可能与TLR-4 和TLR 抑制蛋白IRAKM 显著变化有关。GÜNALTAY 等[57]还发现 IRAKM 水平在淋巴细胞性结肠炎中也升高,可能是机体的一种应激性升高。
4.3 IRAK4 党参中分离出的Lancemaside A 可改善结肠炎,IRAK4 参与Lancemside A 的抗炎作用。Lancemaside A 在体外和体内均可抑制促炎细胞因子TNF-α和IL-1β产生,下调iNOS和COX-2表达,抑制IRAK4 及其下游信号通路激活,从而改善小鼠肠炎[58]。研究表明,IBD 患者 TNF-α 治疗无应答者先天免疫功能障碍与TLR-2、TLR-4和TLR-7刺激后无应答者细胞内IRAK4 积累、循环浆细胞样树突状细胞数减少和CD4+Treg数增加有关,表明IRAK4有望成为预测抗TNF-α治疗效果的血清学标志物[59]。
5 总结和展望
近年对IRAKs 家族在炎症和自身免疫性疾病中作用的研究不断深入,尤其是其影响先天免疫和适应性免疫的内在分子机制研究证实IRAKs 在调节单核细胞、巨噬细胞、T 细胞等免疫细胞增殖分化及功能方面发挥重要作用(图2)。IRAKs 的4 个成员从MyD88、TIF 接收到激活信号后,家族成员可能相互作用或以复合物形式积累,调节下游级联蛋白,但其如何相互作用有待进一步研究。因此,同时双敲除或三敲除家族成员的研究将进一步增加该家族在自身免疫方面的认知。
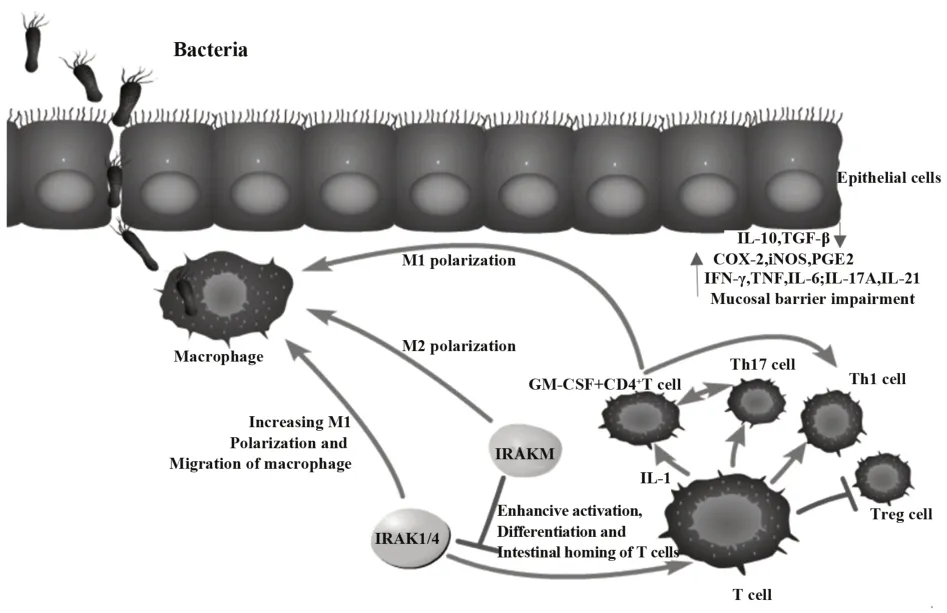
图2 IRAKs在IBD发病机制中的作用假想Fig.2 Hypothetical of IRAKs role in pathogenesis of IBD
深入研究IRAKs在IBD 发病中的作用或许能为IBD 预防、诊断和治疗提供新的靶标。目前,针对个体IRAK 的小分子药物已显示出对IBD 的潜在治疗作用,但尚缺乏临床验证,目前已有多种IRAK1/4选择性抑制剂进入临床试验,包括Pf-06650833(Pfizer)和CA-4948(Curis/Aurigene),前者用于类风湿关节炎(NCT02996500),后者用于非霍奇金淋巴瘤(NCT03328078)。但抑制IRAKs 可能导致机体免疫功能,因此,临床试验中还需评估其安全性。此外,大量研究发现,多种天然化合物可调节IRAKs 相关信号通路,需要更多研究发现特异性针对IRAKs 治疗IBD 的安全有效药物。总之,对IRAKs 的深入研究将为临床诊断和治疗IBD提供新的思路。
