类风湿关节炎患者SIRL-1表达及其调控NETs形成的作用①
2022-08-30袁佳仪司玉莹陈念贞范列英同济大学附属东方医院检验科上海200120
王 岚 袁佳仪 司玉莹 陈念贞 宗 明 范列英 (同济大学附属东方医院检验科,上海 200120)
中性粒细胞外捕网(neutrophil extracellular traps,NETs)是以中性粒细胞染色质解聚为DNA 骨架,附着组蛋白、蛋白酶和其他颗粒蛋白(如髓过氧化物酶、弹性蛋白酶)等形成的纤维网状结构,在清除病原体等有害物中起重要作用。但NETs 过度形成或NETs 产物清除失调将导致组织损伤、炎症并诱发自身免疫性疾病[1]。研究显示,RA 患者外周血中性粒细胞自发形成NETs 增多,NETs 产物与抗环瓜氨酸肽抗体(anti-citrullinated protein antibodies,ACPAs)和炎症标志物水平相关,可能是促进ACPA生成的主要机制之一[2-3]。目前RA 患者体内NETs形成增多的机制尚未阐明。SIRL-1 是表达于中性粒细胞、单核细胞等髓系吞噬细胞表面的抑制性受体,SIRL-1 mAb能够通过与SIRL-1特异性结合活化SIRL-1 信号、抑制 NETs 形成[4-5]。SIRL-1 基因多态性可影响其在单核细胞上的表达,与特应性皮炎发病相关[6]。本研究分析RA 患者外周血髓系吞噬细胞(中性粒细胞、单核细胞)和关节滑膜组织SIRL-1表达,探讨SIRL-1对RA-NETs形成的作用。
1 资料与方法
1.1 资料
1.1.1 研究对象 外周静脉血取自2019 年11 月至2020 年1 月于同济大学附属上海市东方医院就诊的RA 患者38 例和同期健康体检者(healthy con‑trol,HC)46例,样本来自血常规检查后的剩余血液。RA 组女 34 例,男 4 例,平均年龄(51.39±9.83)岁;HC 组女38 例,男8 例,平均年龄(55.16±14.46)岁,两组性别和年龄分布差异无统计学意义(P=0.371 0,P=0.160 7)。RA和OA关节滑膜组织蜡块(RA患者5例,OA患者4例)来自关节镜手术切除和病理检查后的剩余滑膜组织。RA 患者符合2018 年修订的中国类风湿关节炎诊疗指南,OA 患者符合中华医学会骨科学分会“骨关节炎诊疗指南(2018 年版)”。研究方案经同济大学附属东方医院医学伦理委员会审批备案[2016(伦)审第(011)号]。
1.1.2 主要试剂与仪器 聚-L-赖氨酸溶液、BSA、Triton X-100(Sigma-Aldrich 公司);Hanks 平衡盐溶液、RPMI1640 培养基、FBS(Gibco 公司);Ficoll-PaquePLUS(GE Health 公司);流式抗体CD11b/CD14/CD15/CD16、FITC 标记羊抗鼠 IgG(BD 公司);SIRL-1 mAb(Hycult 公司);兔抗MPO 单克隆抗体(Abcam公司);DyLight 594 标记的羊抗鼠IgG(Introgen 公司);Hoechst 33342、SYTOXTMGreen Nucleic Acid Stain(Thermo Fisher Scientific 公司);Fluoromount-G荧光封片剂(Southern Biotech 公司);流式细胞术分析仪(BD Calibur);多功能酶标仪(Spectra Max M5);荧光显微镜(Leica DM6000B)。
1.2 方法
1.2.1 免疫组化 将 5 例 RA 和 4 例 OA 滑膜组织切片高温脱蜡,滴加3%H2O2,室温静置15 min 清除内源性过氧化物酶。加入20%正常山羊血清封闭液室温孵育30 min,加入一抗SIRL-1 mAb(1∶100 稀释)4 ℃湿盒过夜,第2 天室温下复温1 h,加入相应二抗室温孵育1 h,DAB 显色,苏木精复染,冲洗,烤干,封片。显微镜下观察,阳性部位呈褐色,胞核呈蓝色。200 倍视野下计数每个视野下阳性细胞数,每张切片计数30个视野。
1.2.2 流式细胞术 收集30 例RA 患者、38 例HC新鲜EDTA 抗凝血,取100 µl 全血进行流式细胞术分析。采用特异性二抗FITC 标记SIRL-1 mAb,通过 FSC/SSC 和 CD11b、CD14、CD15、CD16 筛选中性粒细胞、单核细胞和嗜酸性粒细胞。每个样本计数10 000 个细胞,检测 SIRL-1 表达,FlowJo 软件处理数据。
1.2.3 人外周血中性粒细胞分离 采用Ficoll-PaquePLUS梯度密度离心法从EDTA 抗凝血中分离最下层细胞,加入红细胞裂解液静置10 min,Hanks 缓冲盐溶液洗2 次,分离得到原代中性粒细胞,含10%FBS的RPMI1640培养基重悬细胞并计数。
1.2.4 NETs 免疫荧光染色 预先配制0.001%多聚赖氨酸溶液包被细胞爬片,将计数完成的中性粒细胞按3×105个/孔接种于 24 孔板,37 ℃、5%CO2培养4 h,Hanks 平衡盐溶液清洗3 次,4%多聚甲醛固定,0.25%TritonX-100 透化,1%BSA 封闭,加入兔抗MPO 单克隆抗体(1∶100)4 ℃孵育过夜。次日加入Alex Fluor 488 标记的抗兔 IgG(1∶200)室温避光孵育 1 h。Hoechst 33342 复染,Fluoromount-G 封片,荧光显微镜下200 倍视野观察NETs 形成情况。为更直接地观察NETs 形成,采用活细胞膜不透性染料SYTOX Green 对胞外DNA 进行染色,荧光显微镜观察拍照。
1.2.5 NETs 定量检测 参照文献[7-8],采用细胞膜通透性染料Hoechst 33342、活细胞膜不渗透染料SYTOX Green 和髓过氧化物酶(myeloperoxidase,MPO)荧光显微镜下可视化NETs 形成,并采用活细胞膜不渗透染料SYTOX Green通过荧光强度定量评估同个体来源的中性粒细胞NETs 形成。选择分离纯化的中性粒细胞(RA 组8 例,HC 组8 例),免疫荧光染色方法同上,酶标仪检测:接种到黑色平底96 孔培养皿(3×105个/孔,200 µl 体系),根据实验条件选择是否采用SIRL-1 mAb 处理1 h,37 ℃、5%CO2培养3 h,SYTOX Green 染色20 min,如细胞膜完好,染料则不能与细胞内DNA 结合,Spectra Max M5 多功能酶标检测荧光强度(Ex:485 nm,Em:520 nm)。
1.3 统计学处理 采用SPSS20.0 和Graphpad Prism 8.0 软件进行统计分析和绘图。符合正态分布的各组间比较采用两独立样本t检验,非正态分布数据采用Kruskal-Wallis 检验。P<0.05 为差异具有统计学意义。
2 结果
2.1 RA 患者和OA 患者关节滑膜中SIRL-1 表达比较 采用SIRL-1 mAb对5例RA 关节滑膜和4例OA关节滑膜进行免疫组织化学染色,有棕色颗粒附着为阳性细胞,200 倍镜下统计每个样本30 个视野表达SIRL-1 的阳性平均细胞数,结果显示,RA 患者表达 SIRL-1 的 阳 性 细 胞 数 少 于 OA 组[(3.943±2.889)个vs(12.780±7.284)个,P<0.05,图1]。
2.2 RA 患者外周血SIRL-1 表达比较 流式细胞术结果显示,RA 患者 CD14−CD11b+CD15+CD16+中性粒细胞、CD14+CD11b−单核细胞SIRL-1 表达低于HC(P<0.05,P<0.01);RA 患者CD14−CD11b+CD15+CD16−嗜酸性粒细胞表面SIRL-1 表达虽略低于HC,但差异无统计学意义(P>0.05,图2)。
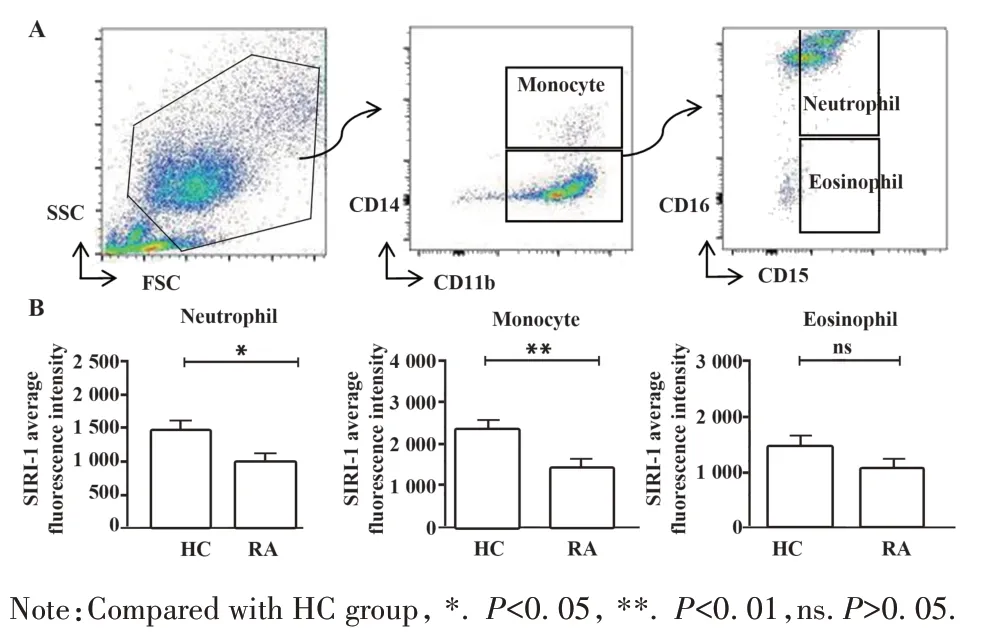
图2 RA和HC外周血主要吞噬细胞SIRL-1表达Fig.2 Expression of SIRL-1 on surface of primary phago⁃cytes cells in peripheral blood from RA patients and HC
2.3 SIRL-1 抑制RA 患者中性粒细胞形成NETs与HC 组相比,RA 组大部分中性粒细胞分叶核结构消失,胞外可明显观察到大量Hoechst 33342 和MPO 共定位的NETs,RA 组中性粒细胞更易自发形成NETs;而SIRL-1 mAb 预处理的中性粒细胞NETs形成明显减少(图3A)。多功能酶标仪对同一样本中性粒细胞的胞外DNA 进行检测,结果显示RA 组胞外DNA 荧光强度明显高于HC组(P<0.001)。HC组中,与无 SIRL-1 mAb 处理相比,SIRL-1 mAb 处理后DNA 荧光强度有减弱趋势,但差异无统计学意义(P>0.05);RA 组 SIRL-1 mAb 显 著 降 低 细胞外NETs-DNA水平(P<0.05,图3B)。

图3 RA 患者中性粒细胞自发形成NETs 的情况及SIRL-1 mAb对RA-NETs的影响Fig.3 Spontaneous NETs formation produced by neutro⁃phils from RA patients and effect of NETs on formation mediated by SIRL-1 mAb
3 讨论
NETs 在发挥胞外抗菌作用的同时暴露胞内成分,其清除缺陷及随后反应过程的调节失衡会加重某些自身免疫性疾病严重程度[9]。NETs 释放与ACPA 存在一定相关性,已有临床研究证实RA 患者体内NETs增多并与RA 疾病活动度和ACPA 滴度呈正相关。目前已知PADI4 催化组蛋白瓜氨酸化导致染色质解聚是NETs 形成的必要环节[10]。本课题组前期研究发现,PADI4在RA患者外周血单个核细胞及关节滑膜组织中表达明显升高,与RA 发生发展密切相关[11]。NETs 暴露瓜氨酸化蛋白刺激免疫系统被认为是促进ACPA 生成的主要机制之一,导致器官组织慢性、自身免疫性炎症性损伤[3,12-13]。表明调控NETs形成对RA防治具有重要作用。
SIRL-1是2010年首次报道的免疫抑制受体,与PD-1、CTLA-4 等免疫抑制受体表达部位不同,目前仅发现SIRL-1 表达于髓系吞噬细胞表面,在中性粒细胞和多数单核细胞上高表达、部分髓样树突状细胞上中度表达,而来源于淋巴干细胞的淋巴细胞和浆细胞样树突状细胞不表达[14]。中性粒细胞和单核细胞均为髓样干细胞分化而来,细胞膜上均带有FcR 和补体受体。报道指出,SIRL-1 mAb 能够激活中性粒细胞SIRL-1 信号,通过抑制FcR 受体介导的MEK-ERK 信号通路、抑制吞噬细胞内NADPH 氧化酶依赖性ROS 产生、抑制正常人抗中性粒细胞抑菌肽抗体诱导的NETs 形成[4]。本研究采用免疫组织化学染色法分析了RA和OA患者关节滑膜中SIRL-1表达,虽未特异性标记滑膜组织中的髓系吞噬细胞,但从免疫组化切片直观判断RA 关节滑膜组织中SIRL-1+细胞明显少于OA关节滑膜组织。进一步采用流式细胞术分析外周血中性粒细胞、单核细胞和嗜酸性粒细胞SIRL-1 表达,发现RA 患者中性粒细胞、单核细胞中SIRL-1表达明显降低。
现有研究显示RA 患者外周血中NETs 形成明显增多[15]。本研究通过细胞免疫荧光和酶标仪检测胞外游离DNA 共同证实了RA患者的中性粒细胞比HC的中性粒细胞更易自发形成NETs。
为阐明SIRL-1 信号对RA 患者中性粒细胞形成NETs 的影响,课题组收集活动期RA 患者外周血和HC 外周血各8例,通过密度梯度离心法体外分离中性粒细胞,实验组采用SIRL-1 mAb(1∶50)刺激中性粒细胞1 h,为保证抗体与细胞表面抗原充分结合,课题组将刺激时的反应体系维持在50µl,结果发现SIRL-1 信号能够激活中性粒细胞表面SIRL-1 信号;采用SIRL-1 mAb 刺激的RA 中性粒细胞与未使用SIRL-1 mAb 组相比,NETs 形成水平明显降低,与在系统性红斑狼疮中的观点相似[5]。说明SIRL-1 mAb能够调控SIRL-1信号,抑制NETs产生。
综上,RA 患者关节滑膜和外周血中性粒细胞、单核细胞存在SIRL-1 表达降低的现象,RA 患者中性粒细胞更易自发形成NETs,SIRL-1 mAb 活化SIRL-1 信号抑制RA 中性粒细胞NETs 形成。提示SIRL-1 表达可能与 NETs 形成相关,调控 SIRL-1 信号可能为RA生物防治提供新的策略。
