聚合物胶束作为抗癌药物纳米递送载体的研究进展
2022-08-30吕佳琦罗来龙李明媛
郭 娜,吕佳琦,李 云,李 媛,罗来龙,李明媛,
(1. 天津科技大学生物工程学院,天津300457;2. 解放军总医院京中医疗区中关村门诊部,北京100089; 3. 天津市透明质酸应用研究企业重点实验室,天津市康婷生物工程集团有限公司,天津300380)
目前,癌症是人类的第二大死因,预计在未来几 十年或将成为第一大死因[1].现阶段,癌症的主要治疗方法有手术、化学治疗和放射治疗等,其中化学治疗是常用的治疗方法[2].目前大多数的抗癌药物是疏水的低相对分子质量分子,应用于临床时,由于缺乏对肿瘤细胞的特异性、在体内环境中易失活、药物代谢动力学不足、毒副作用严重和细胞膜等天然屏障作用的问题,给治疗带来困难,极大限制了治疗药物在实际临床上的应用[3].为了克服这些缺点,纳米药物递送系统(nano drug delivery systems,Nano-DDS)作为疏水性抗肿瘤药物的载体得到了广泛研究.
1992年,Yokoyama等[4]提出聚合物胶束(polymeric micelles,PMs)可以作为一种新型的Nano-DDS后,胶束制剂便有望用于癌症治疗中的靶向输送抗癌药物.聚合物胶束亦称高分子胶束,是嵌段共聚物在水中通过疏水作用、静电作用等多种驱动力自组装包埋难溶性药物,形成尺寸在10~100nm的纳米结构的胶束溶液[5].聚合物胶束具有良好的自组装能力、溶解疏水抗癌药物的能力;其独特的壳–核结构可根据药物性质自由选择适宜的胶束载体;通过在胶束的亲水链段连接特异性抗体、配体或某些刺激敏感系统等,实现抗癌药物定位传递;其较小的尺寸使肝脏和网状内皮系统(reticulo-endothelial system,RES)难以识别,从而避免抗癌药物被肾脏快速清除,延长药物在血液中的循环时间,维持抗癌药物在体内的生物活性及功能[6];可选择性地在实体肿瘤中蓄积而达到治疗作用,能有效克服生物障碍,减轻抗癌药物的毒副作用,解决了常规化学治疗药物无靶向性的难题[7],被称为最有潜力的纳米药物载体系统之一[8]. 本文就聚合物胶束作为递送抗癌药物的常用材料、靶向策略及其在递送抗癌药物的临床应用现状进行总结.
1 聚合物胶束组成材料
用于递送抗癌药物的常用聚合物胶束有双嵌段共聚物胶束(A-B)、三嵌段共聚物胶束(A-B-A)和接枝共聚物胶束,主要由具有生物相容性的亲水链段和多功能载药核心的疏水链段组成[9].当疏水链段与亲水链段在水介质中达到或高于临界胶束浓度(critical micelles concentration,CMC)时,因分子间的相互作用力自组装形成了疏水基团在内、亲水基团在外的壳–核结构胶束溶液[10](图1).
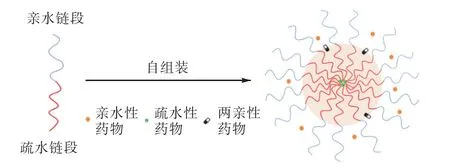
图1 水溶液中嵌段共聚物自组装成聚合物胶束 Fig. 1 Block copolymers in aqueous solution self-assembled into polymer micelles
疏水性和难溶性抗癌药物在聚合物胶束疏水性内核中的分配系数高,可以达到较高的载药量和包封率;而其亲水性外壳可载亲水性药物,壳–核交界处可载两亲性药物,可以广泛递送抗癌药物.
1.1 亲水链段材料
构成嵌段共聚物亲水链段的材料有聚乙二醇(polyethylene glycol,PEG)、聚乙烯醇(polyvinyl alcohol,PVA)、聚〔N–(2–羟丙基)甲基丙烯酰胺〕 〔poly(N-(2-hydroxypropyl)methylacrylamide, PHPMA〕、聚乙烯亚胺(polyethylenimine,PEI)、聚(N–异丙基丙烯酰胺)〔poly(N-isopropylacrylamide),PNIPAM〕和聚乙烯吡咯烷酮(polyvinylpyrrolidone,PVP)等[11].常用的亲水材料结构式如图2所示.PEG是非离子水溶性聚合物,能够在聚合物胶束表面聚集形成栅栏,有效避免与免疫球蛋白作用或被吞噬细胞吞噬,延长了抗癌药物在体内的循环时间.因其在水介质和几种有机溶剂中表现出良好的亲水性、低毒性[12]以及含有大量的羟基基团等优点而被广泛应用于生物医学和制药领域,是目前使用最广泛的亲水链段材料[13].多柔比星(doxorubicin,DOX)、喜树碱(camptothecin,CPT)和紫杉醇(paclitaxel,PTX)等抗癌药物均已成功与PEG偶联[14].
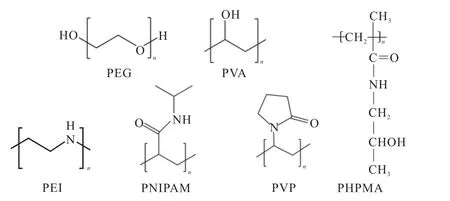
图2 常用的亲水材料结构式 Fig. 2 Commonly used hydrophilic material structure formula
Nosrat等[15]制备了生物素功能化的聚乙二醇–聚己内酯(Biotin-PEG-PCL)胶束靶向递送青蒿素(artemisinin,ART),以改善ART的不溶性.Biotin-PEGPCL可以缓慢释放ART,促进其在体内循环.乳腺癌模型的体内抗癌活性表明,负载ART的胶束与对照组相比,肿瘤体积减小了40mm3,显著增加了肿瘤中药物的蓄积.
1.2 疏水链段材料
构成嵌段共聚物疏水链段的材料可根据被包埋抗癌药物所需要的性质,通过设计与合成疏水链段的结构并对其进行相应的调整,从而提高药物的包封率及载药能力,实现抗癌药物的有效传递.与亲水链段相比,疏水链段具有更大的选择空间.
疏水链段的材料多为生物可降解高分子材料,一般分为合成材料与天然材料两大类[16].常用的合成材料有聚己内酯(polycaprolactone,PCL)、聚乙交酯(polyglycolide acid,PGA)、聚丙交酯(polylactide,PLA)、聚丙烯酸酯(polyacrylate,PA)、聚苯乙烯(polystyrene,PS)、聚乳酸–聚羟基乙酸共聚物(polylactic acid-polyglycolic acid copolymer,PLGA)、精胺和短链磷脂等[17].常用疏水合成材料结构式如图3所示.
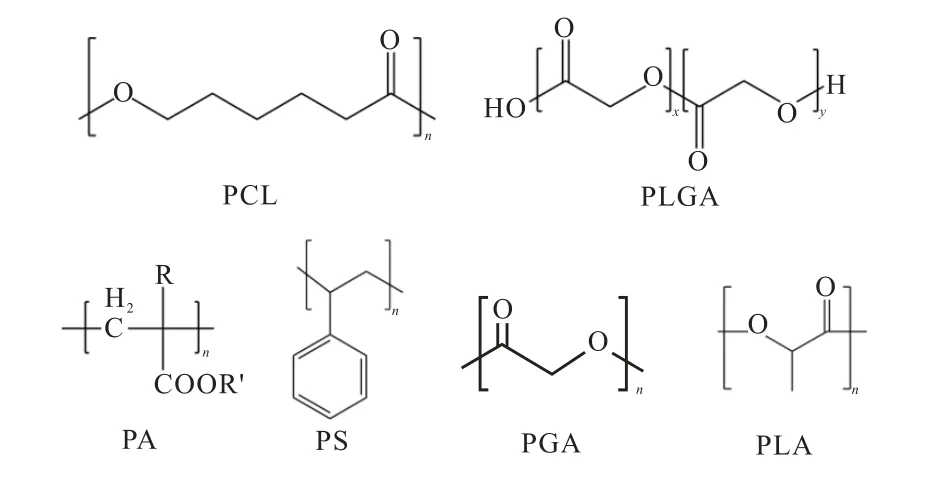
图3 常用疏水合成材料结构式 Fig. 3 Structure formula of common hydrophobic synthetic materials
疏水天然材料来源于生物,常用的有纤维素衍生物、壳聚糖衍生物、淀粉衍生物、酪蛋白等[18-19].这些疏水链段大多具有低毒性、生物相容性、可生物降解等优点,被广泛应用于胶束研究.
Chen等[20]设计一种新型的壳聚糖衍生物(GACS-TPGS共聚物),以此构建聚合物胶束包载PTX.GA-CS-TPGS共聚物具有增强生物黏附、抑制P-糖蛋白(P-gp)外排和肝脏药物代谢等优点.胶束包载PTX后显著增强了药物的溶解性和通透性,提高了PTX的生物利用度和抗肿瘤效果.与Taxol®相比,该PTX胶束将PTX的生物利用度提高了约3.80倍,增强了PTX的抗肺癌效果.
2 抗癌药物胶束制剂靶向策略
为了达到一定的治疗效果,临床常用抗癌药在肿瘤组织中必须达到有效药物剂量并反复给药,抗癌药物在体内的非特异分布给正常器官和组织带来毒性,其潜在的严重副作用严格限制了药物的给药剂量.因此,为了避免传统药物的治疗缺陷,靶向治疗癌症是治疗的关键.而聚合物胶束因其良好的生物相容性、安全性和靶向性,已成为抗癌药物纳米递送系统的主流[21].聚合物胶束载体可将抗癌药物选择性地递送到体内的特定位置,避免全身给药后的快速清除,提高药物的治疗效果,增加药物在肿瘤中的蓄积,减少药物的毒副作用,实现更有效的治疗. 聚合物胶束载体递送抗癌药物治疗肿瘤有被动靶向、主动靶向和刺激触发靶向3种策略[22].胶束制剂对肿瘤组织和细胞的药物靶向示意图如图4[23]所示.
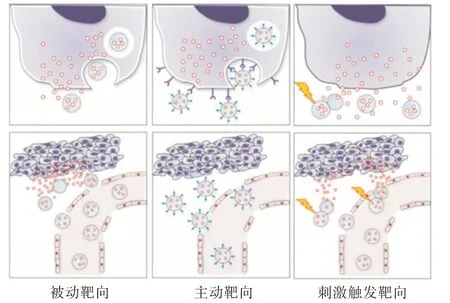
图4 胶束制剂对肿瘤组织和细胞的药物靶向示意图 Fig. 4 Schematic diagram of drug targeting micellar agents in tumor tissues and cells
2.1 主动靶向
主动靶向主要通过生物学的特殊相互作用将聚合物胶束与靶向配体结合[24].由于癌细胞和正常细胞的表面受体和抗原不同,靶向配体可识别癌细胞表面过度表达的靶点将癌细胞与正常细胞进行区分,将药物定向输送到肿瘤组织中,减少抗肿瘤药物对正常组织的不良影响,提高肿瘤组织中的药物浓度,改善细胞的识别能力,增强靶细胞的摄取能力,从而达到主动靶向的目的[25].目前叶酸、转铁蛋白、抗体和肽均已成功与聚合物胶束结合[26].
Kanazawa等[27]开发了一种具有脑肿瘤靶向、经鼻入脑适用的聚合物胶束载体,该载体是由TAT肽和铃蟾素修饰的硬脂酰基共轭聚合物胶束(BOM/PEGPCL-TAT)包载CPT靶向递送.该胶束在脑瘤模型中展示出良好的脑部递送效果,显著提高了抗癌药物CPT的治疗效果.
2.2 被动靶向
被动靶向即自然靶向,是由于肿瘤组织周围血管内皮细胞之间的缺陷,导致聚合物胶束载体在肿瘤中的累积速率远高于正常组织;而淋巴系统的缺陷导致聚合物胶束滞留在肿瘤中,这种现象被称为实体瘤的高通透性和滞留效应(enhanced permeability and retention effect,EPR)[28].利用EPR效应药物胶束能被动靶向并滞留在癌症病变部位,以疗效好、副作用小的特点使药物达到治疗作用[29].
抗癌药苯丁酸氮芥(chlorambucil,CLB)因其具有疏水性、不稳定性和毒副作用,严重制约了其在化学治疗中的应用.Hu等[30]以1,6-己二胺盐酸盐(HDH)为亲水链段,与疏水的CLB共价键合,制备了可在水溶液中自组装成两亲性的胶束CLBHDH.该胶束可以通过EPR效应被动靶向肿瘤组织,增强细胞内化.体外细胞毒性实验和体内抗癌实验均证实了CLB-HDH胶束与游离CLB相比具有良好的治疗效果,CLB-HDH胶束为CLB抗癌的临床应用带来了新的机遇.
2.3 刺激触发靶向
刺激触发靶向即通过制备刺激敏感聚合物胶束,在各种物理、化学或生化来源的内源性刺激或外源性刺激下引发胶束的崩解、失稳、异构化、聚合或聚集的反应,从而导致药物的受控释放[31].在肿瘤环境中,内源性刺激包括低pH、氧化还原电位、炎症引起的高温以及各种过表达酶的存在;外源性刺激包括温度、光(紫外线、可见光和红外线)、磁场、电场和超声波[32].刺激敏感胶束通过在空间或时间上进行控制,实现对癌症实际治疗的按需控制,确保了抗癌胶束制剂靶向治疗的有效性和安全性.
Emami等[33]研制了由α–生育酚(TOC)和肝素(HEP)组成的pH触发聚合物胶束,它可以包载多西紫杉醇(DTX)并靶向递送至乳腺肿瘤.负载DTX胶束具有pH药物释放依赖性.负载DTX胶束比游离DTX对乳腺癌细胞的毒性更大.与已上市的Taxotere®相比,负载DTX胶束治疗组的消除半衰期、血浆浓度曲线下面积和平均停留时间均显著增加.
3 抗癌药物共同递送胶束策略
目前常规的单一抗癌药物治疗可能会因为药物摄取少、药物流出增加、解毒蛋白激活、触发DNA修复过程和凋亡信号通路中断等而引发肿瘤耐药性及复发性[34],因此将抗癌药物与其他多种治疗方式结合已引起广泛关注.抗癌药物作为一种治疗方法主要与放射治疗、手术治疗联合使用[35],但放射治疗与手术治疗只能固定在一个区域,而抗癌药物可以杀死从原发部位扩散的癌细胞,具有其独特优势.因此,针对癌症化学治疗机制的多样性,开发不同联合用药治疗方式以增加协同效应具有重大意义.目前聚合物胶束载体已被应用于抗癌药物联合用药、抗癌药物与基因共同递送、抗癌药物与光敏剂共同递送.
3.1 抗癌药物联合用药胶束制剂
由于不同抗癌药物之间具有协同作用、多药耐药逆转作用和靶向性[36],联合用药都表现出比相应的单一抗癌药物更好的治疗效果.传统的临床抗癌联合用药是一种简单混合,而不同的抗癌药物具有不同的理化性质及药物代谢动力学性质,简单混合后药物之间的不协调分布使治疗具有局限性[38].而聚合物胶束可以将两种或两种以上不同抗癌药物在有效剂量内按所需的比例进行包载,同时输送到同一肿瘤部位,以达到最好的协同效果.与单一载药系统相比,聚合物胶束能逆转多药耐药性,从而发挥更好的抗癌效果.
Wan等[39]通过制备两亲性聚合物胶束包载PTX和顺铂(cisplatin,CDDP)用于联合治疗卵巢癌和乳腺癌.该胶束对两种药物的载药量超过50%,减缓了药物在血清中的释放,改善了药物代谢动力学,增加了药物在肿瘤中的分布.该研究表明共载PTX/ CDDP胶束的抗肿瘤活性优于单一药物胶束或其混合物.
3.2 抗癌药物与基因共同递送胶束制剂
克服耐药性的另一种方法是通过靶向沉默多药耐药相关蛋白〔如P-gp、多药耐药蛋白1(MRP1)或抗凋亡蛋白(如Bcl-2)〕基因[40],目前已开发出携带小干扰RNA(small interfering RNA,siRNA)的聚合物胶束.与常规化学治疗的胶束制剂不同,聚合物胶束的表面可以通过修饰带正电荷,利用核酸带负电荷的性质通过静电相互作用装载siRNA,并且同时将疏水药物装载到疏水性内核中,同时实现化学治疗和基因治疗的协同治疗作用[41].除了治疗性siRNA外,microRNA (miRNA)在过去几十年中也引起了广泛关注. miRNA不需要与信使RNA(mRNA)完全互补的碱基,具有抑制mRNA转录、翻译或剪切mRNA的功能,并允许同时调节多个基因[42].已有研究[43]表明,各种癌症中肿瘤抑制性miRNA的表达明显较低.通过合成肿瘤抑制性miRNA,靶向运送至肿瘤部位恢复肿瘤抑制性miRNA水平已被证明对癌症治疗有效[44].因此,miRNA已在基因治疗领域及其与化学治疗药物联合治疗癌症领域得到开发.
Christie等[45]通过嵌段共聚物与siRNA自组装,制备了粒径45nm的稳定多功能聚乙二醇–聚(L–赖氨酸)(PEG-b-PLL)胶束.该胶束由2–亚氨基噻吩(2-IT)修饰的赖氨酸和PEG末端的精氨酸–甘氨酸–天冬氨酸环肽(cRGD)组成.将siRNA掺入含有cRGD的稳定胶束中,可以提高基因沉默和细胞摄取的能力,增加药物胶束在肿瘤组织和肿瘤相关血管中的 蓄积.
3.3 抗癌药物与光敏剂共同递送胶束制剂
化学治疗和光疗的结合,对提高个性化精准治疗的安全性和有效性具有重大意义,在抗癌治疗中展示出良好的潜力[46].光疗指由非侵入性的光线刺激杀死肿瘤细胞,产生的副作用较小[47].光疗主要包括光动力疗法(photodynamic therapy,PDT)和光热疗法(photothermal therapy,PTT)两种形式[48],然而,由于光的穿透深度有限,单纯使用光疗很难将肿瘤完全消除,而化学治疗可以弥补这一缺陷.因此,将化学治疗与光疗进行联合的治疗方式将成为新一代癌症治疗的机遇和挑战.
Li等[49]开发了活性氧(ROS)响应型聚合物胶束药物传递系统,以PTX前药和荧光光敏剂Cypate为疏水链段,以PEG为亲水链段包裹PTX形成聚合物胶束.Cypate是一种典型的近红外染料,同时用作光敏剂和光热剂,胶束包载后提高了溶解度,在近红外光照射条件下触发光疗,促进PTX渗透杀伤癌细胞,实现了两亲性聚合物胶束化学治疗与光疗的有机结合,展示了化学治疗与光疗联合治疗癌症的应用前景.
4 抗癌药物胶束制剂产品研发进展
近几十年来,胶束制剂在癌症治疗中的作用尤为显著,在改善肿瘤药物治疗活性和减少药物毒性方面取得了巨大的成功,为抗癌药物纳米递送系统的进一步发展提供了坚实的基础.目前使用胶束制剂应用于临床研究的抗癌药物有PTX、DOX、CDDP、7–乙基–10–羟基喜树碱(7-ethyl-10-hydroxycamptothecin,SN-38)等[50].
4.1 国外抗癌药物胶束制剂产品研发现状
4.1.1 国外临床抗癌药物胶束产品研究情况
NK012是由化学偶联药物SN-38与PEGP(Glu)嵌段共聚物组成的胶束,主要用于治疗胃癌、直肠癌、乳腺癌[51].SN-38是伊立替康盐酸盐(irinotecan hydrochloride,CPT-11)的生物活性代谢物,具有抗肿瘤活性,但由于其极差的溶解性限制了药物的市场潜力[52].NK012是有史以来第一个成功地以20nm的药物载体传递SN-38,载药量约为20%. NK012具有清除慢、肿瘤聚集率高的特点.在日本和美国分别进行了两项独立的Ⅰ期临床试验,研究发现NK102能显著抑制肿瘤活性[53].目前NK012处于Ⅱ期临床试验阶段.
NK105是由PEG-P(Asp)共聚物经4–苯基–1–丁醇修饰的胶束,通过物理包埋法包裹PTX,适用于乳腺癌和胃癌的治疗[51].NK105的粒径约为85nm,载药量约为23%,易溶于5%葡萄糖溶液,可静脉注射给药[54]. NK105的PEG亲水外壳体积小、亲水性强,延长了药物的循环时间,显著降低了PTX的毒副作用. Nippon Kayaku公司于2004年开始NK105的Ⅰ期临床试验,目前在日本等地进行Ⅲ期临床研究[55].
NK911是负载DOX的PEG-P(Asp)胶束,DOX以物理方式包埋在核中,粒径约为40nm,适用于多种实体瘤.2001年在日本进入Ⅰ期临床试验,结果表明最低毒性剂量为 67mg/m2,推荐剂量为50mg/m2[56]. 目前正在进行Ⅱ期临床研究.
NC-6004是负载CDDP的PEG-P(Glu)纳米胶束,载药量为39%,平均粒径为20nm,主要用于胰腺癌的治疗[57].体外研究表明,该药物对各种癌细胞株的细胞毒性较低,体内抗肿瘤活性优于游离药物.NC-6004Ⅰ期临床研究于2006年在英国和美国启动,之后在中国和新加坡启动了针对晚期或转移性胰腺癌患者的Ⅰ/Ⅱ期临床研究[58].目前正在进行Ⅲ期临床研究.
SP1049C是由泊洛沙姆181(Pluronic L61)和泊洛沙姆407(Pluronic F127)混合胶束组成负载DOX的新型配方[59],主要用于治疗多药耐药性肿瘤,已经通过了Ⅰ期和Ⅱ期临床试验,目前正在研究用于食管或胃食管交界处(gastroesophageal junction,GEJ)腺癌的Ⅲ期试验[60].研究结果表明Pluronic L61共聚物将仓鼠卵巢CHRC细胞的药物摄取率提高了7.2倍,而Pluronic F127使该制剂具有物理化学稳定性,防止液相分离,并将胶束的有效尺寸保持在30nm以下而不影响胶束体系的细胞毒性[51].
部分国外临床研究的胶束制剂见表1[17,61].

表1 部分国外临床试验中的胶束制剂 Tab. 1 Some overseas clinical micelle preparations
4.1.2 国外上市抗癌药物胶束产品情况
Genexol®-PM是全球第一个上市的PTX聚合物胶束制剂,由mPEG-PLA共聚物自组装形成,平均粒径为20~50nm[62].Genexol®-PM原研公司为韩国Samyang,2007年1月首次在韩国上市,现已在印度、菲律宾、越南、印度尼西亚等亚洲国家上市[62];作为一线药物主要用于治疗复发性或转移性乳腺癌、卵巢癌,并与CDDP联合治疗非小细胞肺癌[63]. Genexol®-PM在肿瘤中的生物分布显示PTX水平是Taxol®的2.0~3.0倍,其体内抗肿瘤效果明显优于Taxol®,另外研究[64]表明Genexol®-PM使用安全,无过敏反应,大大降低了微生物污染和免疫抵抗的风险,具有更高的耐受剂量[65].
Paclical®于2015年在俄罗斯获得批准上市[66],该胶束结构中引入了Oasmia Pharmaceutical公司独有的新型辅料XR-17.XR-17是一种可被机体代谢的维生素A类似物,可形成20~60nm的胶束,对疏水药物PTX有增溶作用[67].研究[68]结果表明,Paclical®与当前市场上销售的PTX制剂Taxol®(脂质体制剂)、Abraxane®(白蛋白结合制剂)与Genexol®-PM相比,其载药量大大提高.
Nanoxel®的原研公司为Dabur Pharma,2007年 在印度上市[69].Nanoxel®是以PVP-PNIPAM为载体制备的PTX聚合物胶束制剂,胶束粒径为80~100nm[66].Nanoxel®不含表面活性剂,主要用于转移性乳腺癌、卵巢癌、非小细胞肺癌及艾滋病相关Kaposi肉瘤的治疗[64].Nanoxel®与Taxol®具有相同的药物代谢动力学特征和相似的抗肿瘤活性,但其 不良反应较少,不会引起过敏反应,安全性有所提 高[70].
国外已上市的胶束制剂见表2[71].

表2 国外已上市的胶束制剂 Tab. 2 Micellar preparations already on abroad markets
4.2 国内抗癌药物胶束产品研发现状
根据国家药品监督管理局上市药品信息查询发现,目前国内仅有上海谊众药业股份有限公司产品注 射用紫杉醇聚合物胶束获批上市(批准文号:国药H20210047).在药物临床试验登记与信息公示平台可以查询到国内处于临床试验的胶束制剂(表3).
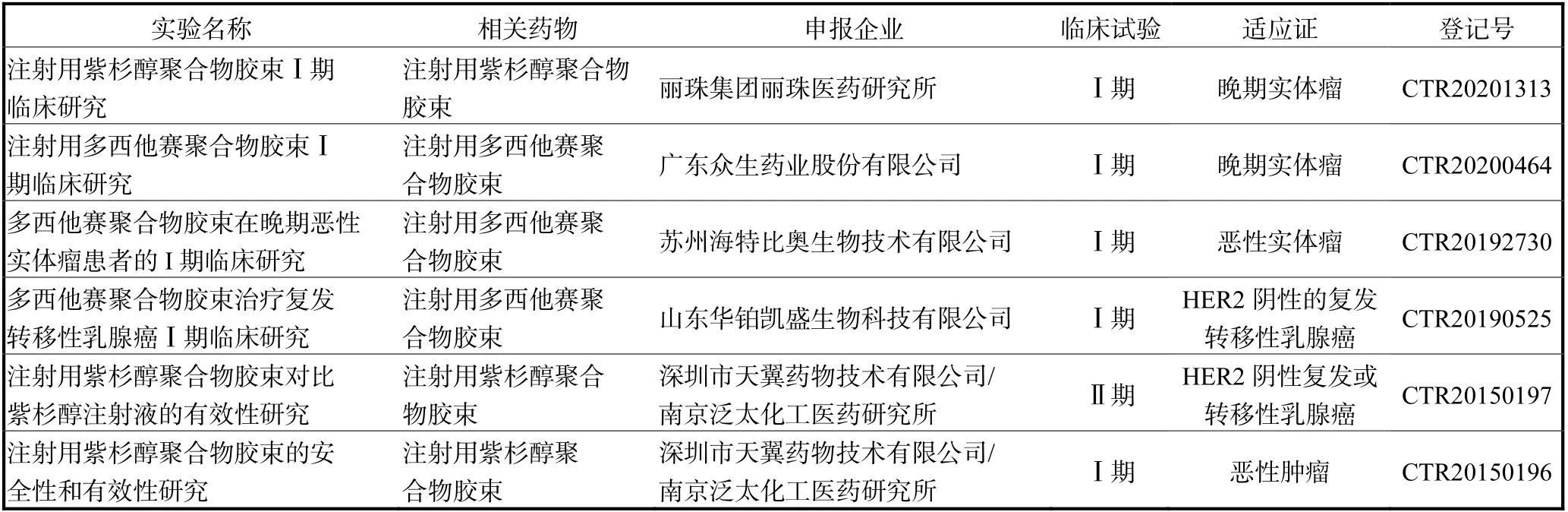
表3 部分国内临床中的胶束制剂 Tab. 3 Some domestic clinical micelle preparations
5 聚合物胶束作为抗癌药物纳米递送载体的局限及未来展望
迄今为止,几种抗肿瘤药物的胶束制剂已经在临床前和临床试验中得到了深入研究,明显改善了药物的功效、安全性、物理化学性质和药物代谢动力学,证明了胶束在递送抗癌药物方面的实用性.聚合物胶束小于100nm的尺寸使其在血液中长期稳定循环,基于EPR效应在肿瘤组织内蓄积,良好的生物相容性和生物降解性充分展示了胶束给药的显著优势;其特殊的壳–核结构,可以包裹不同性质的药物,广泛用于输送疏水性抗癌药物、金属配合物、siRNA等;大小易于控制且尺寸比其他纳米载体小、稳定性好、血液循环时间长;易于进行功能化修饰,将功能配体安装到聚合物中以实现智能聚合物胶束的制备,提高抗癌药物的生物利用度,降低免疫原性.因此,聚合物胶束作为抗癌药物的纳米递送载体可以降低给药频率,同时以最大的药理作用和最小的全身副作用达到治疗效果.与脂质体等其他纳米递送载体相比,聚合物胶束进行药物输送更实用,也更接近现实.基于抗癌药物胶束制剂在临床试验中的专利和发表文章数量,可见其在递送抗癌药物的领域中展示出巨大的潜力.
尽管在过去几十年中临床应用的聚合物胶束取得了显著进展,但癌症的遗传多样性和生物复杂性仍限制着聚合物胶束介导方法的治疗效果,因此新的抗癌药物递送策略成为可能,如胶束递送联合用药、抗癌药物与基因共同递送、抗癌药物与光敏剂共同递送、刺激敏感激活药物靶向等功能将成为治疗癌症的新趋势.虽然人们已从现有的研究中对聚合物胶束获得了一定的了解,但聚合物胶束递送抗癌药物仍面临许多挑战,如对其潜在的毒性、胶束的稳定性与药物递送之间的潜在机制尚不完全清楚,胶束如何与药物相互作用从而影响药物的稳定性,以及药物释放与胶束之间的关系等.现阶段,聚合物胶束递送抗癌药物面临的主要问题之一是其生产的可扩展性,在实验室中可制备载药量高、稳定性好的胶束,但在大规模生产中变量对物理因素的影响不同,这可能导致无法复制具有相同质量属性和规格的胶束,且大量生产成本较高,不能完全满足临床给药的要求.为了解决这些问题,科研人员需要对聚合物胶束的不同性质进行深入研究,要彻底了解聚合物胶束在体内的生物分布、药物代谢动力学、安全特性、免疫原性、免疫反应性和体内降解情况,从而控制聚合物胶束的化学物理性质,实现抗癌药物的有效递送.预计在不久的将来,胶束靶向递送抗癌药物将取代目前的化学治疗,充分发挥纳米医学的潜力.
