3种微藻藻际环境生物多样性及相互作用关系研究进展
2022-08-30侯路路
侯路路, 李 蕾
(1.中国海洋大学,山东 青岛 266003;2.烟台市海洋经济研究院,山东 烟台 264000)
引 言
藻际环境(phycosphere)是以微藻为核心的微生态结构,微藻生长过程中不断向周围释放多种胞外产物(ECPs),自藻细胞向外延伸一定距离内聚集了以细菌为主的大量微生物,形成了和微藻相互作用、具独特结构与功能的藻际微生物群落[1]。在藻际环境选择压力下,微藻和藻际微生物群落处于不断演替的动态过程中。
藻际微生物具有特异性,同一微藻在不同生境、不同生活周期中的藻际微生物结构也存在差异[3]。微藻新陈代谢过程产生并分泌的ECPs,包括碳水化合物、氨基酸、脂类、维生素、促进和/或抑制因子等[3],被藻际微生物摄取利用,代谢释放后为藻类提供营养及必需生长因子。微藻和藻际微生物相互协调并互为补充,通过ECPs共同调节藻际环境平衡[4]。
微藻中生物活性物质如类胡萝卜素、多不饱和脂肪酸等,具有抗氧化、消炎等作用,被应用于医药、食品等多个行业领域。目前已商业化或具备商业化前景的微藻有小球藻(Chlorella)、杜氏盐藻(Dunaliella)和雨生红球藻(Haematococcus)等。本文就这3种微藻藻际环境的微生物多样性特征、相互作用机制以及微生态调节等方面的研究进行了综述。
1 微藻藻际微生物多样性特征
单一微藻长期继代培养过程中,藻际微生物主要为细菌和真菌。
1.1 藻际细菌
藻际细菌与微藻的接触包括:自由生长在藻际环境中、依附于微藻细胞表面以及在微藻细胞内成为内共生菌[5]。目前已报道小球藻藻际细菌在变形菌门(α-, β-, γ-Proteobacteria)、噬细胞菌-黄杆菌-拟杆菌(Cytophaga-Flavobacterium-Bacteroides, CFB)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)和疣微菌门(Verrucomicrobia)中均有分布,其中α-变形菌菌属最为丰富,β-变形菌则为其特有类群。杜氏盐藻藻际细菌主要有α-Proteobacteria、γ-Proteobacteria和放线菌门菌属,其中γ-变形菌是优势类群。雨生红球藻藻际细菌包含变形菌门(α-, γ-Proteobacteria)、CFB、厚壁菌门、放线菌门和浮霉菌门(Planctomycetes)菌属,α-变形菌是第一代表性类群。其中α-变形菌在3种微藻藻际环境中均有分布,蓝细菌(Cyanobacteria)也在小球藻和雨生红球藻藻际环境中成功分离。相关藻际细菌组成见表1。
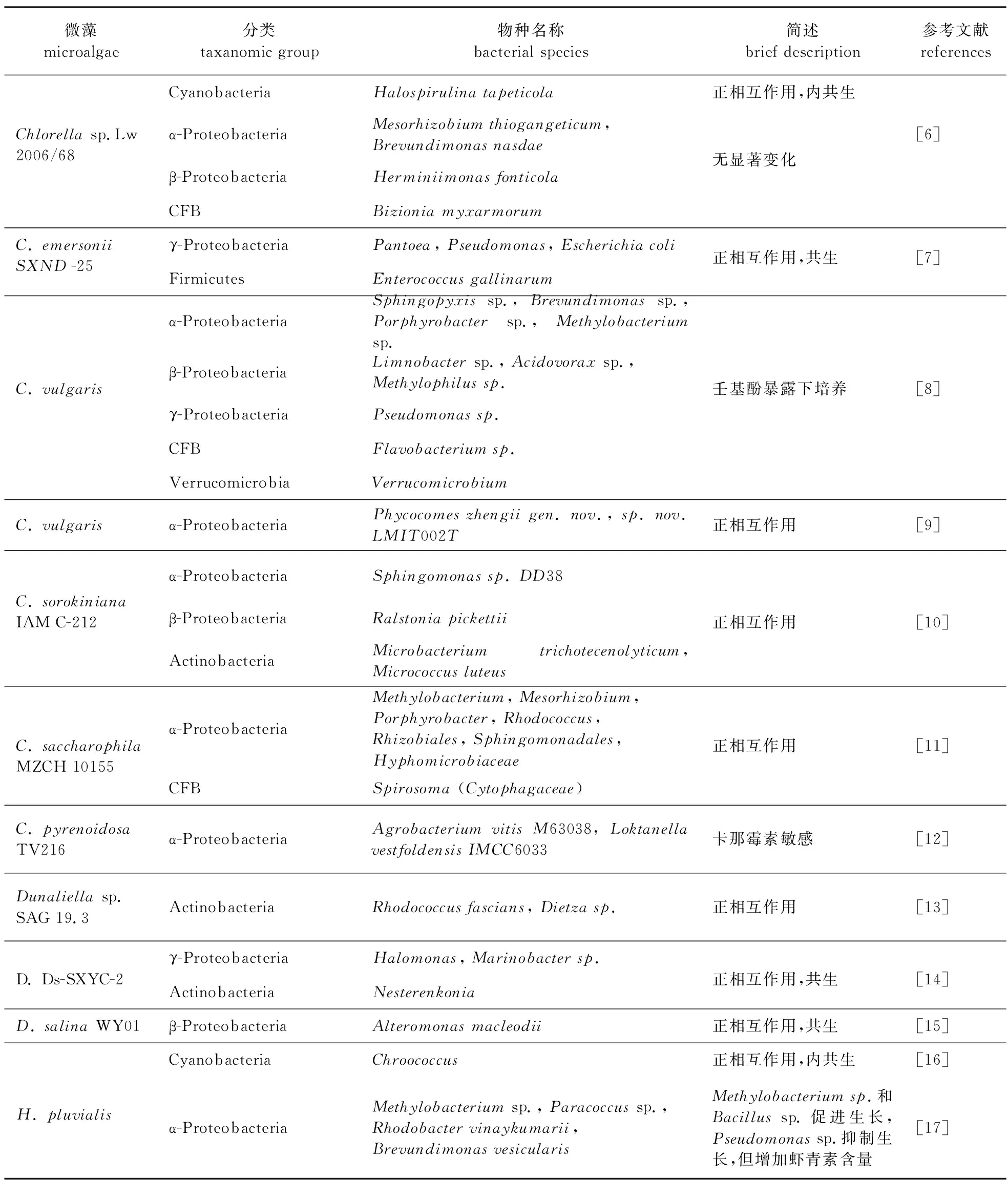
表1 常见微藻藻际细菌组成

续表1
1.2 藻栖真菌
藻栖真菌包括单细胞真菌和丝状真菌,通过释放抗生素或抗生素类物质,以及寄生溶藻方式对微藻产生影响。藻栖真菌在微藻中寄生较为普遍,光自养条件下,C.sorokinianaIAM C-212藻际环境中的AcremoniumCSSF-1直接附着在藻细胞表面[10]。雨生红球藻中专一性寄生真菌P.sedebokerensis,可以感染来自不同地理位置的60株雨生红球藻[19]。相关藻栖真菌组成见表2。

表2 常见微藻藻栖真菌组成
2 藻际环境中的相互作用
藻际环境中微藻与微生物群落种间关系包括正相互作用、负相互作用。正相互作用包括互利共生、偏利共生和原始协作;负相互作用包括竞争、捕食、寄生、偏害等。
2.1 正相互作用
微藻和藻际微生物间的相互作用具有种属特异性,并通过ECPs形成良好的营养互补。已报道基于藻-菌系统的Pseudomonassp.和Clostridiumthermocellum分别通过甘油三酯[21]和甲烷氢[22]参与C.vulgaris生物质和生物燃料的生产。在1∶1共培养体系下,Halomonassp. B3促进D.salinaDs-SXYC-2生长及代谢产物累积,盐藻多糖、蛋白质、总脂含量分别比对照组增加了34.8%、71.2%和37.6%[14]。
微藻和藻际微生物通过调整新陈代谢以满足彼此需要。AgrobacteriumtumefaciensWB-1促进了C.salina对As(III)的富集和形态转化[23]。异养条件下,C.vulgaris与Azospirillumbrasilense共固定能增加脂肪酸和总脂质的积累[24]。Halomonassp.产生的Fe(III)载体提升了D.bardawil的Fe摄取水平,促进其在缺铁条件下的生长[25]。PaecilomyceslilacinusTD16的胞外蛋白和多糖都可促进H.pluvialis生物量和脂类含量增加[26]。
2.2 负相互作用
在营养限制条件下,藻际微生物和微藻因生态位重合,对现有营养物质的竞争,使微藻生长减缓。藻际细菌寄生时,微藻细胞在葡萄糖苷酶、几丁质酶、纤维素酶等酶作用下裂解。病原真菌P.sedebokerensis在感染H.pluvialis的早期分泌多糖水解酶类降解细胞壁多糖,穿透其特殊细胞壁结构,释放甘露寡糖进一步促进真菌寄生过程[20,26]。
3 藻际环境中的微生态调节
3.1 群体感应信号
群体感应信号(quorum sensing, QS)是一种基于微生物密度的基因表达调控方式,通过合成并释放AI信号分子,微生物中的相关基因启动并表达,进而调控种群密度、生物膜发生(生态位提供)、毒素产生(溶藻行为)以及碳氮等营养物质加工转化等生物行为[27]。藻际微生物ECPs通过信号分子影响藻际环境,QS可使微藻分泌的ECPs明显增多,研究最多的是高丝氨酸内酯AHLs[28]。
C.saccharophilaCCAP211/48在2 h培养过程中持续抑制了VibrioharveyiJMH612 AHL调节的发光性[29]。营养饥饿下C.pyrenoidosaNCIM-2738的叶黄素通过与LasI、LasR、RhlI和RhlR蛋白质对接,参与QS途径生物膜形成[30]。作为抗生素和细胞-细胞通讯的信号分子,Pseudoalteromonaspiscicida释放的高浓度HHQ,接触D.tertiolecta时,未观察明显生长速度变化[31]。
3.2 微食物环
微食物环(microbial loop)是指异养细菌将有机物分解利用,转化为自身颗粒有机物(次级生产力),后经原生动物摄食进入主食物链[20]。异养细菌既是分解者,也是生产者。
藻际环境中微藻和藻际微生物形成物质微循环,ECPs中的多糖被微生物降解为溶解有机碳(DOC),通过扩散和矿化作用进一步转化为颗粒有机碳(POC)。不易被分解的多糖可作为沉积物碳库的重要组成,形成碳封存和碳汇。ECPs中的透明胞外聚合颗粒物(TEP)由溶解性有机碳在非生物力作用下自发凝聚形成,是DOC转为POC的非生物途径[32]。TEP具有高的碳氮比,在很大程度上影响颗粒性有机碳库和微食物环结构。C.vulgaris和D.tertiolecta的DOC平均最大释放量分别占总有机碳的6.4%和17.3%,微藻光合作用的固定有机物流失到藻细胞周围,反过来支持了细菌生物量的显著增长[33-34]。
4 总结
对于微藻藻际环境的研究,包括藻际环境的组成,微生态、微循环的结构与功能,微藻和藻际微生物的相互作用等,目前已取得了多方面的进展。基于微藻藻际微生物的生态多样性,未来可着眼的研究方向包括:(1)通过藻际环境ECPs,分析微食物环中物质循环降解和聚合的作用,以及微藻和微生物化学信号物质及作用机理,揭示碳氮等生源要素物质活性和生物微生态位特征;(2)关注不同培养条件和不同生活周期中的藻际环境变化,结合组学和群落分析法相关技术,对特定藻类不同的藻际微生物结构和成因有更深了解;(3)结合多种技术方法培养无菌化藻种,分析微藻病害机理和防御机制,揭示共生微生物和寄生微生物、藻际微生物和游离微生物的关联作用机制,在互利共生基础上构建藻-菌生物互作研究平台。
