颅内动脉瘤大鼠不同组织中端粒长度与动脉瘤大小的相关性
2022-08-29裴美娟史新宇于海波
裴美娟,于 迪,史新宇,于海波
颅内动脉瘤(intracranial aneurysm,IA)是颅内动脉血管壁因局限性病理性扩张而发生的瘤样突起,是导致出血性脑卒中的重要疾病之一,总人口发病率为2%~5%,IA年破裂率为0.8%~2%,并与患病时间呈正相关。端粒是衰老领域近年来的研究热点,端粒的重复序列TTAGGG帽结构能够发挥保护染色体、维持遗传系统稳定的作用。同时,端粒也会随着细胞分裂而逐渐缩短,当其缩短达到临界长度时,会导致细胞失去分裂增殖能力并衰老凋亡。研究发现,端粒长度变化在IA的发生发展中可能扮演重要作用,本实验拟进一步探讨在IA模型大鼠体内,不同组织中端粒长度变化是否一致,并与IA的大小进行相关性分析,以求寻找能够更为准确预测IA形成的生物学标志物。
1 材料与方法
1.1 实验动物 清洁级雌性SD大鼠50只,6~7周龄,体重200~250 g,购自军事医学科学院实验动物中心,每日光照12 h,5只/笼,标准饮食适应性饲养1周。许可证号为SCXK-(军)2012-0004。
1.2 主要仪器设备 手术显微镜及显微手术器械(新天医疗有限公司),NanoDrop 2000(Thermo Fisher Scientific,美国),real-time PCR仪(Step One,美国),扫描电子显微镜(莱卡公司,美国)。
1.3 主要试剂耗材 0.9%氯化钠注射液、戊巴比妥钠、肝素钠、L-甲硫氨酸(北京索莱宝科技),肝素抗凝管(积水医疗公司),DNA提取试剂盒(北京天根生物科技),real-time PCR试剂盒(UltraSYBR Mixture With ROXⅡ,北京康为世纪),Batson's #17组织侵蚀试剂盒(东莞市汉诺生物技术)。
1.4 大鼠分组及模型的构建 SD大鼠随机分为2组(=25),IA组和对照组。腹腔内注射1%戊巴比妥钠(40 mg/kg)麻醉。 IA组操作:颈中线切口,分离颈总动脉和迷走神经,结扎右颈总动脉。背部纵向切口,切除卵巢。显微镜(10x)下分离双侧肾动脉后支并结扎。对照组:暴露右侧颈总动脉和肾动脉双侧后支15 min,关闭伤口缝合皮肤。术后大鼠正常饮食。如出现不进食症状或死亡,进行相应补充。1周后,IA组喂食含有3%L-蛋氨酸和8%氯化钠的饲料,对照组予正常饲料,两组均予自由饮食。
1.5 标本采集 术后6个月,SD大鼠腹腔注射戊巴比妥钠麻醉后采集标本。(1)血液:眼眶取血0.5 ml,肝素抗凝;(2)皮肤:剪取双侧耳缘皮肤3 mm×3 mm;(3)肌肉:取右侧大腿部骨骼肌组织约1 g;(4)心肌、主动脉、脾脏、肾脏:完成血管铸型后解剖取材。所有组织标本均在-80 ℃条件下储存。
1.6 血管铸型及扫描电子显微镜观察
1.6.1 灌注液配置 将Batson’s #17组织侵蚀试剂盒中的Base Solution A 分两等份(100 mL/份),其中一份加25 ml催化剂Catalyst,另一份中加入24滴促进剂Promoter C。灌注前将两份Base Solution A混合均匀,加2%红色染料,30 min内完成灌注。
1.6.2 血管铸型 颈椎离断法处死SD大鼠,16号灌胃针从左心室插入升主动脉,剪开左心耳排空血液后将10 ml混合之后的单体树脂灌注液缓慢注入,直至左心耳流出灌注液。灌注完成后,将大鼠整体置于通风橱内1 h待树脂凝固,取出大脑,仅保留颅底动脉及附着的脑组织,浸泡于质量浓度为50%氢氧化钠溶液内3 d,每2 h摇晃一次,每2 d更换溶液一次,制得完整Willis环。扫描电子显微镜下观察,记录IA大小及分期。
1.7 荧光定量PCR 按照试剂盒说明书提取各组织及血液的基因组DNA。所有反应条件分两步进行:95 ℃预变性10 min,95 ℃ 15 s和60 ℃ 1 min共40个循环,然后0.3 ℃梯度升温进行熔解曲线分析。 使用2方法计算每个基因的相对表达水平。端粒引物序列:上游-GGTTTTTGAGGGTGAGGGTGAGGGTGAGGGTGAG GGT(终浓度100 nmol/L),下游- TCCCGACTATCCCTATCCCTAT CCCTATCCCT ATCCCTA(终浓度900 nmol/L)。内参GAPDH引物序列:上游- TACACTGAGGA CCAGGTTG(终浓度400 nmol/L),下游- CCCTGTTGCTGTAGCCATA(终浓度400 nmol/L)。
2 结 果
2.1 IA形成情况 通过显微镜观察血管铸型,IA组共有20只(18%)大鼠形成动脉瘤,其中3只(12%)形成Ⅰ期瘤体,9只(36%)形成Ⅱ期瘤体,3只(32%)形成Ⅲ期瘤体,5只(20%)形成为多发动脉瘤,共形成28处瘤体。其中Ⅱ期以上瘤体24个,Ⅱ期瘤体直径为(94.46±42.00)μm,Ⅲ期瘤体直径为(262.43±146.59)μm。
2.2 大鼠组织端粒长度变化 以对照组骨骼肌组织的端粒长度为标准,绘制各部位端粒长度变化。可见与对照组比较,IA组心肌组织和主动脉组织端粒长度增加,血液中细胞端粒长度显著缩短,差异有统计学意义(<0.05);脾组织、肾组织、骨骼肌组织以及皮肤组织中,两组的端粒长度变化差异均无统计学意义(>0.05,表1)。
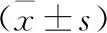
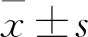
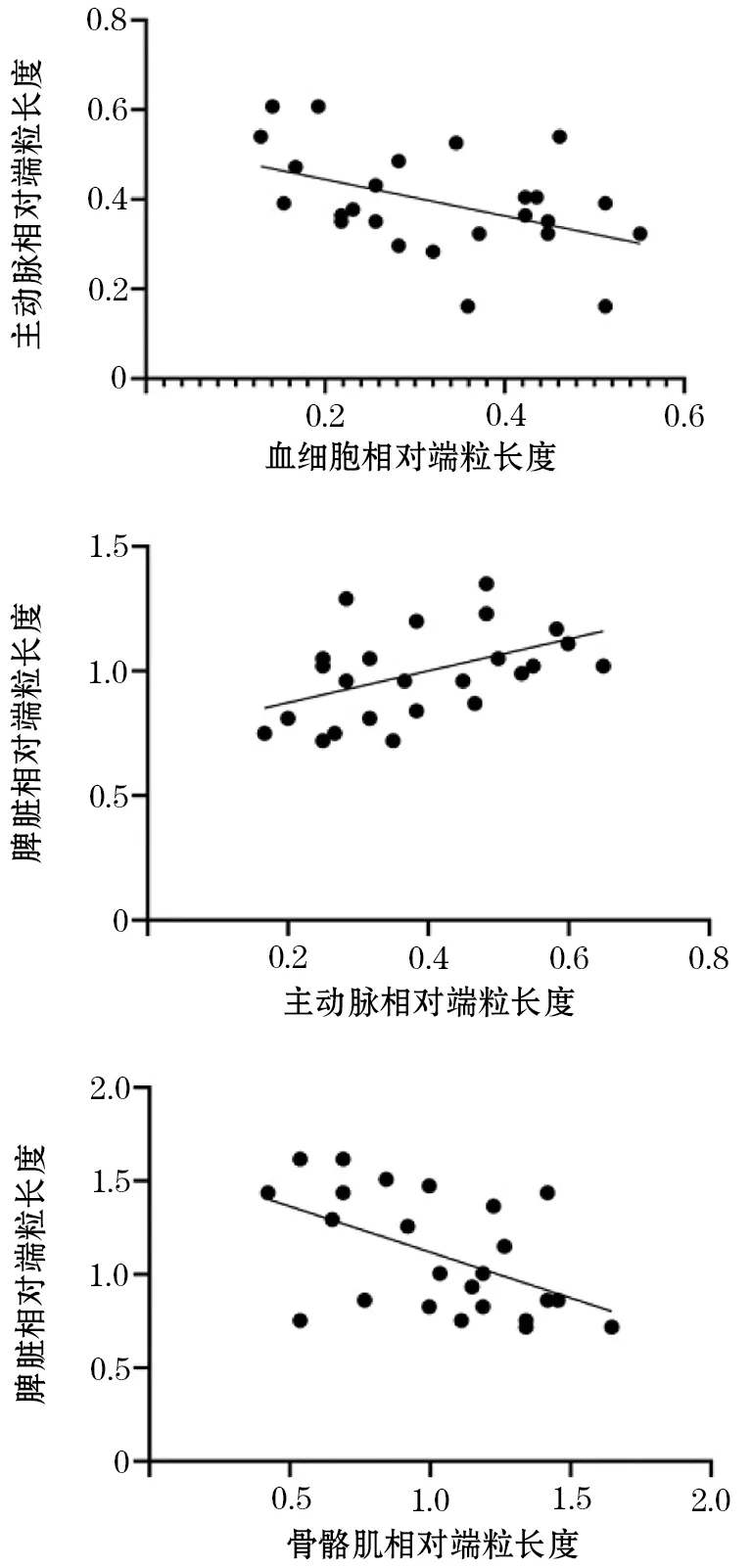
2.3 IA组大鼠组织间端粒长度相关性 IA组大鼠外周血与主动脉端粒长度呈负相关,差异有统计学意义(=-0.45,<0.05);主动脉与脾脏端粒长度呈正相关(=0.47,<0.05),差异均有统计学意义。IA组大鼠各组织间端粒长度的相关性比较可见,仅脾脏和肌组织端粒长度呈负相关(=-0.515,<0.05,图1)。
2.4 IA组大鼠组织端粒长度与IA大小的相关性 各部位组织中的,仅心肌组织端粒长度与IA大小呈正相关(=0.585,=0.014,图2)。主动脉及外周血液细胞与IA大小无显著相关性(<0.05)。

3 讨 论
端粒长度的调控主要是由端粒酶和端粒结合蛋白共同发挥作用而完成的。当受到外界损伤时,端粒长度可发生动态变化,并调控细胞的凋亡。既往有研究发现端粒在IA的发病中可能发挥重要作用,但脑血管组织端粒长度的测量在临床中难以实现,且哺乳动物体内不同组织的端粒长度也不尽相同,端粒长度的变化与IA的大小是否存在相关性有待进一步探讨。胚层是产生各种组织器官的物质基础,其中血管组织就由中胚层发育而来,中胚层主要由动物极内卷细胞形成。皮肤中的真皮层、骨骼以及肌肉所构成的运动系统、循环系统(包括血液、淋巴器官、骨髓、心脏和血管)、生殖系统、排泄系统和内脏器官的外部结缔组织等均由中胚层发育而来。故本实验选取了心肌组织、主动脉组织、血液、脾组织、肾组织、骨骼肌组织及皮肤组织进行研究。
本研究发现,IA组血液中端粒长度显著缩短,这可能是由于在高血压、高同型半胱氨酸血症、血流动力学改变、低雌激素水平等因素的综合作用下,机体的氧化应激水平得到了显著升高,这将带来过量的氧自由基,过多的氧自由基可将端粒重复序列TTAGGG的5’-端的G碱基氧化成7,8-二氢-8氧鸟嘌呤,进而直接影响端粒酶与端粒的结合,使端粒酶活性下降,同时血液中细胞更新速度较快,使得损伤因素加速了有丝分裂中的细胞端粒长度的不断缩短。实验还发现IA组心肌细胞中端粒长度显著延长,可能是由两方面原因造成,一是炎症和氧化应激激活了端粒修复系统。机体氧化应激水平虽可以部分抑制端粒酶的活性,但同时也可能激活了端粒-端粒酶系统的修复功能,在它的帮助下使端粒酶活性大幅代偿性增高,进而掩盖了抑制部分的作用。二是心肌细胞中,细胞有丝分裂程度较低。既往研究发现,哺乳动物的心肌细胞在正常情况下,出生后不久即会因为体内某些细胞周期蛋白依赖性激酶抑制剂的活性增强,促细胞分裂周期因子下调,使得心肌细胞成为终末分化有丝分裂后细胞,失去有丝分裂能力。例如人类的心肌细胞则在出生后3到6个月后逐渐停止有丝分裂,并主要停滞于G0期,仅在心肌细胞损伤发生后,例如心力衰竭或心肌梗死患者体内,可见心肌分裂指数显著提高。结果显示,IA组大鼠的主动脉端粒长度显著长于对照组,这与心肌端粒长度变化趋势一致。可能原因除了上述的端粒损伤-修复系统失衡外,可能还与细胞自身功能有关。研究发现,细胞中存在一个维持细胞稳定和凋亡的最佳端粒长度,端粒过长可导致本该凋亡的基因缺陷细胞继续存活,同样会导致染色体的不稳定和遗传异常。
各组织中端粒长度的相关性分析可见,在对照组中端粒长度呈显著相关性的组织,却在IA组中无显著相关性,端粒长度在对照组中无显著相关性的脾脏和骨骼肌组织,在IA组中却呈负相关。这表明在不利因素的影响下,不同的组织中端粒长度的变化也各不相同。这与Kesäniemi等的研究结果类似,其发现暴露在切尔诺贝利核电站附近高环境背景辐射水平中可导致田鼠肝脏和睾丸中端粒长度的缩短,但是对脑组织、卵巢和心肌细胞中端粒长度的影响却无统计学意义。这可能是由于端粒除了受端粒酶的影响外,其长度的稳态还受多种途径调节,例如重组介导的端粒交替延长等,但其中具体机制尚不清楚。由此可见关于端粒长度在不同疾病及不同组织中变化的研究结果并不一致,这可能与端粒复杂的损伤-修复系统有关,具体机制仍有待于进一步探索。
端粒长度与IA大小相关性研究发现,血液和主动脉端粒长度变化虽然与IA的形成相关,但与IA的大小无关,提示外部不利环境对血液和主动脉端粒的影响程度与对IA的影响程度并不一致。研究表明,无合并症的IA患病率约为3.2%,平均年龄为50岁,但每年动脉瘤性蛛网膜下腔出血的发病率约为6-16/10万,绝大部分动脉瘤最终都不会破裂,特别是小动脉瘤。大部分动脉瘤在经过数年的发展,机体会通过在动脉壁形成大量的胶原增生,使血管壁的抗张强度得到显著提升,从而促进IA的稳定。但外周血白细胞却始终处于不断地更新中,炎症、氧化应激等不利因素在细胞的有丝分裂过程中会对端粒造成持续的影响,使端粒长度不断缩短。主动脉中包含血管内皮细胞和血管平滑肌细胞,虽然其也处于不断的自我更新之中,在有丝分裂时会受到不利因素的影响,但其更新速度远慢于血细胞,在端粒损伤-修复系统的作用下,不利因素的持续刺激也会使端粒酶、端粒结合蛋白等端粒修复因子代偿性增高,使其受损的端粒得到一定修复,即端粒长度处于动态调节过程,虽最终呈现为端粒长度的延长,但并非线性的增加,故与IA的尺寸未能呈线性相关。而心肌细胞的端粒长度,与IA的大小呈正相关,这可能与心肌细胞自身特性有关。虽然损伤因素可对全身细胞造成影响,但是心肌细胞几乎不进行有丝分裂,在端粒结合蛋白的保护下,损伤因素对端粒造成的影响很小,反而是端粒修复系统的激活可使端粒长度缓慢增加,从而出现了端粒延长的现象。
综上所述,本实验通过构建IA大鼠模型,检测了若干不同组织中端粒长度的变化,及其与IA大小的相关性,发现端粒长度的变化存在组织特异性,且端粒在IA的发生及发展中扮演重要角色,但是具体机制仍有待于进一步探索。
