茶多酚对农杆菌介导的植物遗传转化体系的影响
2022-08-27李晶林彩容黄艳邓旭铭王艺清孙威江
李晶,林彩容,黄艳,邓旭铭,王艺清,孙威江*
茶多酚对农杆菌介导的植物遗传转化体系的影响
李晶1,3,4,林彩容1,3,4,黄艳2,3,4,邓旭铭1,3,4,王艺清1,3,4,孙威江1,3,4*
1. 福建农林大学园艺学院,福建 福州 350002;2. 福建农林大学安溪茶学院,福建 泉州 362400;3. 福建省茶产业工程技术研究中心,福建 福州 350002;4. 海峡两岸特色作物安全生产省部共建协同创新中心,福建 福州 350002
为研究在农杆菌介导的茶树遗传体系中,茶多酚对农杆菌侵染效率的影响,以LBA4404、EHA105、ATCC15834和K599 4个农杆菌菌株为研究对象,分析其在不同浓度茶多酚处理下的耐酚能力、被膜完整率、吸附性、和基因表达,以及遗传转化差异。结果显示,4个菌株的耐酚能力依次为LBA4404>K599>EHA105>ATCC15834,其中EHA105和ATCC15834菌株对茶多酚较为敏感;ATCC15834菌株被膜完整率与茶多酚的浓度、静置时间呈负相关,EHA105在600 mg·L-1茶多酚处理48 h后,其被膜完整率最低;ATCC15834和EHA105对烟草叶肉细胞的吸附能力随着茶多酚浓度的升高而降低,在经茶多酚处理24 h后,ATCC15834中和EHA105中的表达受到显著抑制,表达量与低浓度酚类的敏感性呈正相关性;烟草经农杆菌菌液(含茶多酚)侵染后,瞬时转化效率和稳定转化效率均受到不同程度的抑制,发状根诱导率大大降低。1 000 mg·L-1茶多酚处理后,ATCC15834的发根诱导率最低,仅为13.85%,坏死率高达33.85%。综上所述,茶多酚会降低农杆菌活力和被膜完整率,基因通过降低表达量影响其吸附性,最终导致烟草转化体系中瞬时转化效率和稳定转化效率均受到不同程度的抑制。
茶多酚;农杆菌介导;吸附性;和基因;遗传转化
茶多酚是茶叶中多酚类物质的总称,其主要成分包括黄烷醇类(以儿茶素类化合物为主)、花色苷类、黄酮类、黄酮醇类和酚酸类等[1-2]。茶多酚作为一种广谱、强效、低毒的抗菌药物,对革兰氏阳性菌和革兰氏阴性菌均有明显抑制作用[3-4]。有研究报道,茶多酚对12个细菌类群近百种细菌具有抑制作用,其抑菌能力与浓度呈正相关[5-9]。
农杆菌()为根瘤菌科农杆菌属革兰氏阴性细菌,在农杆菌介导的遗传转化体系中,多酚类物质在植物遗传转化中具有重要的作用。低浓度多酚类物质可作为化学趋化剂,吸引农杆菌向植物细胞移动,并激活农杆菌基因表达系统[10-12],提高如小麦[13],水稻[14]等作物遗传转化率。在特定浓度范围内,多酚类物质在茶树遗传转化体系中扮演抑菌剂的作用,主要有3个原因:(1)多酚会在一定范围内抑制农杆菌的趋化作用,阻止农杆菌进入植物伤口,影响农杆菌与植物细胞之间的吸附性[15-22];(2)多酚会抑制农杆菌的生长活力,并使基因表达受到抑制、vir蛋白被沉淀等;(3)多酚类物质的氧化作用会产生一种深褐色的聚合物,导致组织培养中外植体褐化、坏死[23]。以上可能是茶多酚影响茶树转化效率低的主要原因。
在茶树的遗传转化体系中,前人对农杆菌菌株展开了相关研究。宋大鹏[24]研究发现,农杆菌在愈伤组织提取液中能正常生长;在茶鲜叶提取液中,根癌农杆菌GV3101和发根农杆菌ATCC15834活力受到影响,使得、和基因表达受到明显抑制,这种抑制作用来自于鲜叶中的儿茶素类物质。毛清黎等[25]研究发现,儿茶素对发根农杆菌R1000有抑制作用。仓梅芹等[26]通过研究A4和R12556等4个农杆菌菌株的茶多酚耐受性,发现它们在未添加茶多酚的培养基上,培养36 h内均呈现对数生长,而不同浓度茶多酚对农杆菌的生长抑制效果存在显著性差异。
本研究选取根癌农杆菌(EHA105、LBA4404)和发根农杆菌(K599、ATCC15834),检测茶多酚对农杆菌生长活力的影响,并从中选取敏感度高的菌株进一步研究茶多酚对其被膜完整性、吸附性以及相关基因表达量的影响,探讨茶多酚对农杆菌介导的遗传转化体系的作用机制。在农杆菌介导的茶树遗传转化体系中,本研究旨在为茶树品种(适宜的茶多酚含量)、菌株的选择提供理论依据,为茶树分子生物学育种提供理论基础。
1 材料与方法
1.1 试验材料
茶多酚(纯度≥99%),购于上海易恩化学技术有限公司。烟草种子来源于福建农林大学海峡联合研究院基因组中心,采用氯气消毒法,播种至1/2 MS培养基,25℃,每天光照12 h,培养至长出6~8片真叶。
农杆菌菌株采用根癌农杆菌EHA105、LBA4404,发根农杆菌K599、ATCC15834;其中菌株EHA105、LBA4404、K599、大肠杆菌DH5为本实验室保存,菌株ATCC15834由安徽农业大学赵剑教授提供。双元表达载体pBI121,携带GUS基因,为本实验室保存;原核广宿主表达载体为pBBR1MCS2-Tac-EGFP,携带eGFP标记基因,抗生素类型均为卡那霉素,购买于湖南丰晖生物科技有限公司。
YP固体培养基:酵母提取物5 mg·L-1,蛋白胨10 mg·L-1,NaCl 10 mg·L-1,琼脂12 mg·L-1,pH 7.0,121℃灭菌20 min。
YMB培养基:酵母提取物1 mg·L-1,甘露醇10 mg·L-1,K2HPO40.5 mg·L-1,MgSO4·7H2O 0.2 mg·L-1,NaCl 0.1 mg·L-1,pH 7.0,121℃灭菌20 min。
1.2 试验方法
1.2.1 农杆菌的活化与菌液制备
农杆菌活化:将相应农杆菌划线于含抗生素的YP固体培养基中,利福平(Rifampicin,Rif)质量浓度为25 mg·L-1,加入对应的抗生素质量浓度均为50 mg·L-1,28℃恒温箱中暗培养2 d,用无菌接种环挑取单克隆于YP液体培养基中,28℃恒温摇床,200 r·min-1振荡培养再次活化至菌液浑浊,用移液枪取出1 000 μL菌液,加入100 mL YP液体培养基,继续培养至OD600为0.6~0.8。
菌液的制备:将活化好的农杆菌菌液,于10 000离心15 min,去除上清液后用侵染液(1/2 MS+0.20 g·L-1酸水解酪蛋白+10 g·L-1蔗糖+0.5 g·L-1MES)重悬,分别加入质量浓度为200、400、600、800 mg·L-1和1 000 mg·L-1的茶多酚,对照1加入等体积无菌水,对照2用含相应茶多酚的侵染液代替(不含农杆菌),总体积为50 mL,室温静置1 h,用于侵染烟草叶盘。
1.2.2 农杆菌抑制率的测定
在含有不同浓度茶多酚的YMB培养基中加入活化好的农杆菌菌液,起始浓度的OD600=0.05,分别在3、6、9、12、18、24、30、36、48、60 h取1 mL菌液,以含对应浓度茶多酚的YMB培养基为参比,测定600 nm处吸光值,光程为1 cm。处理设3个重复。记录其生长曲线,并根据生长曲线计算茶多酚对农杆菌的抑菌率,公式如下:
茶多酚对农杆菌的抑制率=(1-处理组OD600/对照组OD600)×100%
1.2.3 pBBR1MCS2-Tac-mCherry原核表达载体构建
将pBBR1MCS2-Tac-EGFP载体用EcoRⅠ和PvuⅠ核酸酶进行酶切回收;再根据相关片段设计引物将Tac启动子和mCherry片段进行PCR扩增,最后用Infusion试剂盒连接pBBR1MCS2骨架、tac启动子和mCherry片段。采用冻融法将上述连接产物转入大肠杆菌感受态中,通过菌落PCR鉴定阳性菌落,双酶切验证后,再挑取阳性菌落进行测序验证。
1.2.4 农杆菌细胞被膜完整性的测定
按1.2.1章节方法活化并用茶多酚处理ATCC15834和EHA105农杆菌,于室温静置1、24 h和48 h后分别取样。用LIVE/DEAD BacLight试剂盒测定农杆菌细胞被膜完整性,用多功能酶标仪测定红荧光值:激发波长为485 nm,测定发射波长为530 nm处荧光强度(Emission 1,绿色);保持激发波长为485 nm不变,测定激发波长为630 nm处荧光强度(Emission 2,红色)。并绘制标准曲线,计算出菌液中农杆菌的被膜完整率。
1.2.5 农杆菌与烟草叶肉细胞之间吸附性的测定
共培养方法:将烟草置于不同菌液中侵染10 min,然后取出并用无菌滤纸吸干多余菌液,背面朝上平铺于共培养培养基上,22℃暗培养一定时间后取出,置于杜氏磷酸盐缓冲液(D-PBS)中,洗去游离农杆菌,随机选取3个叶盘制备临时装片。
处理1:将烟草叶片置于含有EHA105-pBBR1MCS2-Tac-EGFP和ATCC15834-pBB R1MCS2-Tac-EGFP的菌液,按照上述方法暗培养48 h。
处理2:将烟草叶片置于含有EHA105-pBBR1MCS2-Tac-mCherry和ATCC15834-pBBR1MCS2-Tac-mCherry的菌液(菌液含茶多酚),按照上述方法暗培养24 h后取出,用侵染液清洗两遍;再分别用含EHA105-pBBR1M CS2-Tac-EGFP和ATCC15834-pBBR1MCS2-Tac-EGFP的菌液再次侵染。
使用激光共聚焦显微镜分别观察处理1和处理2的红绿色荧光农杆菌在烟草细胞外围分布情况。
1.2.6 农杆菌DNA的提取与反转录
菌株采用EHA105-pBI121和ATCC15834-pBI121。将烟草叶片置于菌液中侵染10 min,取5 mL菌液,用于农杆菌RNA提取。将烟草按照1.2.5章节的方法进行共培养后,加入新的D-PBS,加入数滴吐温-20并剧烈涡旋,将附着在烟草叶肉细胞上的农杆菌洗脱;收集上清液,用于农杆菌RNA提取。
每个处理重复3次。采用trizol-up法进行RNA提取,反转录采用全式金生物有限公司TransScript®II All-in-One First-Strand cDNA Synthesis SuperMix for qPCR(One-Step gDNA Removal)试剂盒完成,cDNA保存于–20℃,稀释50倍使用。
1.2.7 农杆菌基因及基因表达检测
以农杆菌cDNA为模板,农杆菌基因组为内参基因,采用全式金生物有限公司PerfectStartTMGreen qPCR SuperMix试剂盒对部分基因进行实时荧光定量PCR检测,测定EHA105和ATCC15834部分基因和基因表达情况,数据结果取3次技术重复平均值。
1.2.8 不同农杆菌介导的烟草瞬时转化和烟草遗传转化
将烟草叶片分别放入含有EHA105-pBI121和ATCC15834-pBI121菌液中,对照1用无菌水,对照2用含茶多酚的侵染液,侵染5 min后,22℃暗培养2 d。
将经过EHA105-pBI121菌液培养的烟草用无菌水清洗两遍,加入GUS染液,37℃黑暗过夜孵育,用75%乙醇脱叶绿素,叶绿素脱去后拍照。
将经过ATCC15834-pBI121菌液培养的烟草用含500 mg·L-1头孢噻肟钠的MS液体培养基浸泡20 min,无菌水清洗2遍,无菌滤纸吸干后置于1/2MS+300 mg·L-1特美汀+300 mg·L-1头孢噻肟钠固体培养基上进行脱菌培养,每7 d转接1次,直至无明显菌落形成,2周后统计外植体发状根和坏死率。
2 结果与分析
2.1 茶多酚浓度对菌株抑制率的影响
农杆菌的活性与茶多酚的浓度和培养时间有关。由表1可知,茶多酚对根癌农杆菌LBA4404和EHA105的抑制率总体呈现随茶多酚浓度的升高而上升的趋势,随培养时间延长呈现先上升后下降的趋势。LBA4404在培养3 h时,抑制率均为负值,且抑制率随着茶多酚浓度的升高而升高,说明此时茶多酚对LBA4404起促进作用。但随着茶多酚浓度的升高,促进作用逐渐减小。在3~9 h时间段,茶多酚对EHA105的抑制率明显大于对LBA4404的抑制率;EHA105在3~6 h的抑制率与茶多酚浓度和培养时间呈正相关,在9 h时出现了抑制率下降的情况;在12 h时,相同浓度的茶多酚对LBA4404的抑制率大于EHA105。
对发根农杆菌ATCC15834和K599抑制率总体随着茶多酚浓度的升高而升高;随着培养时间的延长先升高后降低,对ATCC15834的抑制率在培养9 h后开始下降,迟于K599。培养6 h后,对ATCC15834的抑制率均大于对K599的抑制率。

表1 茶多酚对农杆菌抑制率的影响
注:同一菌株在相同时间下的比较,不同小写字母表示0.05差异显著
Note: Comparison of the same strain at same time, different lowercase letters indicate significant difference (<0.05)
2.2 不同农杆菌对茶多酚耐受性比较
前期试验发现,本研究中的4种农杆菌在不同浓度的茶多酚培养基中培养60 h时基本处于平台期,细胞增长个数已趋于稳定,因此选取培养时间为60 h的农杆菌测定其在茶多酚不同浓度下的耐受性。由图1可知,在不同浓度茶多酚处理下,不同菌株的生长差异显著。LBA4404菌液浓度随茶多酚浓度的升高,整体变化相对较小,对茶多酚耐受性最强。ATCC15834在200 mg·L-1茶多酚处理下,菌液浓度显著高于其他处理组;茶多酚质量浓度为400~800 mg·L-1时,菌液浓度变化差异不显著;K599和EHA105在1 000 mg·L-1茶多酚处理下菌液浓度显著高于对照组和其他处理组。以上结果表明,LBA4404和K599对茶多酚有较强的耐受能力,EHA105和ATCC15834对茶多酚较为敏感。因此,选取ATCC15834和EHA105进行后续试验。
2.3 茶多酚对农杆菌细胞被膜完整性的影响
测定ATCC15834和EHA105菌株的绿、红色荧光值,计算农杆菌的被膜完整率,结果表明,农杆菌细胞被膜的完整性与茶多酚浓度和静置时间高度相关。
如图2所示,静置1 h时,ATCC15834的被膜完整率与对照组无显著差异;EHA105被膜完整率在200、400 mg·L-1和600 mg·L-1处理组与对照组存在显著差异。静置24 h,ATCC15834和EHA105的对照组被膜完整率显著高于处理组,且ATCC15834的被膜完整率随茶多酚浓度升高而降低,EHA105则呈现先升高后降低的趋势。静置48 h时,ATCC15834的对照组和处理组被膜完整率均大幅降低;对照组高于处理组且处理组的被膜完整率随茶多酚浓度升高而降低,差异显著;EHA105的对照组与处理组被膜完整率也大幅下降,对照组显著高于处理组。

注:同一菌株在不同茶多酚浓度之间的比较,不同小写字母表示P<0.05差异显著

注:同一时间不同小写字母表示P<0.05差异显著。下同
2.4 茶多酚对农杆菌与烟草叶肉细胞吸附性的影响
激光共聚焦结果表明(图3),茶多酚浓度对农杆菌烟草叶肉细胞的吸附量影响显著。共培养48 h时(处理1),ATCC15834与EHA105相比,绿色荧光更多,说明其在烟草细胞壁外附着量更高;ATCC15834和EHA105的绿色荧光随着茶多酚浓度的升高而减少,说明其吸附能力随着茶多酚浓度的升高而降低。
ATCC15834和EHA105共培养24 h,清除茶多酚后再培养24 h(处理2),如图3所示,农杆菌可重新吸附到烟草细胞壁上(绿色荧光);随着茶多酚浓度升高,红色荧光减少,而去除茶多酚后,农杆菌可重新吸附到烟草细胞壁外,且农杆菌吸附量(绿色荧光)与对照相比呈现出更高的吸附能力。
2.5 茶多酚对chv基因表达的影响
如图4所示,ATCC15834经茶多酚处理1 h后,随茶多酚浓度的升高表达量升高,、、和表达量呈现先升高后降低的趋势,表达量呈现先下降后上升的趋势;、、、和在800 mg·L-1茶多酚处理中出现最高的表达量,且显著高于对照组;在所有处理组中的表达量均高于对照组,且在茶多酚质量浓度为400 mg·L-1时表达量最高;而在所有处理组中的表达量显著低于对照组。共培养24 h后,在200 mg·L-1茶多酚处理下的、、和表达量显著高于对照组和其他处理组,400、600 mg·L-1和800 mg·L-1茶多酚处理下的、、和表达量差异不显著;表达量在茶多酚质量浓度为800 mg·L-1时达到最高,600 mg·L-1和1 000 mg·L-1茶多酚处理组显著低于其他组;基因在1 000 mg·L-1茶多酚处理组表达量显著高于对照组,而对照组表达量显著高于其他处理组。
EHA105经茶多酚处理1 h后,和的表达量低于对照组;在400 mg·L-1茶多酚处理下,基因表达量显著高于对照组和其他处理组;在200 mg·L-1和400 mg·L-1茶多酚处理下,基因表达量也显著高于对照组和其他处理组。共培养24 h后,随茶多酚浓度升高,和等7个基因表达量先升高后降低,和在200 mg·L-1茶多酚处理下,表达量达到最高值,则在400 mg·L-1茶多酚处理下表达量达到最高值;800 mg·L-1和1 000 mg·L-1茶多酚处理下,基因与对照组差异不显著,而和基因的表达量显著低于对照组。
上述结果表明,不同菌株同一基因对茶多酚的反应不同,同一菌株不同基因对茶多酚的反应也不同,且表达变化与时间和茶多酚浓度呈现出显著相关性。

图3 茶多酚对EHA105、ATCC15834与烟草叶片细胞之间吸附性的影响

图4 茶多酚对农杆菌EHA105和ATCC15834 chv基因表达量的影响
2.6 茶多酚对vir基因表达的影响
如图5所示,EHA105经茶多酚处理1 h后,随茶多酚浓度升高,、和所有处理组的表达量均显著低于对照组,与对照组表达量差异不显著;、、、、和呈现先升后降的趋势,均显著高于对照组。共培养24 h后,在所有茶多酚处理组中,和表达量均显著高于对照组,均显著低于对照组。
ATCC15834中,菌液经茶多酚处理1 h后,茶多酚处理组、、、、、、和基因表达量高于对照组,和表达量显著低于对照组。共培养24 h后,茶多酚处理组中、、、、、、、和表达量低于对照组,表达量高于对照组;在200 mg·L-1茶多酚处理组中,其表达量显著低于其他组;在800 mg·L-1茶多酚处理组中表达量显著高于对照组,其他处理组显著低于对照组;在800 mg·L-1处理组表达量显著高于对照组,而在其他处理组中的表达量均低于对照组(图6)。
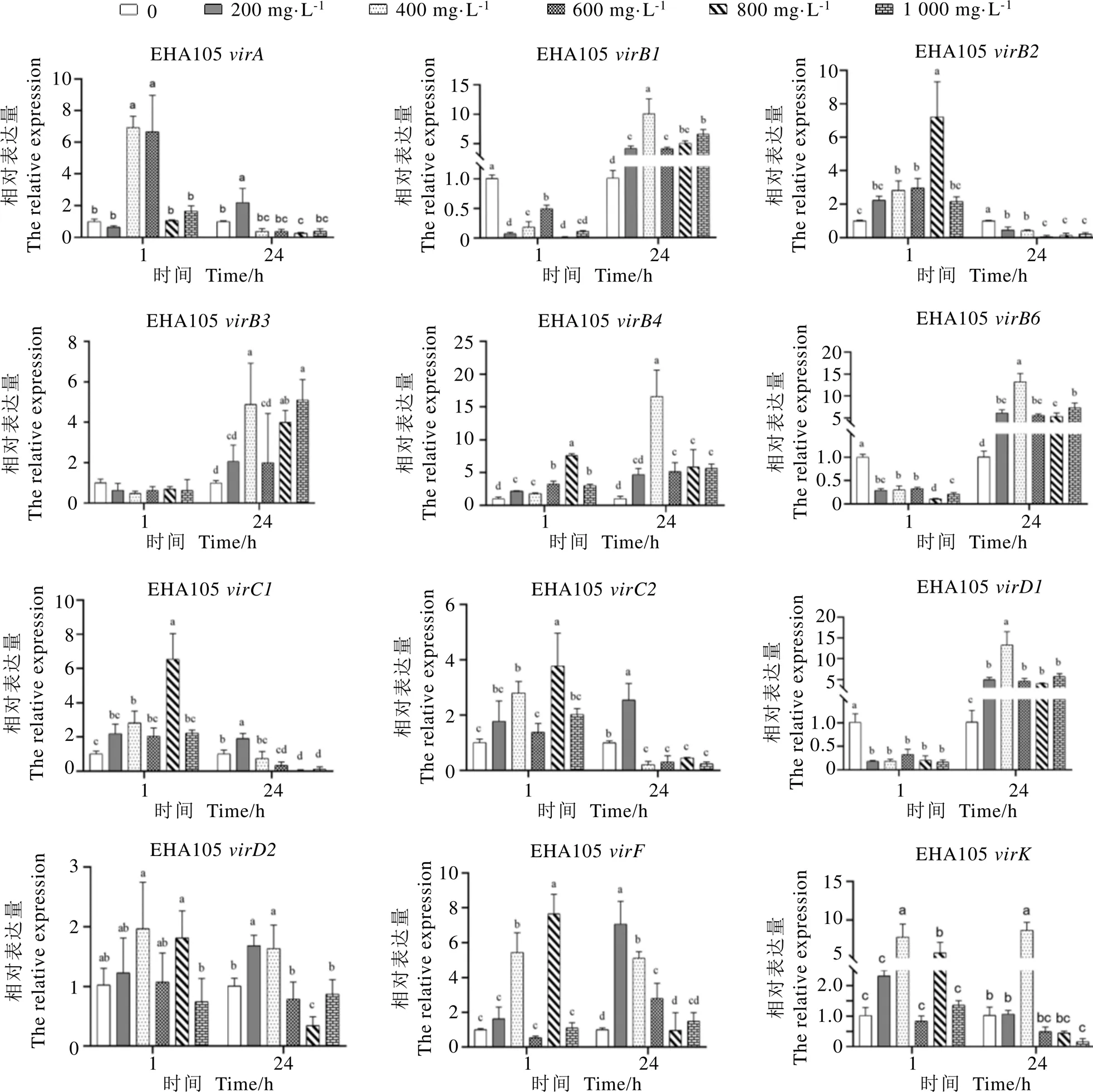
图5 茶多酚对EHA105 vir基因表达量的影响
2.7 EHA105和ATCC15834介导的烟草转化
为探明茶多酚对农杆菌介导植物遗传转化效率是否有影响,通过GUS染色检验烟草叶片瞬时转化效果。如图7所示,在共培养3 d后,茶多酚处理组的烟草叶盘切口处出现褐变,且随茶多酚浓度升高,褐变程度加重,并在1 000 mg·L-1茶多酚处理下出现坏死,而对照组叶盘保持绿色,无黄化或褐变产生;本研究发现含不同浓度茶多酚的菌悬液均可侵染烟草,GUS染色均呈现阳性。与对照组相比,处理组随茶多酚浓度升高,染色程度变浅。
采用含不同浓度茶多酚的菌悬液侵染烟草叶盘,共培养后转移至无激素的1/2 MS培养基中诱导发状根,并统计2周后的发状根诱导率和坏死率。结果如表2所示,ATCC15834发状根诱导率随茶多酚浓度升高而降低,而坏死率随茶多酚浓度升高而增加;在1 000 mg·L-1茶多酚处理后,发根诱导率仅为13.85%、坏死率达33.85%。

图7 茶多酚对农杆菌EHA105介导的烟草瞬时转化GUS染色的影响
3 讨论
本研究分析了不同茶多酚浓度对4个菌株的抑菌率,挑选出两个对茶多酚较为敏感的菌株ATCC15834和EHA105,并对茶多酚浓度影响两个菌株的机理进行了深入的探讨。前人研究表明,低浓度多酚类物质可作为化学趋化剂,吸引农杆菌向植物细胞移动,并激活农杆菌基因表达系统。本研究发现,EHA105和K599在茶多酚质量浓度为0~200 mg·L-1时生长受到抑制,在200 mg·L-1以上时出现耐酚性增长。低浓度茶多酚的界值是一个相对模糊的概念,不同菌株对茶多酚的敏感度不同,产生偏差是正常的。此外,在不同茶多酚浓度下细胞生长速率会受到不同程度的抑制,细胞的死亡速率也有所差异,OD值也会受到这两方面因素的影响。
通过茶多酚对ATCC15834和EHA105菌株被膜完整性的研究发现,农杆菌的被膜完整性与茶多酚的浓度和培养时间有关,与前人研究结果一致[27-29]。不同浓度茶多酚处理下,EHA105变化规律不明显,ATCC15834较为敏感,在培养1 h时就与对照组出现了显著的差异。生物被膜的反应机制较为复杂,涉及多种信号因子的调控。多酚类物质可以通过与细菌外膜螯合,释放脂多糖从而破坏细菌膜结构的完整性[28],本研究中ATCC15834和EHA105菌株的被膜完整性表现出对茶多酚不同的响应,推测是不同菌株的胞外多糖差异的原因所造成的。
农杆菌介导法的转化效率受vir蛋白的影响。vir蛋白参与T-DNA的加工、转移和整合等过程,而吸附过程与基因有关。Sharma等[30]用儿茶素类提取物进行抑菌试验,发现儿茶素会抑制表皮葡萄球菌、黄体微球菌、短杆菌、荧光假单胞菌和枯草芽孢杆菌的生长,且最小抑菌浓度会显著抑制细菌与绿猴肾上皮细胞之间的吸附性。本研究证实了茶多酚能显著抑制农杆菌对烟草细胞的吸附作用,抑制效率与茶多酚浓度呈正相关。农杆菌附着植物细胞时,起关键作用的是细胞表面的多聚糖,等基因均会影响农杆菌对植物细胞的附着与识别,茶多酚处理24 h后,ATCC15834中和EHA105中的表达量受到显著抑制,因此可能是由于的编码产物-1,2葡聚糖合成受到阻碍,导致农杆菌的吸附能力降低。一方面,在不同农杆菌菌株之间的表达模式不尽相同,会导致不同菌株对酚类物质和受体细胞感知的敏感差异性;另一方面,糖类物质的含量与对低浓度酚类的敏感性呈正相关性[31],经茶多酚处理后,不同菌株在糖类物质含量上的差异,也是影响农杆菌对茶多酚敏感性差异的原因之一。
烟草转化体系的侵染液加入茶多酚,不同程度的抑制瞬时转化效率和稳定转化效率,发状根诱导率大大降低,烟草叶片出现了发黄、褐变的症状。随茶多酚浓度升高,整个外植体黄化,坏死率不断上升,外植体再生性受到抑制,导致烟草遗传转化效率下降。有研究表明,植物细胞受到的伤害主要包括侵染前需人为制造的机械损伤和后续来自农杆菌的伤害,而植物受到伤害后,抗氧化酶系统被激活,促进酚类物质的合成和积累,提高抵抗力,但多酚类物质易被多酚氧化酶氧化成醌类物质,进而抑制细胞的生命活动,造成组织褐变、坏死[32]。
本研究通过分析农杆菌对茶多酚耐受性、茶多酚对农杆菌细胞被膜完整性和细胞吸附性、基因和基因表达的影响以及茶多酚对根癌农杆菌EHA105和发根农杆菌ATCC15834介导的烟草转化效率的影响,为农杆菌介导的茶树遗传转化体系提供了一定的理论基础,为进一步提高茶树遗传转化效率做了深入的探讨。
[1] 仝佳音, 杨毅坚, 杨方慧, 等. 紫娟茶花青素对“三高”的影响及其开发利用[J]. 安徽农业科学, 2018, 46(10): 39-41.
Tong J Y, Yang Y J, Yang F H, et al. Influence of anthocyanins of Zijuan tea on hypertension, hyperlipidemia and hyperglycemia and its development and utilization [J]. Journal of Anhui Agricultural Sciences, 2018, 46(10): 39-41.
[2] 潘卫仓. 茶多酚的功效及提取工艺研究进展[J]. 甘肃科技, 2011, 27(15): 57-58.
Pan W C. Research Progress on the efficacy and extraction technology of tea polyphenols [J]. Gansu Science and Technology, 2011, 27(15): 57-58.
[3] Cabrera C, Gimenez R, Lopez M C. Determination of tea components with antioxidant activity [J]. Journal of Agricultural and Food Chemistry, 2003, 51(15): 4427-4435.
[4] Chan E W C, Soh E Y, Tie P P, et al. Antioxidant and antibacterial properties of green, black, and herbal teas of[J]. Pharmacognosy Research, 2011, 3(4): 266-272.
[5] Souissi M, Ben Lagha A, Chaieb K, et al. Effect of a berry polyphenolic fraction on biofilm formation, adherence properties and gene expression of streptococcus mutans and its biocompatibility with oral epithelial cells [J]. Antibiotics, 2021, 10(1): 46. doi: 10.3390/antibiotics10010046.
[6] 李柯欣. 茶多酚的提取、抑菌作用与抑菌机理研究[D]. 成都: 西华大学, 2017.
Li K X. Study on extraction, bacteriostasis and bacteriostatic mechanism of tea polyphenols [D]. Chengdu: Xihua University, 2017.
[7] Bhattacharya A, Sood P, Citovsky V. The roles of plant phenolics in defence and communication duringandinfection [J]. Molecular Plant Pathology, 2010, 11(5): 705-719.
[8] Matsumoto S, Fukui M. Effect of acetosyringone application on-mediated gene transfer in tea plant () [J]. Bulletin of the National Research Institute of Vegetables, Ornamental Plants and Tea (Japan), 1999(14): 9-15.
[9] Mondal T, Bhattacharya A, Ahuja P, et al. Transgenic tea [(L.) O. Kuntze cv. Kangra Jat] plants obtained by-mediated transformation of somatic embryos [J]. Plant Cell Reports, 2001, 20(8): 712-720.
[10] 耿立召, 刘传亮, 李付广. 农杆菌介导法与基因枪轰击法结合在植物遗传转化上的应用[J]. 西北植物学报, 2005, 25(1): 205-210.
Geng L Z, Liu C L, Li F G. Application of the combination of-mediated transformation and particle bombardment in plant genetic transformation [J]. Acta Botanica Boreali-Occidentalia Sinica, 2005, 25(1): 205-210.
[11] 张海平. 棉花转基因体系的优化和抗黄萎病基因的转化[D]. 杭州: 浙江大学, 2008.
Zhang H P. Optimization of cotton transformation system and the transformation of resistant gene to[D]. Hangzhou: Zhejiang University, 2008.
[12] 刘水平. 野生茄子托鲁巴姆黄萎病抗性相关基因功能鉴定[D]. 南京: 南京农业大学, 2011.
Li S P. Functional analysis ofgene related toresistance [D]. Nanjing: Nanjing Agricultural University, 2011.
[13] 叶兴国, 陈明, 杜丽璞, 等. 小麦转基因方法及其评述[J]. 遗传, 2011, 33(5): 422-430.
Ye X G, Chen M, Du L P, et al. Description and evaluation of transformation approaches used in wheat [J]. Hereditas, 2011, 33(5): 422-430.
[14] 尹中朝, 李宝健, 施骏, 等. 存在水稻中新型农杆菌毒性区基因的信号分子[J]. 科学通报, 1995, 40(12): 1126-1128.
Yin Z C, Li B J, Shi J, et al. There are signaling molecules for genes in the toxic region of novelin rice [J]. Chinese Science Bulletin, 1995, 40 (12): 1126-1128.
[15] Bhattacharya A, Sood P, Citovsky V. The roles of plant phenolics in defence and communication duringandinfection [J]. Molecular Plant Pathology, 2010, 11(5): 705-719.
[16] Cabrera C, Gimenez R, Lopez M C. Determination of tea components with antioxidant activity [J]. Journal of Agricultural and Food Chemistry, 2003, 51(15): 4427-4435.
[17] Chan E W C, Soh E Y, Tie P P, et al. Antioxidant and antibacterial properties of green, black, and herbal teas of[J]. Pharmacognosy Research, 2011, 3(4): 266-272.
[18] 杨海伦, 刘小香, 朱军莉, 等. 茶多酚的抗菌特性研究进展[J]. 食品工业科技, 2015, 36(21): 385-389.
Yang H L, Liu X X, Zhu J L, et al. Research progress in antibacterial properties of tea polyphenols [J]. Science and Technology of Food Industry, 2015, 36(21): 385-389.
[19] Sharma A, Gupta S, Sarethy I P, et al. Green tea extract: possible mechanism and antibacterial activity on skin pathogens [J]. Food Chemistry, 2012, 135(2): 672-675.
[20] 陈琛, 徐尤美, 蔺蓓蓓, 等. 秦岭绿茶茶多酚抑菌活性及其机理研究[J]. 四川农业大学学报, 2019, 37(6): 821-827.
Chen C, Xu Y M, Lin B B, et al. Antibacterial activity and mechanism of green tea polyphenols from qinling mountains [J]. Journal of Sichuan Agricultural University, 2019, 37(6): 821-827.
[21] Gonzalez-Rivera C, Khara P, Awad D, et al. Two pKM101-encoded proteins, the pilus-tip protein TraC and Pep, assemble on the Escherichia coli cell surface as adhesins required for efficient conjugative DNA transfer [J]. Molecular Microbiology, 2019, 111(1): 96-117.
[22] Matthysse A G. Attachment ofto plant surfaces [J]. Frontiers in Plant Science, 2014, 5: 252. doi: 10.3389/fpls.2014.00252.
[23] 王戈亮. 植物油脂积累机理和品质改良: 1.利用RNAi改良大豆油脂品质;2.四合木茎积累三脂酰甘油特征[D]. 北京: 中国科学院植物研究所, 2007.
Wang G L. Vegetable oil accumulation mechanism and quality improvement: 1. The improvement of soybean oil quafity using RNAi; 2. Triacylglycerols in stems of[D]. Beijing:Institute of Botany, the Chinese Academy of Sciences, 2007.
[24] 宋大鹏. 儿茶素对农杆菌介导的茶树遗传转化的影响[D]. 合肥: 安徽农业大学, 2014.
Song D P. Effects of catechins on-mediated gene transformation of[D]. Hefei: Anhui Agricultural University, 2014.
[25] 毛清黎, 施兆鹏, 李玲, 等. 茶叶儿茶素对发根农杆菌的抑制作用及抗酚菌株筛选研究[J]. 茶叶科学, 2007, 27(3): 243-247.
Mao Q L, Shi Z P, Li L, et al. Study on inhibitation ofby tea catechin and screening of anti-polyphenol strain [J]. Journal of Tea Science, 2007, 27(3): 243-247.
[26] 仓梅芹, 周健, 成浩, 等. 几种农杆菌的耐酚性能比较与驯化研究[J]. 茶叶科学, 2008, 28(3): 189-194.
Cang M Q, Zhou J, Cheng H, et al. Studies on polyphenol-resisting characteristics of several kinds ofand the demestication of polyphenol-resisting strain [J]. Journal of Tea Science, 2008, 28(3): 189-194.
[27] Alshuniaber M A, Krishnamoorthy R, Alqhtani W H. Antimicrobial activity of polyphenolic compounds fromagainst food-borne bacterial pathogens [J]. Saudi Journal of Biological Sciences, 2021, 28(1):459-464.
[28] Kuo C Y, Zupko I, Chang F R, et al. Dietary flavonoid derivatives enhance chemotherapeutic effect by inhibiting the DNA damage response pathway [J]. Toxicology and Applied Pharmacology, 2016, 311: 99-105.
[29] 姜鹏.sp.QY101胞外多糖的分离纯化及抗细菌生物被膜活性研究[D]. 山东: 中国海洋大学, 2011.
Jang P. The studies on isolation, purification and antibiofilm activities of the exopolysaccharide fromsp. QY101 [D]. Shandong: Ocean University of China, 2011.
[30] Sharma A, Gupta S, Sarethy I P, et al. Green tea extract: possible mechanism and antibacterial activity on skin pathogens [J]. Food Chemistry, 2012, 135(2): 672-675.
[31] 王根平, 张婷, 师志刚, 等. 农杆菌T-DNA传递相关基因研究进展[J]. 分子植物育种, 2017, 15(5): 1752-1761.
Wang G P, Zhang T, Shi Z G, et al. Research progress on T-DNA transfer related genes mediated of[J]. Molecular Plant Breeding, 2017, 15(5): 1752-1761.
[32] 刘红. 枇杷花药愈伤组织诱导及褐化机理和控制方法研究[D]. 成都: 四川农业大学, 2016.
Li H. Studies on callus induction and mechanism of browning and control methods in loquat [D]. Chengdu: Sichuan Agricultural University, 2016.
Effects of Tea Polyphenols on-mediated Plant Genetic Transformation System
LI Jing1,3,4,LIN Cairong1,3,4,HUANG Yan2,3,4,DENG Xuming1,3,4,WANG Yiqing1,3,4,SUN Weijang1,3,4*
1. College of Horticulture, Fujian Agriculture and Forestry University, Fuzhou 350002, China; 2. Anxi College of Tea Science, Fujian Agriculture and Forestry University, Quanzhou 362400, China; 3. Fujian Tea Industry Engineering Technology Research Center, Fuzhou 350002, China; 4. Ministerial and Provincial Joint Innovation Centre for Safety Production of Cross-Strait Crops, Fujian Agriculture and Forestry University, Fuzhou 350002, China
In order to study the effect of tea polyphenols on the infection efficiency ofin tea plant genetic system mediated by, fourstrains LBA4404, EHA105, ATCC15834 and K599 were used as research objects. The phenolic resistance, membrane integrity, adsorption,gene andgene expression and genetic transformation ofunder different concentrations of tea polyphenols were analyzed. The results show that: (1) the phenolic resistance of the four strains followed the order of LBA4404>K599>EHA105>ATCC15834, and EHA105 and ATCC15834 were more sensitive to tea polyphenols. (2) The ratio of ATCC15834 with intact membrane was negatively correlated with the concentration of tea polyphenols and the standing time, and the lowest intact membrane rate of EHA105 appeared 48 h after treatment with 600 mg·L-1tea polyphenols. (3) The adsorption capacities of ATCC15834 and EHA105 on tobacco mesophyll cells decreased with the increase of tea polyphenol concentrations. After treatment with tea polyphenols for 24 h, the expressions ofandin ATCC15834 and EHA105 were significantly inhibited. The expression ofwas positively correlated with the sensitivity to low concentration phenols. (4) After infecting tobacco by thesolution (containing tea polyphenols), the transient and stable transformation efficiencies were inhibited to varying degrees, and the induction rate of hairy roots was greatly reduced. When the concentration of tea polyphenols was 1 000 mg·L-1, ATCC15834 achieved the lowest root induction rate of 13.85% and the highest necrosis rate of 33.85%. In conclusion, tea polyphenols could reduce the activity and membrane integrity rate of, and reduce the expression ofgene to affect its adsorption, which finally suppress the instantaneous conversion efficiency and the stable conversion efficiency in tobacco conversion system to varying degrees.
tea polyphenol,-mediated, adsorbability,andgene, genetic transformation
S571.1
A
1000-369X(2022)04-477-14
2021-12-30
2022-03-29
国家自然科学基金(31770732)、福建省高校产学合作项目(2019N5007)、福建主要茶类原产地溯源与标准体系研究(K1520005A04)、福建张天福茶叶发展基金会科技创新基金(FJZTF01)
李晶,女,硕士研究生,主要从事茶树栽培育种与生物技术研究。*通信作者:swj8103@126.com
