腹腔镜下胃癌D2根治术联合射频消融在胃癌肝转移患者中的临床应用
2022-08-27梁维仁陆轶民王海勇
文/梁维仁,陆轶民,王海勇
胃癌成为当前癌症中发病率和病死率较高的疾病之一,并且随着人民日常生活习惯与饮食习惯的变化,导致该疾病新增发病率只增不减。处于胃癌晚期的患者大部分会存在远处转移,从而增加病死率,其中以肝脏转移较为常见,且大部分进展期胃癌患者到院治疗后均已发生肝转移,增加临床治疗难度。现如今,临床针对该疾病患者暂无标准治疗方式,而胃癌肝转移主要根据转移灶与原发灶分布情况、大小以及肿瘤数量等分为可切除和不可切除两类。大量研究报道显示,针对胃癌肝转移患者开展治愈性手术治疗是可行的,其中肝转移灶局部治疗联合胃癌D2根治术能够确保患者肝功能恢复至正常状态。然而部分研究人员经临床研究证实,常规开腹手术对患者创伤较大,同时影响术后快速康复,部分患者术后还伴有不同程度的并发症,从而降低整体疗效。随着国内医疗技术水平的持续发展,为了探寻更加适合胃癌肝转移患者的治疗方案,临床开始推行腹腔镜手术和局部消融治疗。经治疗后,患者病情得到改善且安全性高。射频消融治疗属于经皮微创手术,在胃癌肝转移灶的局部治疗中疗效显著。鉴于此,本研究分析临床收治的确诊胃癌肝转移患者在选择治疗方式过程中,以射频消融联合腹腔镜下胃癌D2根治术为主治疗效果,内容如下。
1 资料与方法
1.1 一般资料
研究病例选取根据手术方式对纳入的60例确诊胃癌肝转移患者实施分组,时间为2021年5月11日至2022年1月16日,所有患者均接受肝转移瘤射频消融治疗,对照组与观察组在此基础上分别行开腹胃癌D2根治术(30例)与腹腔镜下胃癌D2根治术(30例)。对照组(男/女=18/12),年龄范围44~65岁,平均(58.04±4.28)岁。观察组(男/女=17/13),年龄范围47~66岁,平均(58.22±4.40)岁。两组资料比较差异无统计学意义(P> 0.05)。
纳入标准:(1)患者在完全自愿情况下签署《手术治疗知情同意书》;(2)生存期经过预测在3个月及以上;(3)单发转移灶或多发转移灶直径分别在5cm及以下,且局限在半肝内;(4)患者肝脏储备功能可耐受手术;(5)无手术禁忌证。
排除标准:(1)伴有严重贫血或心脑血管疾病;(2)伴有胃出血或溃疡;(3)伴有胆管癌栓或肝内外血管癌栓;(4)伴有凝血功能障碍或全身传染病;(5)参与本研究前存在放化疗史。
1.2 方法
对照组:术前调整患者体位,使其保持仰卧位,实施全麻处理,切口选择腹部正中左绕脐20cm长。将网膜依次切开,同时对皮下组织进行游离处理,使肿瘤完全暴露在视野中。对胃网膜右动脉进行分离与结扎后将癌灶切除,清扫D2淋巴结,重建消化道。术后,对患者实施常规冲洗、创口缝合以及必要的抗感染治疗。术后3~4d再实施射频消融治疗,引导装置选择彩色多普勒超声诊断仪,将其频率调整为4~5MHz范围内,治疗系统选择RITA150OX射频消融系统。在彩超引导下在肿瘤位置放置探头,随后按照最初拟定治疗计划行消融干预,在治疗时彻底清除肿瘤,同时查看瘤体改变情况,消融时间控制为小于15min/次。
观察组:对该组患者均开展腹腔镜下胃癌D2根治术,实施全麻后使用Trocar穿刺患者脐下大约20mm位置,并将其作为本次手术观察孔,建立气腹,保证气压维持在15mmHg左右,操作孔则分别为由Trocar穿刺左上腹以及右上腹,在腹腔镜引导下观察胃癌和四周组织具体解剖结构,胃网膜左静脉、右静脉和根部均以超声刀完成切断工作,将大网膜彻底切除,对胃左右动静脉、胃网膜右动静脉、脾动脉及肝总动脉行游离、切断处理,随后彻底清扫D2淋巴结,并在患者上腹行5cm正中切口,进入患者腹腔以后,对十二指肠残端进行清理,将远端胃切除,随后完成毕式吻合重建消化道,术后射频消融治疗以及抗感染治疗与对照组一致。
1.3 观察指标
(1)生活质量:使用《生活质量综合评定问卷》评分,分数越高生活质量评分越高。
(2)肿瘤标志物:记录癌胚抗原(CEA)及甲胎蛋白( AFP)水平差异,以酶联免疫吸附试验完成检测工作。
(3)免疫指标:记录外周血中免疫细胞CD4+、CD8+和CD4/CD8水平差异,检测采用贝克曼流式细胞仪完成。
(4)胃肠功能:记录患者腹胀、排气与腹部疼痛消失时间。
(5)各项临床指标:记录住院时间、手术时间及术中出血量。
(6)安全性:记录发生术后肠梗阻、吻合口瘘及切口感染情况。
1.4 统计学方法

2 结果
2.1 生活质量水平对比
术前两组多项生活质量分值对比,差异无统计学意义(P>0.05);术后观察组多项生活质量分值显著偏高,差异有统计学意义(P< 0.05),见表1。
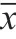
表1 两组患者手术前后生活质量水平对比(±s,分)
2.2 肿瘤标志物对比
术前两组多项肿瘤标志物水平对比,差异无统计学意义(P> 0.05);术后观察组多项肿瘤标志物水平显著偏低,差异有统计学意义(P < 0.05),见表2。

表2 两组患者手术前后肿瘤标志物对比(±s)
2.3 免疫指标对比
术前两组多项免疫指标水平对比,差异无统计学意义(P>0.05);术后观察组免疫指标水平显著偏高,除CD8+指标偏低,差异有统计学意义(P < 0.05),见表3。
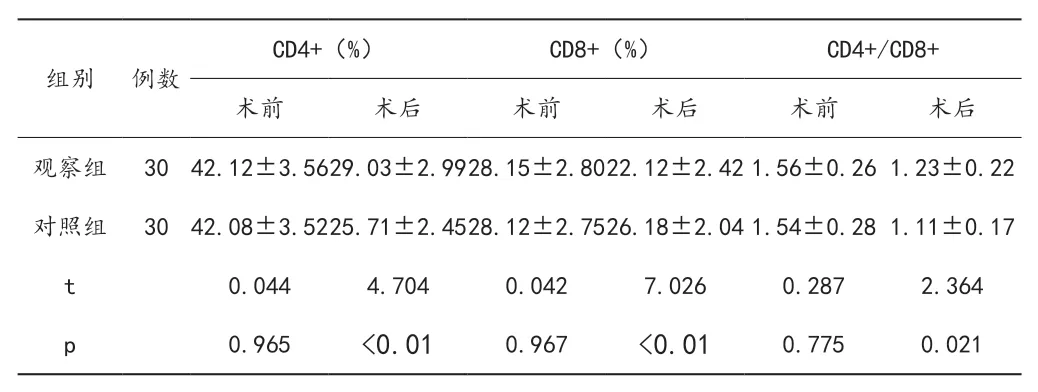
表3 两组患者手术前后免疫指标对比(x±s)
2.4 胃肠功能对比
术后观察组多项胃肠功能指标显著偏低,差异有统计学意义(P < 0.05),见表4。
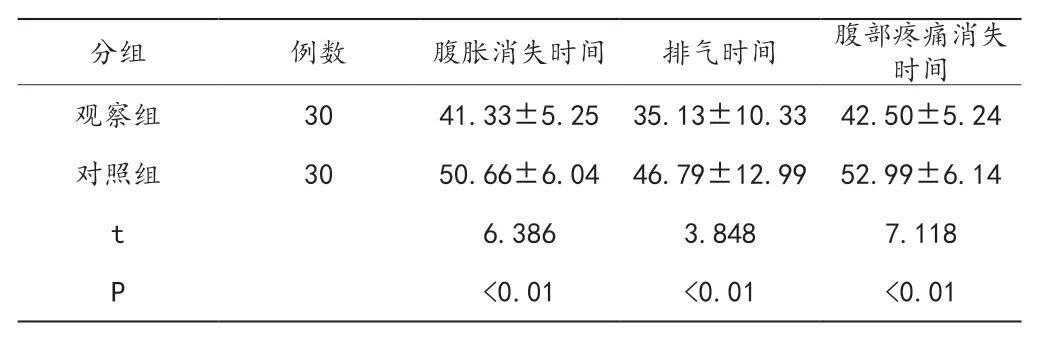
表4 两组患者胃肠功能对比(x±s,h)
2.5 临床指标对比
术后观察组多项临床指标显著偏低,差异有统计学意义(P<0.05),见表5。
表5 两组患者临床指标对比(x±s)
2.6 安全性对比
两组总并发症发生情况比较,观察组偏低,差异有统计学意义(P < 0.05),见表6。
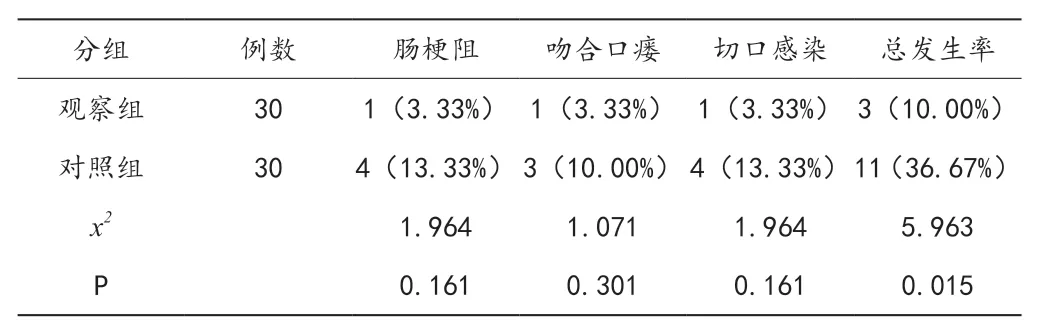
表6 两组患者安全性对比[n(%)]
3 讨论
在肿瘤疾病中胃癌发病率较高,并且早期阶段无明显症状,极易被忽视,当到院治疗时已处于中晚期阶段,增加临床治疗难度。据调查发现,处于晚期阶段胃癌病灶通常伴有多途径转移,其中肝转移最为常见。以往临床针对肝转移首选射频消融术治疗,疗效显著。
在部分胃癌肝转移患者外周血中AFP属于核心标志物,而正常群体中肝细胞内该指标不显著,但在肝转移癌细胞中该指标存在高表达。本研究结果显示,术后观察组多项生活质量分值显著偏高,多项肿瘤标志物水平显著偏低(P<0.05)。说明对胃癌肝转移患者实施射频消融术是可行的,同时在此基础上配合腹腔镜下胃癌D2根治术治疗,能够明显降低AFP水平,提高患者生存时间和生存质量。有部分研究者指出,伴有胃癌肝转移患者通常属于多发病灶,同时影响肝脏多叶,还有少数患者存在远处转移,经胃切除手术治疗后无法根治。而经过消融术联合胃癌D2手术治疗,可提高患者生存期和生活质量。但是,常规开腹胃癌D2根治术时,需要对腹内组织进行切除,同时还要大范围游离,对患者创伤较大,不利于病情康复。而腹腔镜胃癌D2手术属于微创术,对患者影响小,可将癌灶彻底清除。本研究结果显示,术后观察组免疫指标水平显著偏高(除CD8+指标偏低)(P<0.05)。说明开展射频消融术联合腹腔镜下胃癌D2根治术治疗胃癌肝转移患者能够有效改善免疫功能,促使患者术后快速康复。术后观察组多项胃肠功能指标显著降低,多项临床指标显著降低(P<0.05)。说明射频消融术联合腹腔镜下胃癌D2根治术,促使患者胃肠功能快速恢复,同时缩短患者治疗时间,减轻患者治疗痛苦,促使患者早日康复出院。比较两组总体并发症发生情况,观察组显著偏低(P<0.05)。说明与射频消融术联合常规胃癌D2根治术相比,射频消融术联合腹腔镜下胃癌D2根治术更适合应用于胃癌肝转移患者,能够有效降低并发症发生率,保障患者治疗安全性。
总之,对胃癌肝转移患者实施射频消融术的同时还需配合腹腔镜下胃癌D2根治术,对患者造成创伤小,安全性高,可促使患者免疫功能和肿瘤标志物水平明显改善,提升患者术后生活质量,促使患者病情快速康复。
