NSGA-II 遗传算法结合响应面法优化桦褐孔菌活性成分提取工艺
2022-08-27云浩程于繁华牛华周侯万超李赛男刘春明张语迟
云浩程,于繁华,程 杜,刘 震,牛华周,侯万超,李赛男, ,刘春明, ,张语迟
(1.长春师范大学中心实验室,吉林长春 130032;2.长春师范大学计算机科学与技术学院,吉林长春 130032)
桦褐孔菌(),又名白桦茸、黑桦菌、桦菌等,属于真菌门、担子菌亚门、层菌纲、非褐菌目、多孔菌科、褐卧孔菌属,主要分布在北纬40~50°地区,在预防和治疗癌症、心脏病、胃病和食道病等方面起到独到效用且无任何毒副作用,因此引起科研工作者的关注,目前国内外对于桦褐孔菌的研究主要集中在其多糖类成分,而对其中三萜类和黄酮类有效成分提取研究较少。三萜、黄酮类化合物具有显著的生物活性,三萜类化合物具有调节血压、降低胆固醇、抑制病毒增殖等作用;黄酮类化合物在抗氧化、防治心脑血管疾病、增强免疫力等方面具有明显作用。
桦褐孔菌活性成分的传统提取工艺主要有回流提取法、微波提取法、沉淀吸附法等,但以上方法存在得率较低、耗时耗能的不足,而酶解法提取效率高、无污染;超声提取法在液体介质中具有良好穿透性,可以产生扩散击碎,增强溶剂渗透力等作用,提高得率缩短时间、同时避免了高温对有效成分生物活性的影响,因此本文选取超声辅助酶法对桦褐孔菌中总三萜、黄酮进行提取。
目前在桦褐孔菌三萜类和黄酮类成分提取工艺的相关研究主要是针对其单一类成分进行提取,通常采用正交试验或响应面法设计优选提取工艺,以上方法虽能快速地筛选出既定范围内最优工艺,但却只能在有代表性的因素水平点组合进行试验,存在局部优化精确度低,只能优化单一目标提取工艺的缺点。NSGA-II 多目标遗传算法是目前被公认较为先进的多目标进化优化算法,通过引入快速非支配排序的精英策略,使它具有强大的全局搜索能力能更有效地求得模型全局最优解,因此本研究采用NSGAII 遗传算法结合响应面对桦褐孔菌的提取工艺进行优化,弥补了响应面法只能分别对单一目标最优提取方案进行预测的不足,达到同时提高食品中多种有效成分得率、降低研究成本的目的。
本文以桦褐孔菌为研究对象,采用超声辅助酶法提取桦褐孔菌中的三萜、黄酮类化合物,在单因素实验的基础上采用NSGA-II 多目标遗传算法结合响应面优选最佳提取工艺,从而为后续有效成分活性研究、分离纯化以及功能评价奠定基础。
1 材料与方法
1.1 材料与仪器
桦褐孔菌菌块 吉林省晏达顺参业有限公司,经鉴定为桦褐孔菌(Fr.) Pila 的子实体;实验用水为超纯水 美国Millipore 公司;香草醛 天津市福晨化学试剂厂;纤维素酶(50 U/mg)江苏锐阳生物科技有限公司;芦丁标准品 纯度大于98%,成都普菲德生物技术有限公司;齐墩果酸标准品 纯度大于98%,Sigma 公司;甲醇 色谱纯,美国Thermo Fisher 公司;冰乙酸、高氯酸、亚硝酸钠、硝酸铝、氢氧化钠 分析纯,天津市鑫铂特化工有限公司。
UPLC-Q-Extractive 超高效液相色谱-高分辨质谱联用仪 美国Thermo Scientific 公司;Waters 2695 高效液相色谱仪 美国Waters 公司;Evaluation 600 型紫外-可见分光光度仪 美国Thermo-Scientific 公司;KQ250E 型超声波清洗机 昆山市超声仪器有限公司;Satorius-BSA2202S 分析天平 德国Satorius 公司;DK-98-II 型恒温水浴锅 天津市泰斯特仪器有限公司;GZX-9030MBE 电热鼓风干燥箱上海博迅实业有限公司医疗设备厂;FW177 中草药粉碎机 天津市泰斯特仪器有限公司。
1.2 实验方法
1.2.1 桦褐孔菌总三萜、黄酮的提取工艺 将桦褐孔菌菌块放置干燥箱内65 ℃干燥至恒重后取500 g粉碎机粉碎,过40 目筛得到粗粉,称取桦褐孔菌粗粉1.0 g,置于干燥锥形瓶中,加入20 倍的75%乙醇和占原材料质量1%的纤维素酶,酶解时间为60 min,酶解后在90 ℃温度下水浴10 min 使酶被灭活,再超声提取20 min(超声功率400 W、超声温度24 ℃),经过减压过滤后,收集滤液。
1.2.2 桦褐孔菌总三萜、黄酮的测定
1.2.2.1 对照品溶液的配制 分别称取齐墩果酸、芦丁标准品20.0 mg 置于100 mL 的容量瓶中,分别加入甲醇和75%乙醇超声溶解,稀释至刻度摇匀,即为质量浓度200 μg/mL 的齐墩果酸、芦丁标准品溶液。
1.2.2.2 样品测定及得率计算 利用香草醛-冰醋酸显色法和硝酸铝显色法分别在550、504 nm波长下测定吸光度,将所得吸光度值分别代入齐墩果酸和芦丁标准曲线回归方程,求得溶液中的总三萜、黄酮质量浓度,并且按照下述公式计算出总三萜、黄酮含量。
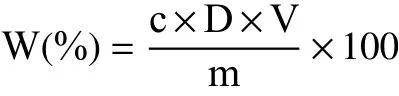
式中:W(%)表示总三萜、黄酮得率;c 表示通过吸光度值计算出的溶液质量浓度,μg/mL;D 表示溶液稀释倍数;V 表示供试品溶液体积,mL;m 表示药材取样量,g。
1.2.3 单因素实验 每组实验均称取1.0 g 桦褐孔菌粉末,根据1.2.1 工艺提取桦褐孔菌中总三萜、黄酮进行单因素实验,考察各因素变量对桦褐孔菌中总三萜、黄酮得率的影响,条件为:固定乙醇浓度为75%,液料比20 mL/g,酶解时间60 min,超声提取时间20 min,考察不同酶添加量(纤维素酶占原材料质量比例)0.5%、1%、1.5%、2%、2.5%对总三萜、黄酮得率的影响;固定乙醇浓度75%,液料比20 mL/g,酶添加量1%,超声提取时间20 min,考察不同酶解时间30、45、60、75、90 min 对总三萜、黄酮得率的影响;固定乙醇浓度75%,酶添加量1%,酶解时间60 min,超声提取时间20 min,考察不同液料比15、20、25、30、35 mL/g,对总三萜、黄酮得率的影响;固定液料比20 mL/g,酶解时间60 min,酶添加量1%,超声提取时间20 min,考察不同乙醇浓度45%、55%、65%、75%、85%对总三萜、黄酮得率的影响。
1.2.4 响应面因素水平设计与试验方法 根据单因素实验结果,分别以酶添加量(A)、酶解时间(B)、液料比(C)、乙醇浓度(D)为考察因素,以桦褐孔菌总三萜、黄酮得率为考察指标,称取桦褐孔菌药材粉末1.0 g,共29 份,按照 Box-Behnken 试验设计方案进行提取,全部试验总计29 组,其中中心点设置为5 组重复实验,用以估计实验误差,其因素水平分析选取见表1。

表1 响应面试验因素水平设计Table 1 Response surface test factor level design
1.2.5 NSGA-II 算法实现步骤 运用R 语言v4.0.2软件,NSGA-II 算法随机产生种群规模大小为N 的父代种群P,然后父代种群P利用交叉变异产生子代种群Q(Q规模大小为N),并通过结合子代Q产生了种群规模大小为2N 的新种群Z,再对种群Z进行快速非支配排序和拥挤度计算,依据个体之间的非支配关系和个体拥挤度的大小,选择合适的个体重新结合并产生新的父代种群P,最后通过传统的遗传算法的基本操作再将P与Q混合一起形成新的种群Zi,重复上述操作,直到满足结束条件。NSGA-II 算法的优化流程如图1 所示。
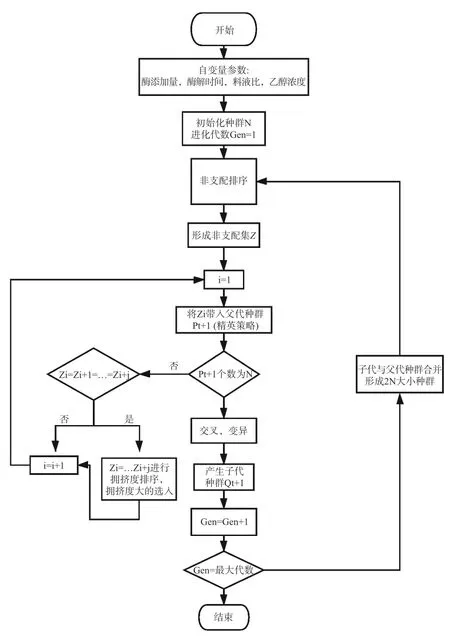
图1 NSGA-II 算法流程Fig.1 NSGA-II algorithm flow
1.2.6 桦褐孔菌提取物中三萜、黄酮类成分含量检测与鉴定
1.2.6.1 三萜、黄酮类成分含量检测液相色谱条件C色谱柱(SunFire,250 mm×4.6 mm,Waters),以甲醇(A)和0.1% HPO水溶液(D)作为流动相,梯度程 序为:0~10 min(10%~30% A),10~15 min(30%~38% A),15~17 min(38% A),17~22 min(38%~42% A),22~40 min(42%~49% A),40~60 min(49%~80% A),60~90 min(80%~100% A);流速0.4 mL/min;进样体积为10.0 μL;检测波长:320 nm;柱温:30 ℃;测定样品:桦褐孔菌提取物。
1.2.6.2 三萜、黄酮类成分液-质联用(UPLC-MS/MS)鉴定条件 UPLC 选择二元线性梯度洗脱:流动相为甲醇(A)和0.1%甲酸水溶液(D),流动相梯度程序:0~10 min(10%~20% A),10~15 min(20%~25% A),15~28 min(25%~36% A),28~43 min(36%~60%A),43~70 min(60%~85% A),70~90 min(85%~90%A);流速:0.3 mL/min;样品进样量:5 μL;检测波长:320 nm;柱温:30 ℃。液相色谱光电二级阵列管检测器通过三通阀和质谱相连接,离子源:电喷雾离子源(ESI);分析模式:正离子模式;扫描范围m/z:150~2000;离子阱条件:离子源喷雾电压4.5 kV,鞘气辅助气为氮气,流速为20 L/min;金属毛细管温度350 ℃,金属毛细管电压3.5 V;测定样品:桦褐孔菌提取物。
1.3 数据处理
应用Design-Expert.V8.0.6.1 软件进行响应面试验设计、方差分析以及二次模型建立,利用R 语言v4.0.2 搭建NSGA-II 模型,作图采用Origin7.5、Visio Professional 2019 软件。多目标优化问题是由多个目标函数组成,多目标优化问题可以表述如下:
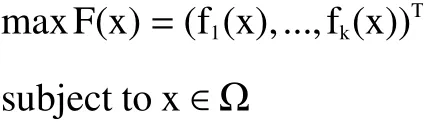
其中Ω 是决策空间,F: Ω→ R由k 个实值目标函数组成,R被称为目标空间。可实现的目标集被定义为集合{ F(x) ∈ Ω},同时NSGA-II 算法引入精英策略,防止在算法运行过程中优秀的Pareto 解流失,通过将父代种群与其产生的子代种群混合后进行非支配排序、拥挤度计算得出下一代种群个体,便能够更好避免父代种群中优秀个体流失。
2 结果与分析
2.1 单因素实验结果
如图2 所示得到酶添加量与总三萜、黄酮得率的关系:得率随着酶添加量增加呈现先升高后下降的趋势,呈现先升高趋势原因是植物组织在纤维素酶的作用下逐渐水解,有利于三萜、黄酮类化合物的释放,从而提高得率,在酶添加量为原料质量的2%时达到峰值,得率下降是因为酶的含量持续增加导致底物分解,底物浓度相对较低,酶与底物触面积减少,并且和底物结构相同的分子与酶的活性中心结合产生了对酶的抑制作用,导致得率降低,经检验酶添加量对总三萜、黄酮得率影响极显著(<0.01)。

图2 酶添加量对总三萜、黄酮得率的影响Fig.2 Effect of enzyme addition on the extraction rate of total triterpenes and flavonoids
如图3 所示得到酶解时间与总三萜、黄酮得率的关系:在酶解时间为30~45 min 得率呈升高趋势,时间为45 min 时得率有显著的提高(<0.05),而在45~90 min 之间,随着酶解反应的进行过长的反应时间会导致溶液三萜、黄酮类化合物发生降解,致使得率逐渐降低,因此酶解时间应控制在45 min 左右较为适宜。经检验酶解时间对总三萜得率影响显著(<0.05),对总黄酮得率极显著(<0.01)。

图3 酶解时间对总三萜、黄酮得率的影响Fig.3 Effect of enzymatic digestion time on the extraction rate of total triterpenes and flavonoids
如图4 所示得到液料比与总三萜、黄酮得率的关系:当液料比为20 mL/g 时总三萜、黄酮得率达到峰值,继续增加提取剂,提取率呈现下降趋势,此现象产生的原因是,起初溶质和溶剂的接触面积随着液料比的增加,提高了有效成分的扩散速度,更有利于桦褐孔菌中有效成分的提取;但提取剂过多时,原料中其他物质也大量溶解在提取剂中,由于液体量增多,浓缩时间增长,损失量增多,导致桦褐孔菌黄酮类化合物得率降低。因此提取工艺的液料比应控制在20 mL/g 左右。经检验液料比对总三萜、黄酮提取率影响极显著(<0.01)。
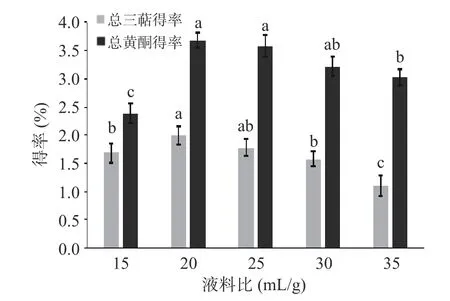
图4 液料比对总三萜、黄酮得率的影响Fig.4 Effect of liquid to material ratio on the extraction rate of total triterpenes and flavonoids
如图5 所示得到乙醇浓度与总三萜、黄酮得率的关系:当乙醇浓度为45%~65%之间,得率随着乙醇浓度增加逐渐增大,其原因是增大乙醇浓度可以促使细胞溶胀,有利于提取剂向细胞内部的渗透,从而提高了总三萜、黄酮的得率,乙醇浓度达到65%时得率达到峰值并与前后水平呈现极显著(<0.01)差异,之后随乙醇浓度的升高得率降低,推测与提取物化学极性大小有关,当提取溶剂极性较小时,提取出更多的杂质,导致提取物占比减少,因此最佳乙醇浓度为65%左右,经检验乙醇浓度对总三萜、黄酮得率影响极显著(<0.01)。
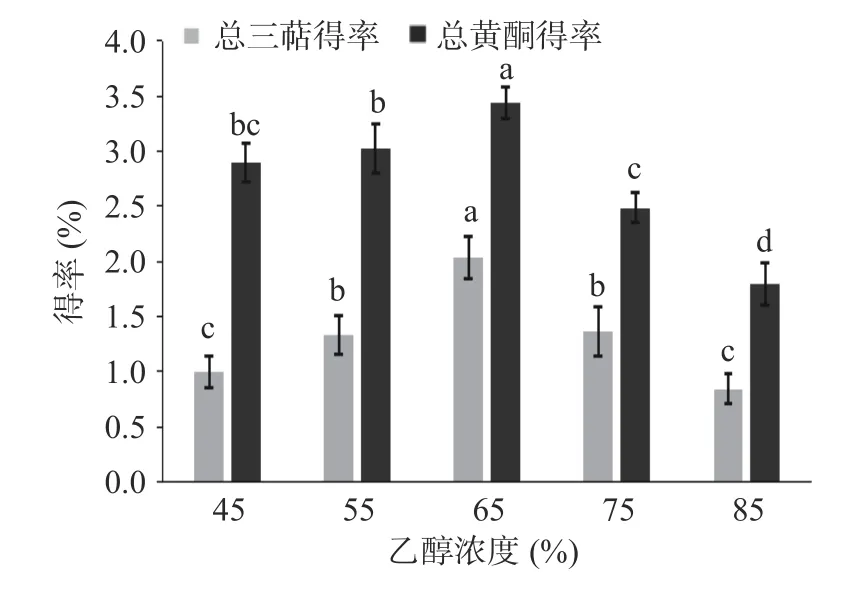
图5 乙醇浓度对总三萜、黄酮得率的影响Fig.5 Effect of ethanol concentration on the extraction rate of total triterpenes and flavonoids
2.2 响应面法优化桦褐孔菌中总三萜、黄酮的提取工艺
2.2.1 响应面回归模型的建立 利用Design-Expert.V8.0.6.1 软件对上述各影响因素设计Box-Benhnken试验,按照响应面试验因素水平设计,共设计29 个试验点,以桦褐孔菌总三萜、黄酮得率为响应值,其中Y为总三萜得率,Y为总黄酮得率,设计方案及实验结果见表2。
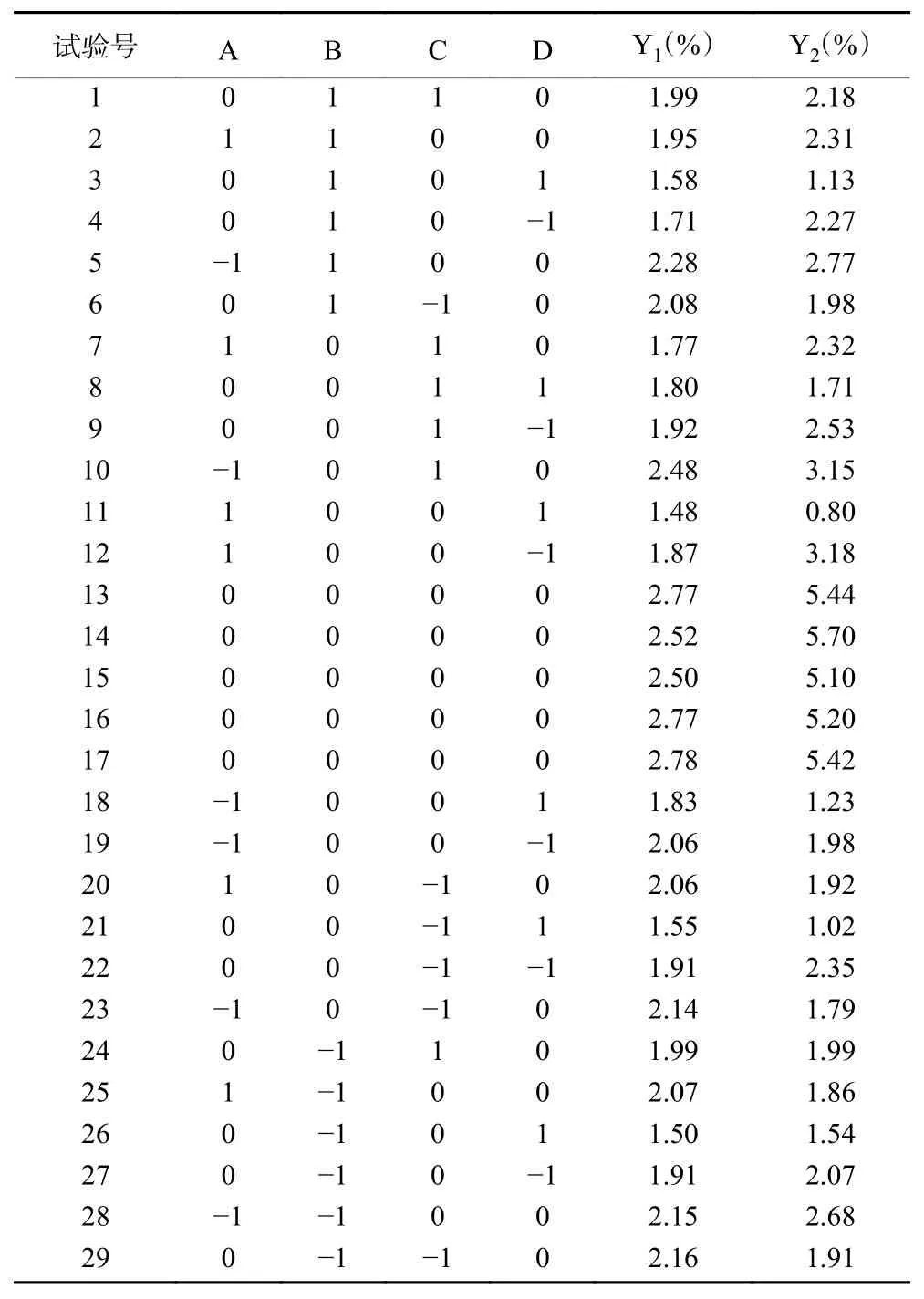
表2 响应面设计试验方案及结果Table 2 Response surface design test protocol and results
利用 Design-Expert.V8.0.6.1 软件对表2 数据进行回归拟合,分别得到以桦褐孔菌总三萜(Y)、黄酮得率(Y)为目标函数的二次多项回归方程:

2.2.2 响应面回归模型显著性检验及分析 由Analysis模块下挑选ANOVA 解析,获得如表3、表4 所示多元回归模型方差分析表,在总三萜、黄酮响应面多元回归模型方差分析中,总三萜模型=23.20,<0.0001、总黄酮模型=32.43,<0.0001,表明以上二次多元回归模型均是极显著的(<0.01);总三萜模型失拟=0.35,=0.9206>0.05、总黄酮模型失拟=2.62,=0.1829>0.05,二者失拟项均不显著(>0.05),表明所选用的二次多项模型的拟合程度良好;总三萜、黄酮模型决定系数分别为=0.9587、=0.9701 证明回归方程有较高的可信度,校正决定系数分别为= 0.9173、=0.9402,说明该模型的拟合程度较好;各因素对桦褐孔菌总三萜得率的影响大小为:酶添加量(A)>乙醇浓度(D)>酶解时间(B)>液料比(C),其中A、D 为极显著因素(<0.01),交互项中AC 对总三萜提取作用为极显著(<0.01);各因素对桦褐孔菌总黄酮得率的影响大小为:乙醇浓度(D)>液料比(C)>酶添加量(A)>酶解时间(B),其中D 为极显著因素(<0.01),C 为显著因素(<0.05),交互项中AD 对总黄酮提取作用为显著(<0.05)。

表3 总三萜响应面多元回归模型方差分析结果Table 3 Results of analysis of variance of total triterpene response surface multiple regression model

表4 总黄酮响应面多元回归模型方差分析结果Table 4 Results of analysis of variance of total flavonoid response surface multiple regression model
2.2.3 响应面交互作用分析 利用Analysis 模块下Model Graphs 选项得到评价各因素交互强度的等高线及响应曲面图。等高线的形状反映出两因素间交互作用的强弱,圆形表示两因素交互作用不显著无促进作用,椭圆形表示交互作用显著存在促进作用,表3、表4 方差分析表明总三萜回归模型交互项AC极显著(<0.01),总黄酮回归模型交互项AD 显著(<0.05),与图6、图7 中交互项AC 和AD 呈椭圆形的等高线图相对应。
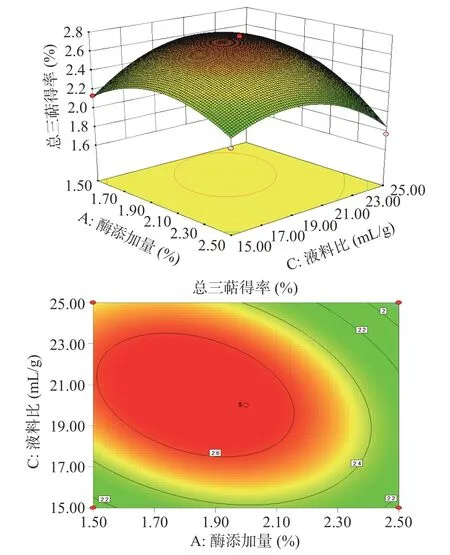
图6 酶添加量(A)与液料比(C)对总三萜得率影响的响应面图和等高线Fig.6 Response surface plots and contours of the effect of enzyme addition and liquid to material ratio on the extraction rate of total triterpenes
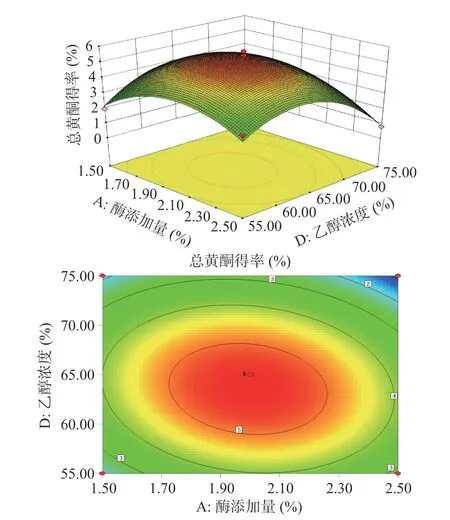
图7 酶添加量(A)与乙醇浓度(D)对总黄酮得率影响的响应面图和等高线Fig.7 Response surface plots and contours of the effect of enzyme addition and ethanol concentration on the extraction rate of total flavonoids
由图6 可知固定酶解时间(B)为45 min,乙醇浓度(D)为65%,总三萜的得率随酶添加量(A)和液料比(C)的增大呈现先增后减的趋势,酶添加量较低时,等高线比较平缓,此时液料比对总三萜的提取量影响不太显著,但酶添加量在2%左右时,等高线排列紧密,液料比对总三萜的提取量有显著影响,且酶添加量(A)对应的曲面坡度较液料比(C)的陡峭,说明酶添加量对总三萜得率的影响程度大于液料比(C),等高线呈椭圆形表示酶添加量(A)和液料比(C)交互作用显著,两因素间存在促进作用,与回归方程中 AC 项方差分析结果(<0.01)极显著相符。
由图7 可知固定酶解时间(B)为45 min,液料比(C)为20 mL/g,总黄酮的得率随酶添加量(A)和乙醇浓度(D)的增大呈现先增后减的趋势,乙醇浓度较低时,等高线比较平缓,此时酶添加量对总三萜的提取量影响不太显著,但乙醇浓度在65%左右时,等高线排列紧密,酶添加量对总黄酮的得率有显著影响,且乙醇浓度对应的曲面坡度较酶添加量的陡峭,说明乙醇浓度(D)对总黄酮得率的影响程度大于酶添加量(A),等高线呈椭圆形表示酶添加量(A)和乙醇浓度(D)交互作用显著,两因素间存在促进作用,与回归方程中AD 项方差分析结果(<0.05)显著相符。根据响应面实验结果,可以清楚的观察各因素对总三萜、黄酮得率影响,但由于响应面只能分别对单一目标最优提取方案进行预测,因此下文2.3 利用NSGA-II 同时对Y、Y回归方程模型进行优化并预测优化方案。
2.3 NSGA-II 优化模型建立与结果分析
2.3.1 NSGA-II 优化模型建立 采用NSGA-II 算法对响应面回归方程进行优化,设定决策变量为A(酶添加量)、B(酶解时间)、C(液料比)、D(乙醇浓度),种群规模为29,迭代次数为200,目标个体数为2。根据真实实验产生初始种群,差分进化产生子代,再进行非支配排序和拥挤距离选择下一代的父代,最终得到Pareto 最优解。建立数学模型如下:

2.3.2 NSGA-II 预测结果分析 利用R 语言求解后得到图8 所示的Pareto 前沿面。
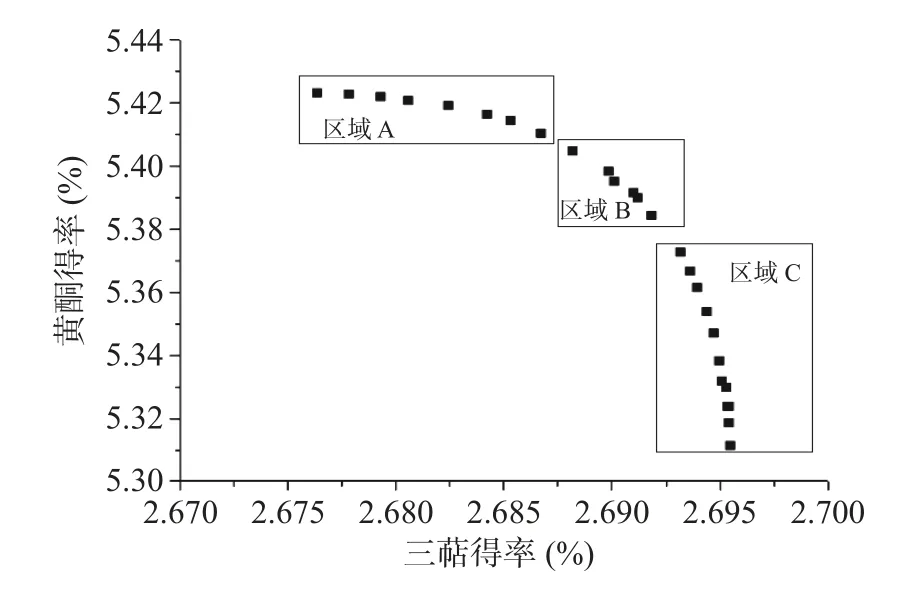
图8 多目标优化模型Pareto 前沿面结果图Fig.8 Pareto front for multiobjective optimization
由图8 可知,在A 区域可获得较高的黄酮得率,但三萜得率并不理想;在C 区域获得的三萜得率较高,但黄酮得率较低。而在B 区域既可得到较高的三萜得率,同时也可获得满意的黄酮得率,为进一步降低提取工艺的成本,既要考虑到桦褐孔菌中三萜类物质具有较高的得率,又要兼顾较优的总黄酮得率,折中考虑选择B 区域方案,表5 为优化模型B 区的域解集。
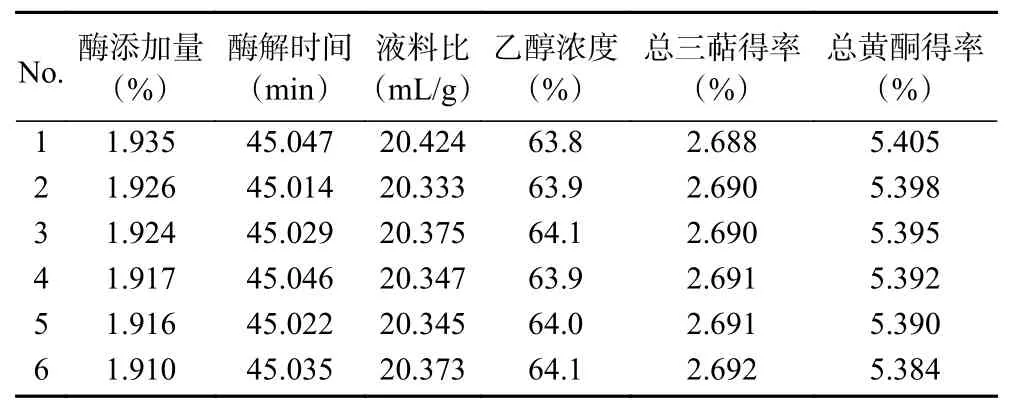
表5 多目标优化模型B 区域Pareto 解集表Table 5 Pareto optimal solutions for optimization B region
2.3.3 NSGA-II 优化结果实验验证 通过表5 根据Pareto 解集B 区域方案预测分析得出最佳提取条件为酶添加量1.92%,酶解时间 45.03 min,液料比20.37 mL/g,乙醇浓度63.97%,该条件下预测得到总三萜、黄酮平均得率分别为2.690%、5.394%,考虑到实际操作的局限性,将实际提取工艺条件修正为酶添加量1.9%,酶解时间45 min,液料比20 mL/g,乙醇浓度64%,进行3 次重复验证试验,实际测得总三萜、黄酮平均得率为2.670%±0.05%、5.356%±0.09%,与预测得率平均值的相对误差为0.75%、0.70%,实测总三萜、黄酮得率RSD 值分别为2.13%、2.24%,实测结果与预测值误差较小,重复试验相对标准偏差较小,验证了NSGA-II 多目标遗传算法优化提取工艺具有可行性。
2.4 应用液-质联用技术鉴定桦褐孔菌中有效成分
采用“1.2.6”项高效液相色谱分离条件,桦褐孔菌提取物中有效成分得到较好的分离,如图9,为桦褐孔菌提取物的高效液相色谱图。采取液相色谱与质谱联用技术对液相色谱中主要化合物色谱峰相对应的质谱数据进行了分析测定,结果如表6 所示。

表6 桦褐孔菌提取物中主要成分的液-质联用分析数据Table 6 LC-MS data of the main components in the extract of Inonotus obliquus
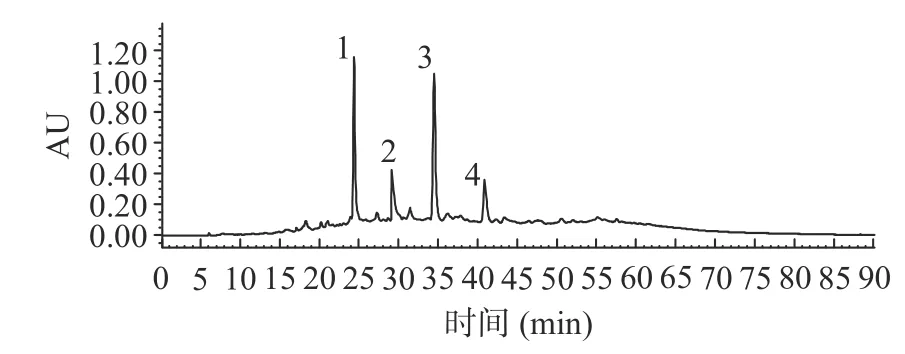
图9 桦褐孔菌提取物取物液相色谱图Fig.9 Chromatograms of extracts of Inonotus obliquus
化合物1 保留时间为24.20 min,正离子模式下其一级质谱出现m/z:443.12[M+H]准分子离子峰,二级质谱主要碎片离子m/z:425.21 [M+H-HO]为该准分子离子脱去1 个HO 分子所产生,m/z:407.23[M+H-2HO]为准分子离子在此基础上再脱去1 分子HO 所产生;m/z:411.16 [M+H-CHOH]离子为准分子离子与-CHOH 裂解所产生,在此基础上再脱掉1 分子HO 从而生成碎片离子m/z:393.15。经液相色谱分析提取物中化合物1 相对百分含量为32.30%,且以上为碎片信息与文献中报道的质谱碎片信息一致,故确定化合物1 为白桦脂醇。
化合物2 保留时间为29.15 min,正离子模式下其一级质谱出现m/z:427.60 [M+H]准分子离子峰,二级质谱主要碎片离子 m/z:412.81 [M+H-CH]为该准分子离子裂解1 个-CH所产生,m/z:395.02 为准分子离子在此基础上脱去1 分子HO 所产生;m/z:315.03 碎片离子则为准分子离子丢失C侧链所产生。经液相色谱分析提取物中化合物2 相对百分含量为10.50%,且以上碎片信息与文献中报道的质谱碎片信息一致,故确定化合物2 为羊毛甾醇。
化合物3 保留时间为34.30 min,正离子模式下其一级质谱出现m/z:179.07 [M+H]准分子离子峰,二级质谱主要碎片离子 m/z:161.06 [M+H-HO]为该准分子离子脱去1 个HO 所产生。m/z:164.03[M+H-CH]为该准分子离子脱去1 个-CH所产生,m/z:137.06 碎片离子为准分子离子在此基础上丢失2'C 侧链所产生。经液相色谱分析提取物中化合物3 相对百分含量为30.99%,且以上碎片信息与文献中报道的质谱碎片信息一致,故确定化合物3 为紫萁酮。
化合物4 保留时间为40.68 min,正离子模式下其一级质谱出现m/z:303.02 [M+H]准分子离子峰,二级质谱主要碎片离子 m/z:285.10 [M+H-HO]为该准分子离子脱去1 分子HO 所产生,m/z:257.01碎片离子为在此基础上失去1 个CO 所产生,m/z:229.06 则为碎片离子m/z:257.01 经重排后再次失去1 个CO 所得到。经液相色谱分析提取物中化合物4 相对百分含量为9.12%,且以上碎片信息与文献中报道的质谱碎片信息一致,故确定化合物4 为槲皮素。
3 结论
本实验在单因素实验基础上,利用响应面法建立了二次多项式模型,通过方差分析证明理论模型拟合较好,得到各因素对总三萜、黄酮得率影响关系,且交互项AC、AD 分别对总三萜、黄酮得率作用显著(<0.05),其次利用NSGA-II 遗传算法结合响应面回归方程对最佳提取工艺进行预测,相对于已有传统提取工艺优化的研究,该方法在搜索过程中不容易陷入局部最优,能更准确地搜索到最佳提取方案,更直观地找出合理工艺参数区间并对多种目标量同时进行预测,预测获得最佳提取工艺:酶添加量1.9%,酶解时间45 min,液料比20 mL/g,乙醇浓度64%,该条件下桦褐孔菌总三萜、黄酮的得率分别为2.670%±0.05%、5.356%±0.09%,进行3 次重复验证试验,结果实测值与理论预测值吻合度较高,表明NSGA-II遗传算法结合响应面优化桦褐孔菌有效成分提取工艺准确可靠、重现性良好,经UPLC-MS/MS 鉴定桦褐孔菌主要包含白桦脂醇、羊毛甾醇、紫萁酮、槲皮素四种有效成分,其相对百分含量分别为32.30%、10.50%、30.99%、9.12%。本研究结果为桦褐孔菌总三萜、黄酮的高效提取提供了工艺路线和工艺参数的数据支撑,而且对一般植物有效成分的提取也具有参考价值,具有同时提高多种有效成分得率,极大降低研究成本的应用价值,为食品现代化、智能化生产提供了新思路。
本研究以超声辅助酶解法为提取方法,利用NSGA-II 遗传算法结合响应面对提取工艺进行优化,同时提高了三萜、黄酮类有效成分的得率,一定程度为桦褐孔菌有效成分的利用提供了理论基础,但未进一步对桦褐孔菌三萜、黄酮类有效成分活性开展深入研究。
